血红蛋白在海胆状WO3微球上的直接电化学性质及对过氧化氢的传感性能研究
2015-12-25段聪越沈婉秋
刘 辉, 郭 凯, 段聪越, 汤 妮, 沈婉秋
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
血红蛋白在海胆状WO3微球上的直接电化学性质及对过氧化氢的传感性能研究
刘辉, 郭凯, 段聪越, 汤妮, 沈婉秋
(陕西科技大学 材料科学与工程学院, 陕西 西安710021)
摘要:采用溶剂热法并结合热处理,合成了纳米线自组装的海胆状WO3微球,并将其用于构筑血红蛋白(Hb)基直接电化学生物传感器,并采用扫描电子显微镜(SEM)、X-射线衍射(XRD)等对所制材料进行了形貌与结构表征.光谱与电化学分析表明,这种WO3微球具有很好的生物相容性,能够保持蛋白质的稳定性与生物活性;电化学实验结果显示,海胆状WO3微球的特殊结构,可以促进Hb的直接电子转移.所组装的生物传感器具有较低的检测极限(0.1 μm)和较宽的线性范围(0.5~230 μm),同时还具有快速响应性与优异的长效稳定性.
关键词:海胆状氧化钨; 血红蛋白; 直接电化学; 生物传感器
0引言
研究氧化还原蛋白质在电极上的直接电子转移,不但能知悉氧化还原蛋白质催化反应的热力学和动力学性质,有助于了解其在生命体内的电子转移机理和生理作用机制,而且还可以为开发新型生物传感器和生物反应器提供理论指导[1,2].
由于氧化还原蛋白质的电活性中心深埋在蛋白质内部,故在普通电极表面实现直接电子转移十分困难.因此,需要借助特殊电极材料作为蛋白质的固定基体,在维持其生物活性的同时,还促进直接电化学反应[2,3].最近的研究显示,纳米材料具有特殊的电学效应和表面效应,可以促进氧化还原蛋白质的直接电子转移[3,4].现有研究表明纳米材料的形貌和结构对固定酶的能力与生物传感器的检测性能具有重要影响[5].其中,具有特殊结构和形貌的三维结构金属氧化物纳米材料在生物传感器的研究方面已得到了广泛关注.
Wang等[6]采用海胆状MnO2作为血红蛋白的基体构筑直接电化学生物传感器,实现了对CCl3COOH高效检测;Dong等[7]采用多种具有三维结构的NiO纳米材料构筑直接电化学生物传感器,并研究了纳米材料形貌对传感性能的影响;Xie等[8]研究了具有空心核壳结构的TiO2微球在生物传感方面的应用;Lu等[9]采用纳米片自组装ZnO微球负载血红蛋白构筑传感器,并研究了该传感器对H2O2和NaNO2的传感性能.但目前尚未有报道采用具有三维纳米结构的WO3作为基体构筑直接电化学生物传感器.
本文采用溶剂热法并结合热处理成功地制备出了纳米线自组装海胆状氧化钨微球.这种氧化钨微球在固定蛋白质方面具有诸多优势.第一,已有的研究[10]与本次实验结果都表明WO3具有很优异的生物相容性,能够为蛋白质提供一个良好的生物微环境,有利于其保持生物结构的稳定;第二,组成海胆状氧化钨微球的纳米线直径小于30 nm,这使其拥有大量的活性表面区域,有利于蛋白质的吸附.同时,纳米线还可以提供一个一维电子通路,促进蛋白质与电极表面的电子交换.此外,纳米线之间的空隙还可以成为电解质的扩散通路,电解质溶液中的底物可以较容易地接近固定于纳米线上的蛋白质,从而有利于提高蛋白质与底物之间有效碰撞的次数.可见,这种纳米线自组装海胆状氧化钨微球在酶的固定与生物传感器方面具有广阔的应用前景.
血红蛋白(Hb)是目前研究得最为清楚的蛋白质之一,而且相对价廉易得,因此已成为研究生物大分子电化学的理想模型物.本文采用Hb作为模型蛋白质,用所制备的海胆状氧化钨作为固定基体材料,组装了直接电化学生物传感器,并研究了该生物传感器的电化学性质及对H2O2的检测性能.
1实验部分
1.1试剂和仪器
血红蛋白(Hb)与Nafion(5 wt%)购自Sigma公司;六氯化钨(WCl6)、无水乙醇(CH3CH2OH)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、过氧化氢(H2O2,30 wt%)购自国药集团,均为分析纯;实验用水均为去离子水.
采用日本Rigaku的D/Max-2200型X射线衍射仪对样品的物相和结晶性进行分析,(Cu Kα辐射,λ=0.154 18 nm);采用S-4800型日立扫描电子显微镜对样品的形貌进行观察分析;采用PerkinElmer Lambda 950型紫外可见吸收光谱仪(UV-VIS)与Bruker V70型红外光谱仪(Fourier Transform Infrared,FT-IR)对复合膜中的Hb进行检测;使用辰华660D电化学工作站进行电化学测试.测试使用三电极体系,修饰的玻碳电极(GCE)为工作电极,铂丝电极为对电极,Ag/AgCl电极为参比电极.
1.2海胆状WO3微球的制备
称量0.6 g WCl6溶解于60 mL 无水乙醇中,得到黄色透明溶液.将所得溶液转移至100 mL聚四氟乙烯内衬的水热釜中,并将其放置于180 ℃的烘箱中保温24 h,自然冷却至室温得到蓝色反应产物 (WO2.72).将反应产物用去离子水和无水乙醇分别洗涤三次,50 ℃ 干燥24 h.对所得蓝色产物进行热处理,热处理温度为450 ℃,升温速率为1 ℃/min,保温30 min自然冷却至室温而得到黄色产物 (WO3).
1.3制备酶电极
玻碳电极(GCE)在使用前,分别在撒有1.0μm、0.3μm、0.05μm Al2O3粉的麂皮上打磨成镜面,用去离子水冲洗,并用纯氮气吹干待用.采用简单的涂抹法制备修饰电极.首先,取10 mg 所制备的WO3微球加入5 mL 去离子水中,超声分散并结合搅拌获得了WO3分散液;随后,将Hb溶液(10 mg mL-1溶于PBS,pH=7.0)、Nafion(5.0 wt%)与WO3分散液按体积比1∶1∶2制成混合液(记为I液).在此混合液中,Hb为2.5 mg mL-1,WO3为1 mg mL-1,Nafion为1.25 wt%.用微量计量器取4μL I液涂抹在抛光的GCE上,用烧杯盖上,使水分缓慢挥发,待完全干燥后在电极表面形成一层均匀的复合膜,即制备出Nafion/Hb/WO3/GCE.将所制成的修饰电极存储于4 ℃的冰箱中待用.
作为对比,采用相同的工艺制备了Nafion/Hb/GCE与Nafion/WO3/GCE两种电极.在电化学测试之前,所用的修饰电极均需要在pH 7.0的PBS中浸泡30 min,以除去表面粘附的杂质.
2结果与讨论
2.1海胆状WO3微球的表征
图1是不同阶段产物的XRD衍射图谱,其中曲线a为溶剂热反应产物的XRD衍射图谱,该曲线对应的是WO2.72的标准图谱 (JCPDS No.36-101)[11];曲线b显示经过450 ℃热处理,WO2.72完全转变成了WO3(JCPDS No.43-1035)[11].
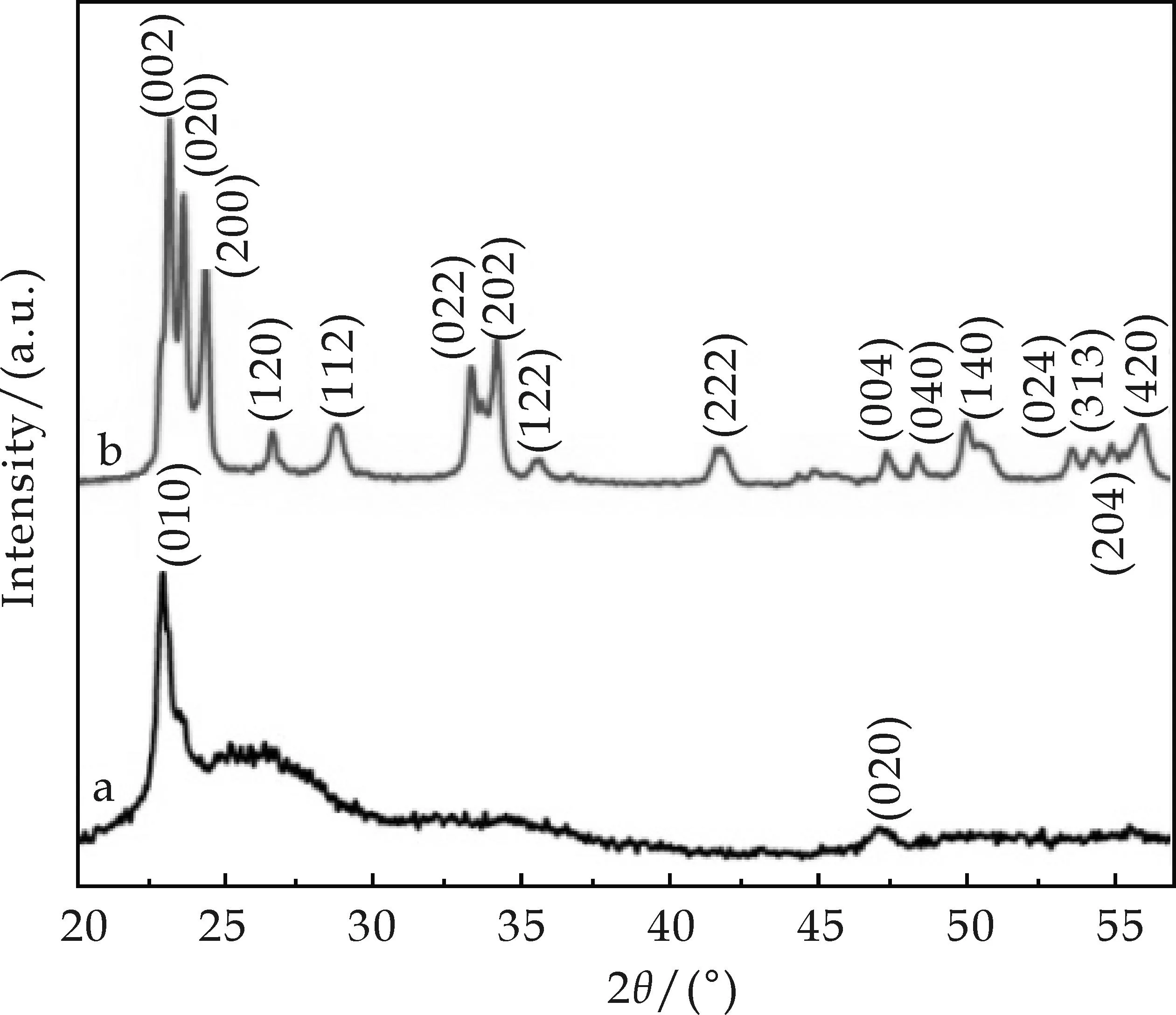
a:水热反应产物; b:热处理所得产物图1 不同阶段产物的XRD图谱
图2显示了不同阶段产物的SEM照片.图2(a)、(b)为溶剂热反应产物WO2.72不同放大倍数的SEM照片.如图2(a)所示,所得WO2.72产物形貌均一,都为纳米线自组装的海胆状微球;图2(b)显示纳米线直径约为20 nm,微球直径约为500 nm;图2(c)与2(d)显示450 ℃热处理30 min未引起产物形貌的明显变化.这可能是由于较温和的煅烧温度、缓慢的升温速率以及WO3与WO2.72具有较为相似的晶体结构[12].

(a)、(b)溶剂热反应产物

(c)、(d)热处理所得产物图2 不同阶段产物的SEM照片
2.2Nafion/Hb/WO3复合膜的光谱表征
血红素类蛋白质Soret 吸收峰的位置能够反映血红素蛋白质构像的完整性信息,故Soret 吸收峰位置的改变可以作为蛋白质是否变性的重要标志[5,13].因此,利用UV-Vis光谱检测Hb的结构的变化情况.
图3为Nafion/Hb/WO3复合膜 (曲线a) 和Hb(曲线b)的UV-Vis 谱图.Hb的PBS溶液滴在石英片上制备的薄膜,其Soret 吸收峰位置为406.2 nm;Nafion/Hb/WO3复合膜的Soret 吸收峰位置为405.4 nm,和纯Hb薄膜相比,其吸收峰位置几乎没有改变,故可以认为Hb在Nafion/Hb/WO3复合膜中保持了原有的结构.

a:Nafion/Hb/WO3复合膜; b:纯Hb图3 Hb的UV-Vis 光谱
红外光谱是研究蛋白质大分子二级结构的有效手段,故在电极表面复合膜中,Hb的活性常用红外光谱进行分析[7-13].在红外光谱中,蛋白质具有Amide Ⅰ与Amide Ⅱ两个特征吸收峰,这两个吸收峰可以提供蛋白质中肽键的许多细节信息.Amide Ⅰ吸收峰 (1 700~1 600 cm-1) 是由于构成蛋白质骨架的肽键(-CO-NH-)中C=O的伸缩振动引起的;Amide Ⅱ吸收峰 (1 620~1 500 cm-1) 是由于N—H的弯曲振动与C—N的伸缩振动共同引起的.Nafion中不含有肽键,故不具有Amide Ⅰ与Amide Ⅱ吸收峰.
图4为Nafion/Hb/WO3复合膜(曲线a)与纯Hb(曲线b)的红外吸收光谱.如图4所示,Nafion/Hb/WO3复合膜具有与纯Hb几乎完全相同的AmideⅠ与Amide Ⅱ吸收峰,这说明Hb在复合膜中保持了原有的二级结构.可见,WO3具有良好的生物相容性,可以提供一个保护性的微环境以保持蛋白质的生物活性.

a:Nafion/Hb/WO3复合膜; b:纯Hb图4 Hb的红外吸收光谱
2.3Hb在Nafion/Hb/WO3复合膜中的直接电化学
如图5所示,Nafion/WO3/GCE(b曲线)的循环伏安曲线中无氧化峰与还原峰,表明在此扫描电压范围内海胆状WO3微球无电活性;Hb/Nafion/GCE(a曲线)的循环伏安曲线有一对很弱的氧化还原峰,这是因为Hb的氧化还原中心包埋于蛋白质内部,要与GCE表面直接进行电子交换并不容易,而且会大量失活;Nafion/Hb/WO3/GCE(c曲线)的循环伏安曲线有一对清晰稳定的氧化还原峰,这对氧化还原峰代表Hb(FeⅢ)/Hb(FeⅡ) 氧化还原对的相互转化.

a:Nafion/Hb/GCE; b:Nafion/WO3/GCE;c:Nafion/Hb/WO3/GCE图5 不同修饰电极在0.1 mol·L-1的pH 7.0 PBS缓冲溶液中的循环伏安曲线,其中扫速为0.1 V s-1
在此修饰电极上,Hb的表观电位Eo′(Eo′定义为 (Epa+Epc)/2,其中Epa为氧化峰电位,Epc为还原峰电位) 为0.352 (vs.Ag/AgCl),这与其他研究者制备的负载Hb的修饰电极所得结果一致[14].峰间电位差(ΔEp) 的大小可以反映直接电子转移速率的快慢.电位差越小,表明直接电子转移速率越快.Nafion/Hb/WO3/GCE的循环伏安曲线中ΔEp=38 mv,这表明在此修饰电极上电子转移是一个快速且准可逆的过程.纳米线自组装海胆状WO3微球之所以可以促进Hb的直接电子转移是由于纳米线可以为电子提供一个快速转移的通路.
Nafion/Hb/WO3/GCE在PBS(0.1 M,pH=7)中的循环伏安特性与扫描速率的关系如图6所示.从图6(a)中可以看出,在0.1~0.8 V s-1的扫速范围中,Hb(FeⅢ)/Hb(FeⅡ) 的氧化还原峰电流值随扫速的增大而增大,同时峰间电位差亦有少量增加.氧化还原峰电流值与扫速成正比,其线性关系见图6(b),这十分清楚地表明,在此修饰电极表面,Hb与GCE之间的电子转移是表面控制的电化学过程.采用Laviron模型[15]对这一表面控制电化学体系进行分析.经计算,Hb在Nafion/Hb/WO3/GCE上的电子转移速率常数(ks)约为2.8 s-1.这说明电活性物质Hb在Nafion/Hb/WO3复合薄膜中具有较快的电子转移.
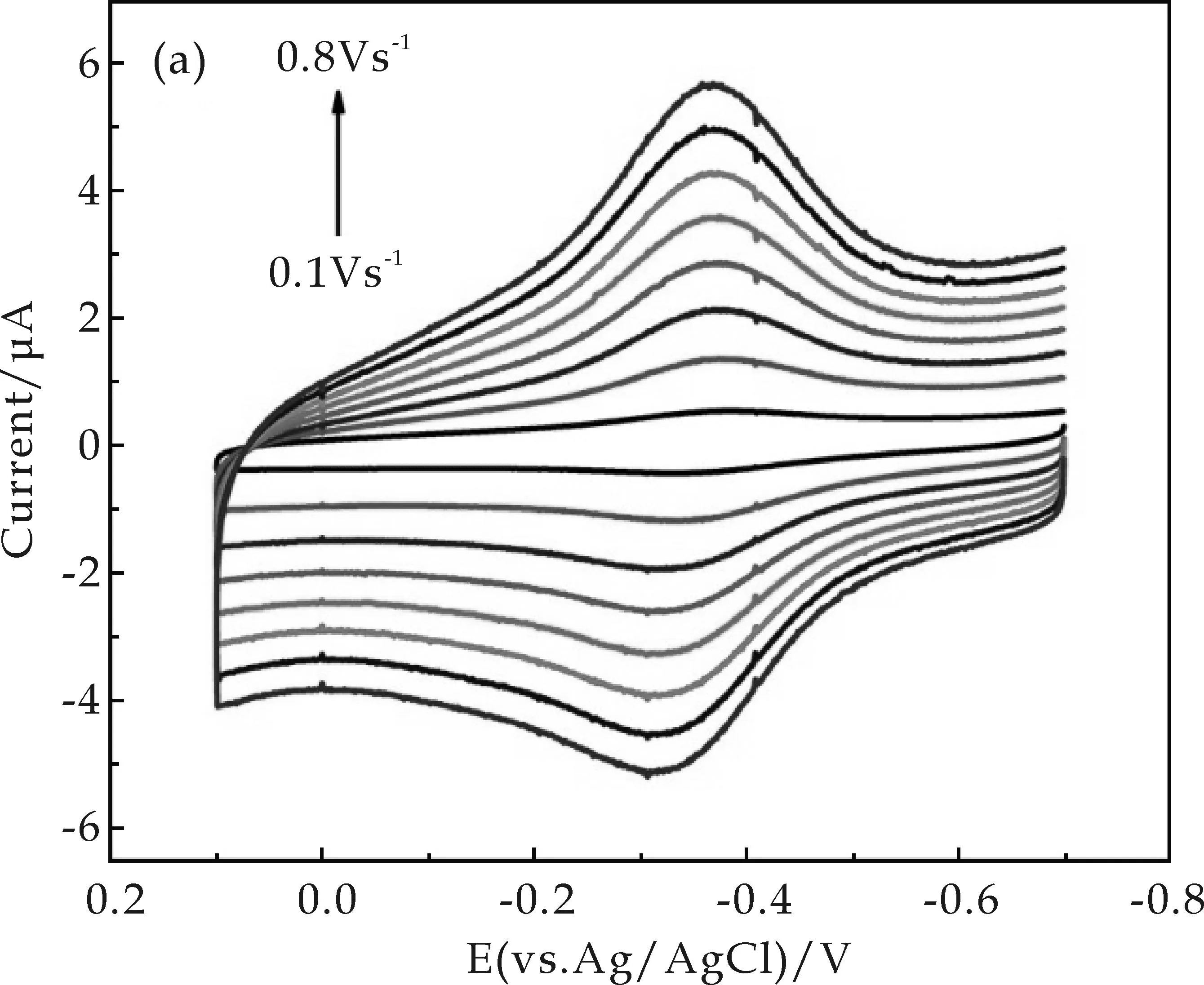
(a)不同扫速条件下的循环伏安曲线
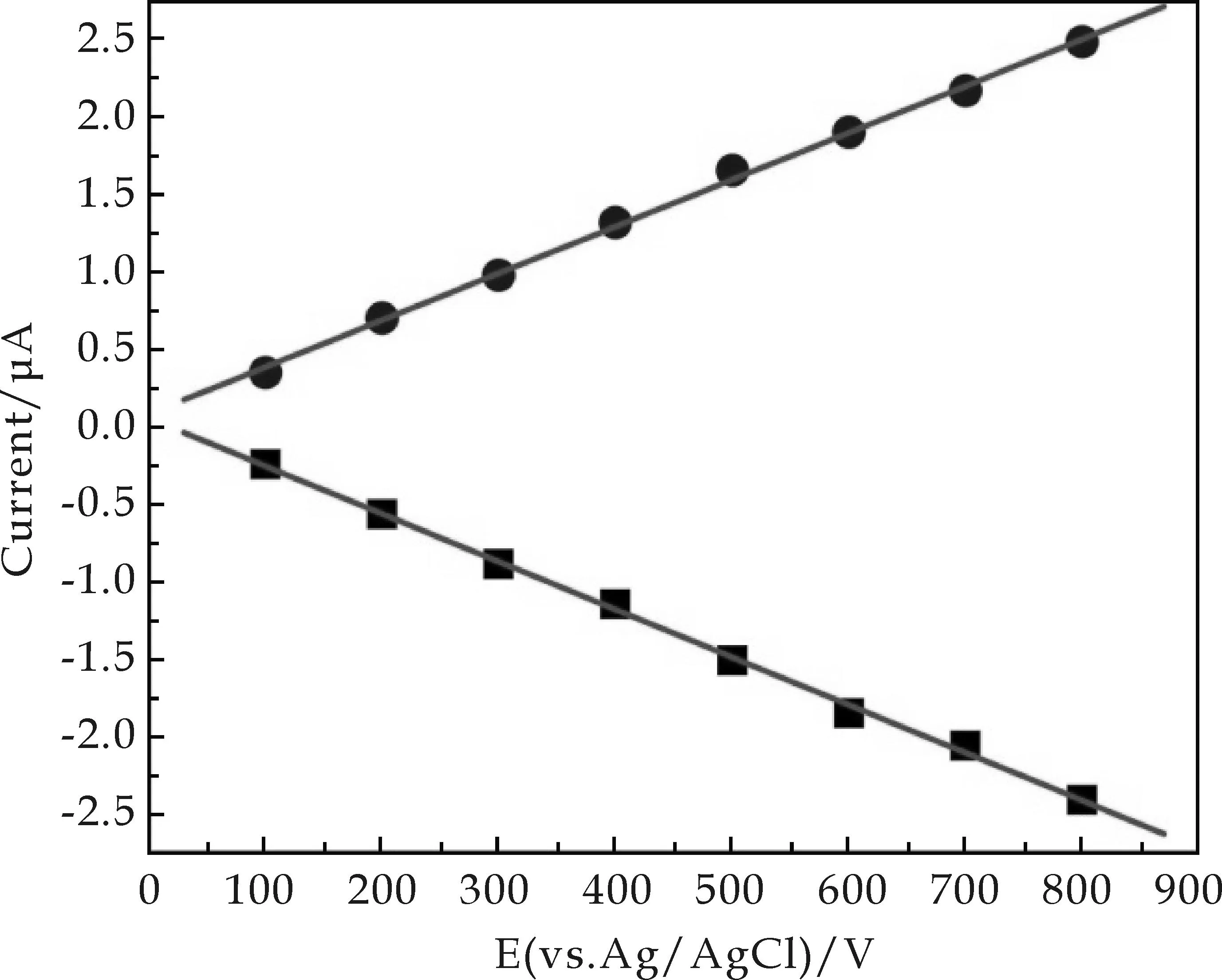
(b)氧化峰与还原峰电流和扫速之间的关系图6 Nafion/Hb/WO3/GCE在0.1 mol L-1的pH 7.0 PBS缓冲溶液中扫速与电流的关系
Nafion/Hb/WO3/GCE的活性Hb表观覆盖度 (Γ*, mol cm-2)可利用公式Γ* =Q/nFA计算得出[16],其中Q是氧化还原峰的积分电量,n是Hb的反应电子转移数(n=1),F为法拉第常数,A是电极几何表面积.据此计算出固定在Nafion/Hb/WO3复合薄膜上具有电化学活性的Hb的表观覆盖度Γ*为3.32×10-10mol cm-2,该值远高于单层覆盖的理论值 (1.89×10-11mol cm-2)[17].这表明多层Hb固定于Nafion/Hb/WO3复合薄膜中并参与了直接电子转移过程.
Hb的直接电化学行为和溶液pH值具有十分密切的关系.图7 所示为Nafion/Hb/WO3/GCE在不同pH的PBS缓冲液中的循环伏安曲线.从图7中可以看出,随PBS的pH值逐渐增大,Hb的氧化峰与还原峰的峰电位均向负电位移动.这种氧化还原电位的变化在测试 pH 值范围(6.0~8.0)内是可逆的,在重复调节到相同的pH值时,修饰电极的循环伏安曲线能够恢复,峰位置和峰电流不会发生改变.

a:6.0;b:6.5;c:7.0;d:7.5;e:8.0图7 Nafion/Hb/WO3/GCE在不同pH值0.1mol L-1的PBS缓冲溶液中的循环伏安曲线(其中插图为表观电位与pH值的关系曲线)
实验考察了Eo′与测试底液pH值的关系,如图7的内插图所示.Hb的表观电位 (Eo′)随溶液的pH值变化而线性变化.其斜率为-52.6 mV pH-1,线性相关系数R=0.999,接近于质子-电子传递的理论值-58.0 mV pH-1.这说明在Nafion/Hb/WO3复合薄膜中,Hb的血红素辅基在发生单电子传递的同时,还伴随有一个质子的得失.其电极氧化还原反应的方程式为[18]:
Hb(FeⅢ) + e-+ H+= Hb(FeⅡ)
(1)
由图7还可以看出,在pH=7.0的PBS中,Hb的氧化还原峰电流都最大,这是由于越接近于生物体内环境,Hb的活性越高.故选取pH=7作为生物传感器的检测条件.
2.4Nafion/Hb/WO3/GCE的电催化性能
Hb能对O2、H2O2、亚硝酸盐等物质进行电催化还原[4,9,19].本文以H2O2为例,研究了Nafion/Hb/WO3/GCE的电催化还原能力.图8所示为Nafion/Hb/WO3/GCE在含有不同浓度H2O2的PBS(0.1M,pH 7.0)中所测得的循环伏安曲线.

图8 Nafion/Hb/WO3/GCE在含不同浓度H2O2的0.1 mol L-1的pH 7.0 PBS缓冲溶液中的循环伏安图(H2O2的浓度分别为:0μm、10 μm、30 μm、50 μm、70 μm、110 μm、150 μm、190 μm、 230 μm、270 μm),插图为H2O2浓度与相应的催化还原电流之间的关系图
当未加入H2O2时,曲线有一对可逆的氧化还原峰.随着H2O2的加入,还原峰电流快速增加,氧化峰电流减小直至消失,这表明H2O2在电极表面发生的是电催化还原反应.其电催化还原反应的方程式为[18]:
H2O2+2Hb(FeⅡ)=2Hb(FeⅢ)+2H2O
(2)
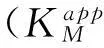
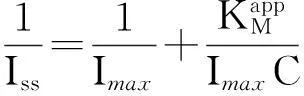
(3)

2.5Nafion/Hb/WO3/GCE对H2O2的生物传感性
采用计时电流法研究Nafion/Hb/WO3/GCE针对H2O2的生物传感性能.在工作电位为0.35 V条件下,向PBS (0.1 M,pH 7.0) 中连续加入一定浓度的H2O2溶液后,得到一系列的电流响应,如图9所示.当加入H2O2后,还原电流快速增大到一个稳定值,且在3 s内达到95%的电流响应,表明Nafion/Hb/WO3/GCE对H2O2具有快速响应.

图9 Nafion/Hb/WO3/GCE对H2O2浓度变化的计时电流响应曲线及H2O2浓度与电流响应之间的关系图
图9内插图为稳态电流与H2O2浓度的校正曲线图.如图9所示,电流与H2O2浓度之间具有明确的线性关系,线性范围为0.5~230μm(γ=0.998,n=31),检测限为0.1μm(信噪比S/N=3).将此体系下的传感器与其它已报道的传感器等对H2O2的传感性能进行了对比,如表1所示[22].由表1可知,Nafion/Hb/WO3/GCE具有较低的检出限和较宽线性范围,这归功于纳米线自组装海胆状WO3微球的优异生物相容性和良好的电子导通作用.
参考文献表1不同修饰电极对H2O2检测性能的比较修饰电极线性范围/μm检测限/μmNafion/Hb/TiO2-rGO/GCE0.1-1450.01[21]Hb/ZnO-MWCNT/Nafion/GCE1-800.85[22]Hb/Chit-[bmim]PF6/TiO2-Gr/GCE1-11700.3[23]HRP/TiO2/Nafion/GCE0.4-1400.05[6]Mb/TiC/chit/GCE0.5-500.2[24]Nafion/Hb/WO3/GCE0.5-2300.1本研究
注:TiO2NSsT, 多壁碳纳米管;CMC, 羧甲基纤维素;[bmim]BF4-rGO, TiO2纳米片修饰还原氧化石墨烯纳米复合材料;MWCN, 离子液体1-丁基-3-甲基咪挫六氟磷酸盐;Mb, 肌红蛋白;Chit, 壳聚糖
2.6传感器的稳定性与再现性
本文还研究了所组装生物传感器的长效稳定性.将该修饰电极存放在4 ℃冰箱中,30天之后再用其检测10μm H2O2,实验结果显示相对于刚制备好的修饰电极,电流响应降低为原来的91.8%,说明固定在电极表面上的Hb能够长时间地保持其生物活性[23].这应归功于所制备的纳米线自组装WO3微球具有良好的生物相容性,可以为Hb提供一个保护性微环境,以维持其生物结构.
同时研究了该生物传感器的重现性.平行制备了6组相同的Nafion/Hb/WO3/GCE,并对10μm H2O2进行平行检测,相对标准偏差(RSD)为3.7%,表明Nafion/Hb/WO3/GCE具有良好的重现性.
3结论
采用溶剂热法结合高温热处理,制备出了纳米线自组装海胆状WO3微球,并将其应用于Hb电化学生物传感器的构建.光谱实验结果表明,Hb在Nafion/Hb/WO3复合膜中保持了其天然构象;电化学实验表明,所制备的直接电化学生物传感器对H2O2具有优异的传感性能,具有较宽的线性范围 (0.5~230μM)和极低的检测极限 (0.1μM),以及较好的稳定性与再现性.这种纳米线自组装海胆状WO3微球是制备电化学生物传感器的一种优异基体材料,在生物医学与环境监测方面具有十分广阔的应用前景.
[1] Hamachi I,Fujita A,Kunitake T.Protein engineering using molecular assem-bly:Functional conversion of cytochrome c via noncovalent interactions[J].J.Am.Chem.Soc.,1997,119(39):9 096-9 102.
[2] Legar C,Elloitt S.J,Hoke K.R,et al.Enzyme electrokinetics:Using protein film voltammetry to investigate redox enzymes and their mechanisms[J].Biochemistry,2003,42(29):8 653-8 662.
[3] Zhihong Z,Lining Q,Qingjuan N,et al.Urchinlike MnO2nanoparticles for the direct electrochemistry of hemoglobin with carbon ionic liquid electrode[J].Biosens.Bioelectron.,2011,26(5):2 119-2 124.
[4] M.Lwasaki,M.Hare.Cobalt ion-doped TiO2photocatalyst reponse to visible light[J].J Colloid Interface Sci,2000,224(1):202-204
[5] Sheng Q.L,Zheng J.B,Shangguan X.D,et al.Direct electrochemistry and electrocatalysis of heme-proteins immobilized in porous carbon nanofiber/room-temperature ionic liquid composite film[J].Electrochim.Acta,2010,55(9):3 185-3 191.
[6] Wang C,Han X,Xu P,et al.Controlled synthesis of hierarchical nickel and morphology-dependent electromagnetic properties[J].The Journal of Physical Chemistry C,2010,114(7):3 196-3 203.
[7] Sheying D,Penghui Z,Hui L,et al.Direct electrochemistry and electrocatalysis of hemoglobin in composite film based on ionic liquid and NiO microspheres with different morphologies[J].Biosens.Bioelectron.,2011,26(10):4 082-4 087.
[8] Xie Q,Zhao Y.Y,Chen X,et al.Nanosheet-based titania microspheres with hollow core-shell structure encapsulating horseradish peroxidase for a mediator-free biosensor[J].Biomaterials,2011,32(27):6 588-6 594.
[9] Lu X.B,Zhang H.J,Ni Y.W,et al.Porous nanosheet-based ZnO microspheres for the construction of direct electrochemical biosensor[J].Biosens.Bioelectron.,2008,24(1):93-98.
[10] Deng Z.F,Gong Y.C,Luo Y,et al.WO3nanostructures facilitate electron transfer of enzyme:Application to detection of H2O2with high selectivity[J].Biosens.Bioelectron.,2009,24(8):2 465-2 469.
[11] Xi G.C,Ye J.H,Ma Q,et al.In situ growth of metal particles on 3D urchin-like WO3nanostructures[J].J.Am.Chem.Soc.,2012,134(15):6 508-6 511.
[12] Xi G.C,Yue B,Cao J.Y,et al.Fe3O4/WO3hierarchical core-shell structure:High-performance and recyclable visible-light photocatalysis[J].Chem.Eur.J.,2011,17(18):5 145-5 154.
[13] Sun W,Guo Y.Q,Zhang Y.Y,et al.Direct electrochemistry of hemoglobin on graphene and titanium dioxide nanorods composite modified electrode and its electrocatalysis[J].Biosens.Bioelectron.,2013,42:207-213.
[14] Shang Y,Zhang D F,Guo L.CuCl-intermediated construction of short-range-ordered WO3mesoporous spheres with excellent adsorption performance[J].Mater.Chem,2012,22(3):856-861.
[15] Laviron E.General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J].J.Electroanal.Chem.,1979,101(1):19-28.
[16] Shi F,Zheng W.Z,Wang W.C,et al.Application of graphene-copper sulfide nanocomposite modified electrode for electrochemistry and electrocatalysis of hemoglobin[J].Biosens.Bioelectron.,2015,64:131-137.
[17] Wang S.F,Chen T,Zhang Z.L,et al.Direct electrochemistry and electrocatalysis of heme proteins entrapped in agarose hydrogel films in room-temperature ionic liquids[J].Langmuir,2005,21(20):9 213-9 260.
[18] Kamin R.A,Wilson G.S.Rotating ring-disk enzyme electrode for biocatalysis kinetic studies and characterization of the immobilized enzyme layer[J].Anal.Chem.,1980,52(8):1 198-1 205.
[19] George S,Lee H.K.Direct electrochemistry and electrocatalysis of hemoglobin in nafion/carbon nanochip film on glassy carbon electrode[J].J.Phys.Chem.B.,2009,113(47):15 445-15 454.
[20] Xie L.L,Xu Y.D,Cao X.Y.Hydrogen peroxide biosensor based on hemoglobin mmobilized at graphene,flower-like zinc oxide, and gold nanoparticles nanocomposite modified glassy carbon electrode[J].Colloids Surf.,B,2013,10:245-250.
[21] Liu H,Duan C.Y,Su X,et al.Hemoglobin encapsulated titania nanosheet modified reduced graphene oxide nanocomposite as a mediator-free biosensor[J].Sens.Actuators B,2014,203:303-310.
[22] Ma W,Tian D.B.Direct electron transfer and electrocatalysis of hemoglobin in ZnO coated multiwalled carbon nanotubes and Nafion composite matrix[J].Bioelectrochemistry,2010,78(2):106-112.
[23] Sun J.Y,Huang K.J,Zhao S.F,et al.Direct electrochemistry and electrocatalysis of hemoglobin on chitosan-room temperature ionic liquid-TiO2-graphene nanocomposite film modified electrode[J].Bioelectrochemistry,2011,82(2):125-130.
A novel H2O2biosensing based on the direct electrochemistry
of hemoglobin on urchin-like WO3microspheres
LIU Hui, GUO Kai, DUAN Cong-yue, TANG Ni, SHEN Wan-qiu
(School of Materials Science and Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:Using solvent hot method and combined with heat treatment,nanowire-based urchin-like WO3microspheres have been synthesized and employed to immobilize hemoglobin (Hb) in order to fabricate a mediator-free biosensor.The morphology and structure of the WO3microspheres were characterized by scanning electron microscopy,X-ray diffraction.Spectroscopic and electrochemical measurements revealed that the WO3microspheres are an immobilization support with biocompatibility for proteins,affording good protein stability and bioactivity.Due to the special structure of the WO3microspheres,the direct electron transfer of Hb is facilitated and the resulting biosensor displayed good performance for the detection of H2O2,with both a low detection limit of 0.1 μm and a wide linear range of 0.5~230 μm,as well as a fast response and excellent long-term stability.
Key words:urchin-like WO3; hemoglobin; direct electrochemistry; biosensor
中图分类号:O64
文献标志码:A
文章编号:1000-5811(2015)05-0050-06
作者简介:刘辉(1976-),男,陕西周至人,副教授,博士,研究方向:纳米功能材料制备及表征
基金项目:国家自然科学基金项目(51272147); 陕西科技大学学术骨干培育计划项目(XSGP201203); 陕西科技大学研究生创新基金项目
收稿日期:*2015-07-19
