儿童非酒精性脂肪性肝病研究的新进展
2015-12-05岳保珠王安丽王清图
岳保珠 王安丽 王清图
1.山东省潍坊市妇幼保健院儿科,山东潍坊261011;2.山东省潍坊市妇幼保健院内科,山东潍坊261011
儿童非酒精性脂肪性肝病研究的新进展
岳保珠1王安丽1王清图2
1.山东省潍坊市妇幼保健院儿科,山东潍坊261011;2.山东省潍坊市妇幼保健院内科,山东潍坊261011
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)指包括单纯性脂肪肝以及由其演变成的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH),甚至肝硬化等一系列病变的综合征。肥胖和静态生活方式可诱发基因重组导致NAFLD的发生;肝脏与肠道和脂肪组织间的相互关联、基因和环境间持续的相互作用,故上述因素在儿童NAFLD的发病机制中占有重要作用。目前人们对儿童NAFLD的自然史认识不多,正逐步深入研究其发病机制。发病机制和组织学改变不仅可为早期诊断和非侵入性诊断手段的应用提供依据,还可为儿童NAFLD的诊治提供新思路。
非酒精性脂肪性肝病;非酒精性脂肪性肝炎;纤维化;儿童
NAFLD包括单纯性脂肪肝以及由其演变的NASH、纤维化、肝硬化,甚至肝癌,严重威胁人类健康[1,2],其患病率随肥胖患病率的增高而上升,且与代谢综合征密切相关。儿童肥胖相关性NAFLD几乎不受其他因素影响(如体重急剧下降、药物治疗、酒精消耗等),遗传易感性、外界环境作用为原发性NAFLD的经典机制。本文从儿童肥胖相关性肝病的遗传背景、发病机制、诊断和治疗管理等方面对儿童NAFLD的最新进展做一概述。
1 流行病学
近20年,儿童超重/肥胖已成为全球性问题[3,4]。现有的无创或侵入性诊断测试的多变性和成本等因素,影响流行病学数据的准确性。谷丙转氨酶(ALT)可用于初步筛查儿童NAFLD,但敏感性较差。抽样误差、青春期年龄、性别、种族、肤色以及遗传倾向等因素均会影响诊断。肥胖、代谢综合征是发病最主要的危险因素,腹围测量对诊断NAFLD的重要性超过了BMI[5,6]。
2 遗传危险因素
遗传是NAFLD发病的主要因素,在疾病早期即起重要作用。对成年人的药物基因组(如PNPLA3的遗传变异)研究发现,rs738409 C>G单核苷酸能编码l148M变种,伴脂肪含量改变、ALT增高,同时使NASH和肝纤维化风险大大增加[7]。该l148M PNPLA3变异会改变甘油三酯含量。PNPLA3受油脂合成过程的调节,同时参与甘油三酯代谢。PNPLA3基因型影响因ALT水平持续异常而接受活检的肥胖儿童NASH和肝纤维化的组织学改变的严重程度。遗传变异rs2854116SNP也与儿童脂肪肝密切相关,而不依赖PNPLA3[8]。

表1 发育年龄影响NAFLD和NASH易感性的遗传变异
另外,某些遗传变异的表达可能有年龄依赖性。表1可以看出遗传多态性影响儿童NASH的易感性。
3 代谢危险因素和器官轴对NAFLD进展的影响
代谢综合征以腹部肥胖、胰岛素抵抗(IR)、葡萄糖耐量受损、血脂异常和高血压等为基本表现。成人NAFLD通常伴有代谢综合征的至少一项表现,儿童NAFLD亦是如此[9]。通过活检确诊的120例NAFLD患儿伴代谢综合征表现的占65.8%,且代谢综合征与肝纤维化程度也密切相关[10]。
根据“多次打击”假说,IR和游离脂肪酸的堆积可使脂肪肝遭受第二次打击,也包括导致脂肪组织释放因子失衡、氧化应激、激活特定的NRs和肝纤维化。为了中和IR,胰腺β细胞数量增加,致胰岛素负荷增加,更加速肝脏脂肪沉积,导致NAFLD。
脂肪肝最终进展为NASH是脂肪组织、胰腺、肠道和肝脏相互作用的结果。其中,肠道发挥了重要作用。饮食/肠道微生物群产生并释放的代谢产物,可穿过受损的肠道渗透屏障、激活固有免疫应答分子、作为炎性组织病变的催化剂,加重纤维化程度[11]。
4 NASH的细胞与分子机制
脂肪肝进展为肝炎、肝硬化的突出条件是调节肝脏生理功能的多种机制共同作用结果。
4.1纤维化细胞学基础
纤维发生主要受以下细胞调控:①内源性成纤维细胞或肌成纤维细胞,主要由肝星状细胞产生;②慢性肝损伤时纤维细胞从骨髓迁移至肝脏;③潜在定植和骨髓来源的间质干细胞转化为肌成纤维细胞[12]。
4.2脂肪细胞因子紊乱
从脂肪变性到NASH的关键是脂肪细胞因子脂联素、瘦素、肿瘤坏死因子(TNF-α)、白介素(ILs)等的紊乱,在IR时浸润脂肪组织。瘦素可下调胰岛素受体,减轻NASH的纤维化。脂联素可抵消瘦素的IR效应,抑制肝星状细胞增生,阻碍纤维化进程[13]。NASH患者的TNF-α和ILs-6水平增高,抑制这些因子可改善NAFLD。
4.3氧化应激反应和脂肪毒性假说
抗氧化系统能清除细胞代谢产生的活性氧(ROS),并维持正常的细胞内稳态。NASH患者的氧化应激反应增加,过量的游离脂肪酸增加肝线粒体和酶的氧化反应,引起ROS产生过量,其在肝纤维化发生中至关重要。
脂肪毒性假说是NASH发病的另一机制。内源性肝脂质的堆积引发局灶性炎性组织反应,导致自由基的产生而损伤细胞膜和DNA[14]。脂质过氧化反应的细胞毒性产物诱导肝细胞凋亡、参与肝纤维化发生。
4.4核受体在NASH中的作用
核受体(NRs)可调节特定基因的表达从而调控大部分细胞和代谢功能[15]。PPARs 参与肝星状细胞的激活,其他的NRs如胆汁酸受体(FXR)等也参与NAFLD的发病机制。
5 诊断
NAFLD缺乏特定症状体征,故儿童NAFLD的早期检测可有效识别潜在进展性脂肪肝[16],对超重/肥胖儿童进行NAFLD筛查意义重大。
5.1常规实验检查
建议10岁内儿童(BMI在同龄儿第95百分位以上或虽处在85~94百分位间但存在高危因素)进行ALT筛查、脂质分析和空腹血糖测定[17]。已证实,男孩ALT阈值25.8 U/L、女孩22.1 U/L为可疑慢性肝病的可靠指标。
5.2超声和放射
肝脂肪变性细胞含量>30%时超声可检测脂肪肝。超声检测脂肪变性指数和肝活检脂肪变性程度有很好的相关性[18]。在儿童检查中不推荐CT扫描,而MRI检测脂肪肝有较好的敏感性。
5.3分级标准
当前,确定肝病进展的概率甚为重要。超声定位肝活检仍是明确诊断、确定严重程度及评估NASH后遗症概率的金标准。BMI、血脂、IR、空腹血糖和单独腹围测量可作为儿童NAFLD的预测指标。上述临床参数可协助早期发现潜在重症NAFLD。儿童NAFLD纤维化指数的计算基于腹围、甘油三酯和年龄。透明质酸、T1MPs等均可作为判定纤维化程度的指标。
6 治疗
目的是通过提供最新的证据来评估儿童NAFLD的治疗方案。
6.1改变饮食和生活方式
饮食减肥可减少肝脂肪供应、提高葡萄糖利用来提高胰岛素敏感性,并降低ROS的生成和脂肪组织炎症反应。体育锻炼减肥则主要提高肌肉细胞基质利用率、提高胰岛素敏感性。
减肥应循序渐进,极端减肥饮食可能导致严重的代谢紊乱、加速肝损伤。研究显示减肥2年再次活检发现肝组织学改变及NAFLD活动度积分均有明显改善[19]。减少饱和脂肪酸摄入、增加不饱和脂肪酸及纤维素摄入,儿童才能均衡饮食、健康成长。
6.2NAFLD的药物干预
通过改变生活方式效果仍不佳的患儿,应行药物干预治疗,包括抗氧化剂、胰岛素增敏剂及细胞保护剂。
抗氧化剂可防止单纯脂肪变性进展为NASH。已知单用维生素E组、维生素E联用维生素C组与通过生活方式干预组疗效均无差异[20]。近期一大样本多中心随机双盲安慰剂对照研究(TONIC研究)发现维生素E联用二甲双胍能有效改善NAFLD的肝细胞肿胀,未明显改善其他组织学改变。二甲双胍是用于儿童的唯一胰岛素增敏剂,可减轻肝脂肪变性程度、降低ALT水平[21]。
熊去氧胆酸理论上可通过保护肝细胞线粒体膜、免疫调节功能、激活抗凋亡信号途径干预NAFLD的进展。
肠道菌群和益生菌可减轻肝脏炎症。研究结果表明,益生菌是另一种有益于治疗部分慢性肝脏疾病包括NAFLD的一种新方法[22]。益生菌可明显改善ALT和多糖抗体水平,而不依赖于体重、腰围和腹部脂肪变化[23]。微生态制剂用于儿童NAFLD的治疗前景广阔。
多不饱和脂肪酸种类较多,如ω-3脂肪酸等。儿童NAFLD双盲RCT研究[24]显示,口服半年ω3-二十二碳六烯酸(DHA)可明显改善“明亮肝”和胰岛素敏感性,且小剂量即有效。
6.3有发展前景的新治疗方法
肠促胰岛素类似物和DPP-4抑制剂可增加胰岛素敏感性。肠促胰岛素类似物艾塞那肽,可降低2型糖尿病患者的空腹和餐后血糖。利拉鲁肽可抑制DPP-4的降解[25]。选择性DPP-4抑制剂西格列汀可提升GLP-1、GIP水平。
胆汁酸受体(FXRs)是一类可能参与NAFLD发生的NRs。胆汁酸可介导以下功能:改善血脂、调节葡萄糖代谢、减轻肝脏炎症和纤维化。故FXR受体激动剂或可用于治疗NAFLD[26]。
半胱胺酸是强力抗氧化剂,易透过细胞膜,提高脂联素多聚体含量,改善NAFLD。
己酮可可碱在成人可对抗TNF-α作用通路、降低ALT水平和改善组织学特征,但儿童患者的应用尚需更多研究支持。
Toll样受体家族(TLRs)中,TLR4和TLR9可能参与NAFLD的发病。TLRs的累积致NF-κB的激活,其可能参与炎症反应及NASH进展为NAFLD的机制。自然杀伤T细胞有抗TLRs通路的功能,故抗TLRs通路是一新思路[27]。
7 结论
儿童NAFLD与代谢异常综合征和心血管疾病患病风险有着复杂的因果关系。因此,开展先天遗传性或后天获得性NAFLD的发病机理研究迫在眉睫,且会有较高的临床诊断及治疗价值。目前儿童NAFLD的诊断取得一些成效,但通过大规模筛查高危儿童群体来寻求新的诊断方法势在必行。
[1]Day CP.Non-alcoholic fatty liver disease:A massive problem[J].Clin Med,2011,11(2):176-178.
[2]Brunt EM.Pathology of nonalcoholic fatty liver disease[J].Nat Rev Gastroenterol Heptal,2010,7(4):195-203.
[3]Mencin AA,Lavine JE.Advances in pediatric nonalcoholic fatty liver disease[J].Pediatr Clin North Am,2011,58(6):1375-1392.
[4]施红波,傅君芬,梁黎,等.肥胖儿童非酒精性脂肪肝病及代谢综合征发病情况分析[J].中华儿科杂志,2009,47(2):114-118.
[5]李洁冰.中西医结合治疗非酒精性脂肪性肝病[J].当代医学,2013,19(12):156-157.
[6]尹秀梅,缪珩.非酒精性脂肪性肝病与代谢综合征相关性的研究进展[J].医学综述,2013,19(17):3186-3189.
[7]Valenti L,Alisi A,Nobili V.I148M PNPLA3 variant and progressive liver disease:A new paradigm in hepatology[J].Hepatology,2012,56(2):1883-1889.
[8]Santoro N,Zhang CK,Zhao H,et al.Variant in the glucokinase regulatory protein(GCKR)gene is associated with fatty liver in obese children and adolescents[J].Hepatology,2012,55(3):781-789.
[9]Larter CZ,Chitturi S,Heydet D,et al.A fresh look at NASH pathogenesis.Part 1:The metabolic movers[J].J Gastroenterol Hepatol,2010,25(4):672-692.
[10]Manco M,Marcellini M,Devito R,et al.Metabolic syndrome and liver histology in paediatric non-alcoholic steatohepatitis[J].Int J Obes(Lond),2008,32(2):381-387.
[11]Alisi A,Carsetti R,Nobili V.Pathogen-or damage-associated molecular patterns during nonalcoholic fatty liver disease development[J].Hepatology,2011,54(5):1500-1502.
[12]De Minicis S,Svegliati-Baroni G.Fibrogenesis in nonalcoholic steatohepatitis[J].Expert Rev Gastroenterol Hepatol,2011,5(2):179-187.
[13]Adachi M,Brenner DA.High molecular weight adiponectin inhibits proliferation of hepatic stellate cells via activation of adenosine mono-phosphate-activated protein kinase[J].Hepatology,2008,47(2):677-685.
[14]Sanyal A.Nonalcoholic steatohepatitis[J].Indian J Gastroenterol,2001,20:C64-C70.
[15]Shulman AI,Mangelsdorf DJ.Retinoid x receptor heterodimers in the metabolic syndrome[J].N Engl J Med,2005,353(6):604-615.
[16]Feldstein AE,Charatcharoenwitthaya P,Treeprasertsuk S,et al.The natural history of non-alcoholic fatty liver disease in children:A follow-up to 20 years[J].Gut,2009,58(11):1538-1544.
[17]Vajro P,Lenta S,Socha P,et al.Diagnosis of nonalcoholic fatty liver disease in children and adolescents:Position paper of the ESPGHAN Hepatology Committee[J].J Pediatr Gastroenterol Nutr,2012,54(5):700-713.
[18]Shann on A,Alkhouri N,Carte r-Kent C,et al.Ultrasonographic quantitative estimation of hepatic steatosis in children with NAFLD[J].J Pediatr Gastroenterol Nutr,2011,53(2):190-195.
[19]Nobili V,Manco M,Devito R,et al.Lifestyle intervention and antioxidant therapy in children with nonalcoholic fatty liver disease:A randomized,controlled trial[J].Hepatology,2008,48(1):119-128.
[20]Lavine JE,Vitamin E.Treatment of nonalcoholic steatohepatitis in children:A pilot study[J].J Pediatr,2000,136(6):734-738.
[21]Schwimmer JB,Middleton MS,Deutsch R,et al.A phase 2 clinical trial of metformin as a treatment for non-diabetic paediatric non-alcoholic steatohepatitis[J].Aliment Pharmacol Ther,2005,21(7):871-879.
[22]Loguercio C,Federico A,Tuccillo C,et al.Beneficial effects of a probiotic VSL#3 on parameters of liver dysfunction in chronic liver diseases[J].J Clin Gastroenterol,2005,39(6):540-543.
[23]Vajro P,Mandato C,Licenziati MR,et al.Effects of lactobacillus rhamnosus strain GG in pediatric obobesityrelated liver disease[J].J Pediatr Gastroenterol Nutr,2011,52(6):740-743.
[24]Nobili V,Bedogni G,Alisi A,et al.Docosahexaenoic acid supplementation decreases liver fat content in children with non-alcoholic fatty liver disease:Double-blind randomized controlled clinical trial[J].Arch Dis Child,2011,96(4):350-353.
[25]Nguyen TA,Sanyal AJ.Pathophysiology guided treatment of nonalcoholic steatohepatitis[J].J Gastroenterol Hepatol,2012,27:58-64.
[26]Fiorucci S,Mencarelli A,Distrutti E,et al.Farnesoid X receptor:From medicinal chemistry to clinical applications[J].Future Med Chem,2012,4(7):877-891.
[27]Miura K,Seki E,Ohnishi H,et al.Role of toll-like receptors and their downstream molecole in the development of nonalcoholic fatty liver disease[J].Gastroenterol Res Pract,2010:362847.
New development of study in children non-alcoholic fatty liver disease
YUE Baozhu1WANG Anli1WANG Qingtu2
1.Department of Paediatrics,Maternal and Child Health Hospital of Weifang City in Shandong Province,Weifang 261011,China;2.Department of Internal Medicine,Maternal and Child Health Hospital of Weifang City in Shandong Province,Weifang261011,China
Non-alcoholic fatty liver disease(NAFLD)is a multi-faceted disorder,which ranges from simple steatosis to non-alcoholic steatohepatitis(NASH)with/without fibrosis.The effects of specific risk factors,such as obesity and sedentary lifestyle,on predisposing genetic settings eventually lead to the development of NAFLD.The complex interplay between genes and environment in NAFLD pathogenesis is sustained by multiple mechanisms that involve liver crosstalk with other organs and tissues,especially gut and adipose tissue.Unfortunately,natural history of pediatric NAFLD is lacking,and the etiopathogenesis is still in the process of being defined.Potential early predictors and suitable non-invasive diagnostic tools can be discovered based on the pathogenetic mechanisms and histological patterns.This will also helps to design novel treatments and a comprehensive and successful management strategy for patients.
NAFLD;NASH;Fibrosis;Children

图1 右侧腹腔妊娠孕囊周围条索状强回声包绕(见内文第83页)
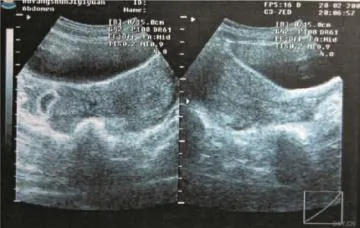
图2 残角子宫妊娠图像(见内文第83页)

图3 左侧阔韧带妊娠图像(见内文第84页)

图4 左侧卵巢妊娠孕囊内可见卵黄囊回声(见内文第84页)

图5 宫颈瘢痕妊娠图像(见内文第84页)

图6 某患者TTP、CBV和CBF图像。图A可见患者左侧脑室旁的白质达峰时间显著较对侧延长,如图红色区域所示;图B、C可见患者侧额叶及右侧颞叶后部CBV和CBF下降(见内文第87页)

图7 乳腺浸润性导管癌:实性癌巢浸润于间质内,癌巢稀少,周围促纤维组织增生。核深染,不规则,未见明显的核分裂像,胞质丰富,嗜酸性(见内文第127页)
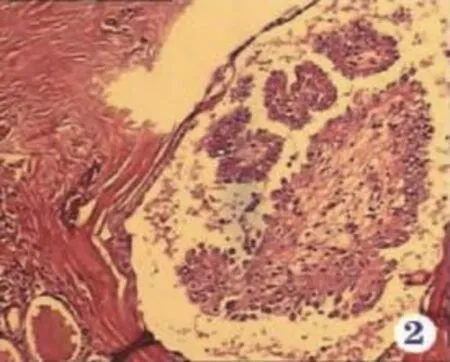
图8 甲状腺微小型多灶性乳头状癌:乳头分枝,水肿,衬复上皮细胞极向紊乱,胞浆淡染嗜酸性。核增大,卵圆形,核重叠呈毛玻璃样,并见核沟(见内文第128页)
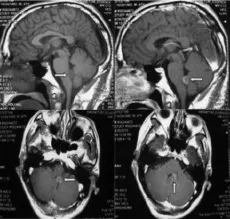
图9 箭头所指处为脑转移肿瘤(见内文第129页)
R725.7
A
1673-9701(2015)07-0157-04
(2014-12-29)
