皱纹盘鲍群体选育第四代成鲍4种多糖裂解酶基因表达的初步研究
2015-12-02何庆国王劭雯李加琦
何庆国 , 王劭雯 , 李加琦 , 刘 晓
(1. 中国科学院 海洋研究所, 山东 青岛266071; 2. 中国科学院大学, 北京100049)
藻类是皱纹盘鲍(Haliotis discus hannai Ino)最重要的天然食物。鲍幼体阶段主要摄食底栖硅藻, 幼鲍和成鲍则主要摄食褐藻、红藻、绿藻等大型藻类。人工养鲍时, 海带(Laminaria japonica)是皱纹盘鲍最常用的饲料[1-2]。藻类的主要成分是多糖, 而皱纹盘鲍的多糖裂解酶在消化利用多糖类物质的过程中起关键作用。鲍的多糖裂解酶很早就受到人们关注,1978年Clark等[3]报道了彩虹鲍(H. iris)消化腺提取液对14种多糖底物的水解酶活性, 并探讨了这些酶作为商用酶制剂的可能性。此后, 中国学者也陆续报道了对皱纹盘鲍[4-7]和杂色鲍[8-10]多糖裂解酶的相关研究结果, 但上述研究均着眼于酶的活性或理化性质, 对它们的表达调控相关知识的了解仍很欠缺。
近10年来, 皱纹盘鲍褐藻酸酶(hdaly)[11]、海带淀粉酶(hdlam)[12]、纤维素酶(hdcel)[13]和盘鲍(H.discus discus)α-淀粉酶(hdamyl)[14]与纤维素酶[15]基因的 cDNA全长序列相继发表。为探讨皱纹盘鲍对多糖类物质的消化利用状况, 作者根据已发表序列信息设计了相关引物, 尝试在 mRNA水平研究这些酶的表达调控[16]。本研究使用的实验材料是中国科学院海洋研究所和大连市水产研究所培育的皱纹盘鲍“97”群体的选育第四代。该选育群体始建于1997年, 是以中国野生群体为母本与从日本岩手县引进的皱纹盘鲍进行群体间杂交培育的杂交苗种经过连续高强度选育而培育的皱纹盘鲍选育系。皱纹盘鲍“97”选育群体具有存活率高、适温范围广、生长速度快、整齐度高等特点[17], 作者从2008年开始对该选育群体开展了一系列的生理研究[16-18], 本文报道对皱纹盘鲍“97”选育群体 2龄成体消化酶基因表达研究的部分结果。
1 材料与方法
1.1 实验动物
供试样品为皱纹盘鲍“97”群体选育第4代的2龄成鲍, 平均壳长为(63.38±4.08)mm, 活体平均体重为(28.9±6.4)g。所用群体于2008年4月在山东荣成寻山渔业集团总公司繁殖, 经福建宁德海区完成越冬培育后在荣成桑沟湾海区笼养至次年11月, 海区养殖期间投喂的饵料为海带。2009年12月至翌年4月, 在中国科学院海洋研究所水族楼的循环水养殖系统中培育, 期间每日投喂新鲜海带, 由中科海WK-3000控温仪(控温精度<±0.1℃)与加热棒调节培育水温在(20±0.5)℃。
1.2 取样
在20℃恒温培育120 d后取部分个体, 逐个编号后分离每个个体的各种组织, 用 RNAwait试剂保存分离组织用于提取 RNA, 同时取足部肌肉于–80℃冻存用于提取DNA。
1.3 DNA和总RNA的提取
随机取4个个体的足部肌肉组织, 采用SQ组织DNA提取试剂盒(Omega公司产品)提取DNA。同时,分别取上述个体的消化腺、足部肌肉组织、外套膜、触手、鳃组织, 采用总RNA提取试剂盒(BioFlux公司产品)提取总RNA, 逆转录后的产物于-20℃冻存备用。
1.4 荧光定量PCR引物设计
根据已发表的皱纹盘鲍 β-actin、褐藻酸酶、海带淀粉酶、纤维素酶基因和盘鲍α-淀粉酶基因的cDNA序列信息, 应用Primer Premier 5.0软件设计荧光定量PCR引物, 引物信息见表1。

表1 引物相关信息Tab.1 Primers used in this study
1.5 扩增产物的克隆测序
以皱纹盘鲍的DNA和cDNA为模板, 分别使用表 1中的引物进行 PCR扩增, 反应体系 20 μL, 含cDNA 2.5 ng, 正反向引物各10μmol/L, Taq酶 0.5U。扩增条件: 94℃预变性5 min; 94℃ 30 s, 58℃ 30 s,72℃ 1 min, 共35个循环; 最后72℃延伸10 min。扩增产物用 1.5%琼脂糖凝胶电泳分离, 目标条带回收后连接到质粒载体 pMD18-T上, 转化 E.coli Trans1-T1, 经 LB固体培养基 37℃培养 12~14h后,挑取单克隆进行PCR鉴定, 阳性克隆在LB液体培养基中37℃振荡培养5~6h, 送交华大基因公司测序。
1.6 半定量PCR分析
以不同组织的cDNA为模板, 对4种多糖裂解酶基因进行半定量PCR分析。反应体系和条件同1.5。扩增产物用1.5%琼脂糖凝胶电泳检测。
1.7 荧光定量PCR分析
标准曲线: 对已知浓度的皱纹盘鲍消化腺cDNA进行5倍比例稀释, 共稀释成4个浓度, 每个浓度2次重复, 进行PCR扩增。以Ct值为纵坐标、起始模板浓度的对数值为横坐标建立标准曲线。
以皱纹盘鲍不同组织 cDNA为模板进行实时荧光定量PCR扩增, 每个反应重复4次。反应体系如下: cDNA 1μL, 正反向引物各 1μL (10μmol/L), 2×SYBR Green预混液 10μL, 加双蒸水到20μL。采用二步法进行扩增: 95℃ 预变性30 s后, 95℃变性5 s、60℃ 退火30 s, 共40个循环。
1.8 数据处理与分析
通过对荧光定量 PCR反应体系进行优化, 使扩增效率为 95%~105%, 采用 2–Δct法计算各目的基因相对于看家基因的表达量[18-19]。扩增效率 E=10–1/K-1(K为标准曲线的斜率)。
数据显著性采用SPSS(Ver.11.5)软件进行统计分析。所有实验数据均以平均值±标准误(±SE)来表示。对测序结果, 应用NCBI网站上的BLAST工具与GenBank数据库中的目的基因序列进行比对分析。
2 结果与分析
2.1 扩增效率及熔解曲线分析
经电泳检测, β-actin、hdaly、hdlam、hdamyl和hdcel的扩增效率分别为96.6%、101.3%、104.4%、93.4%、96.4%。熔解曲线峰值基本一致, 无杂峰, 产物特异度好。
2.2 4种多糖裂解酶基因的扩增结果
以皱纹盘鲍肌肉组织DNA和消化腺cDNA为模板, 分别用表1所列引物进行扩增。PCR产物经1.5%琼脂糖凝胶电泳检测, 结果见图 1。由图 1可知,β-actin和 4种多糖裂解酶基因的扩增产物条带清晰单一, 未见非特异性扩增; 以cDNA为模板所得扩增片段在 100~200bp范围内, 长度与预期一致; 以DNA为模板扩增时, 褐藻酸酶与海带淀粉酶基因的产物与 cDNA 模板所得产物大小相近, 但α-淀粉酶和纤维素酶基因的扩增产物分别在 600bp和 800bp左右, 远大于以cDNA为模板的产物, 推测该区域存在内含子序列。
2.3 扩增产物的序列和SNP
将图1中P1-P9的产物分别克隆, 各取2个克隆测序。经生物信息学分析知: (1)用cDNA模板分别扩增得到β-actin基因、褐藻酸酶(hdaly)、海带淀粉酶(hdlam)、α-淀粉酶(hdamyl)及纤维素酶(hdcel)基因片段的长度分别为175 bp、116 bp、177 bp、188 bp和162bp, 产物长度符合预期, 除纤维素酶基因片段存在 2个碱基差异外, 其他基因片段与盘鲍或皱纹盘鲍已发表基因的相应片段一致; (2)纤维素酶基因片段的2个碱基差异位于其DNA全长序列(AB125892.1)的第8349和第8361处, 分别是甘氨酸和苏氨酸密码子的末位碱基, 甘氨酸密码子由GGC变为GGT, 苏氨酸由 ACT变为 ACC(图 2), 均属同义突变; (3)用DNA模板得到的纤维素酶(图 2)和α-淀粉酶(图 3)基因片段分别为 829bp和 626bp, 生物信息学分析确认分别包含667bp和 438bp的内含子序列。纤维素酶基因的内含子序列与已发表序列相比, 存在 2个SNP(插入2个碱基)。
2.4 皱纹盘鲍多糖裂解酶基因表达的组织特异性
皱纹盘鲍不同组织的cDNA用表1所列引物扩增结果见图 4。可见内参基因 β-actin在不同组织中的扩增产物亮度基本一致, 但纤维素酶(hdcel)、α-淀粉酶(hdamyl)、褐藻酸酶(hdaly)和海带淀粉酶(hdlam)基因的扩增产物量在相同个体的不同组织间有极显著差异, 均主要在消化腺中表达。但在鳃、足部肌肉组织、触手和外套膜中也能检测到α-淀粉酶(hdamyl)基因的微弱信号。
2.5 皱纹盘鲍 4种多糖裂解酶基因组织特异性表达的定量检测
用Real-time PCR检测4种多糖裂解酶基因在皱纹盘鲍不同组织中的相对表达量, 结果如表2所示。可见, 4种多糖裂解酶基因在消化腺中的相对表达量极显著地高于其他组织, 相反, 在鳃、足部肌肉组织、外套膜和触手等组织中的表达量则极低。并且,消化腺中 4种多糖裂解酶基因的相对表达量依次为褐藻酸酶>纤维素酶>α-淀粉酶>海带淀粉酶。此外, 褐藻酸酶和纤维素酶基因的表达量极显著地高于α-淀粉酶和海带淀粉酶(P<0.01)。
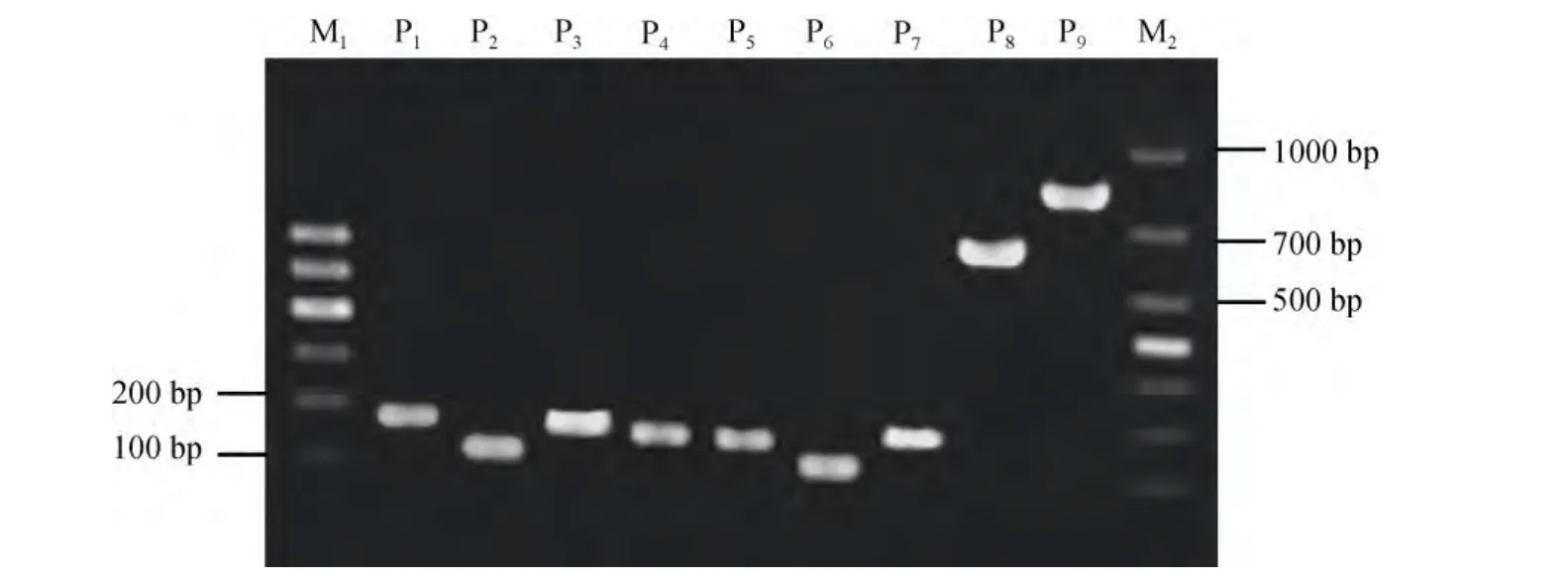
图1 β-actin、hdaly、hdlam、hdamyl和hdcel的扩增结果Fig.1 PCR products of β-actin, hdaly, hdlam, hdamyl and hdcel gene

图2 纤维素酶基因DNA扩增产物的序列分析Fig.2 Sequence analysis of DNA amplification products of cellulase gene

图3 α-淀粉酶基因DNA扩增产物的序列分析Fig.3 Sequence analysis of DNA amplification products of α-amylase gene
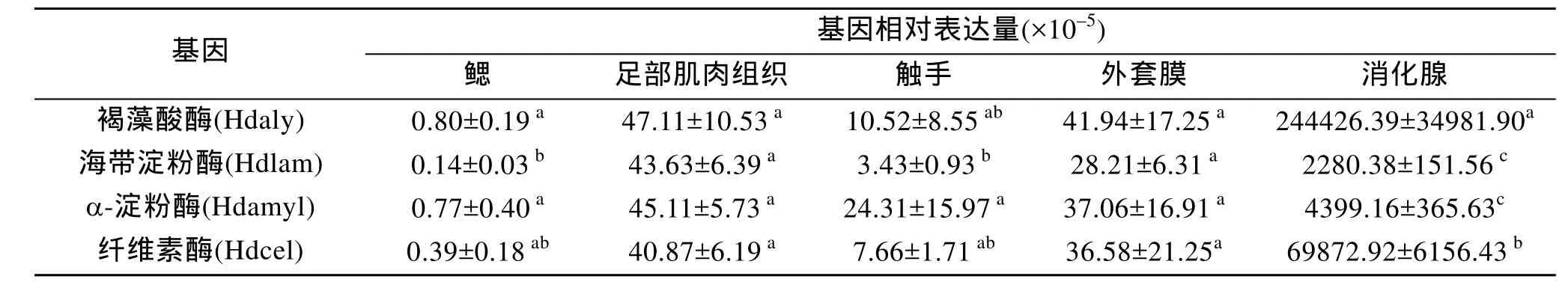
表2 4种多糖裂解酶基因在皱纹盘鲍不同组织中的相对表达量Tab.2 The expression of four polysaccharide lyase genes of Haliotis discus hannai Ino in different tissues
3 讨论
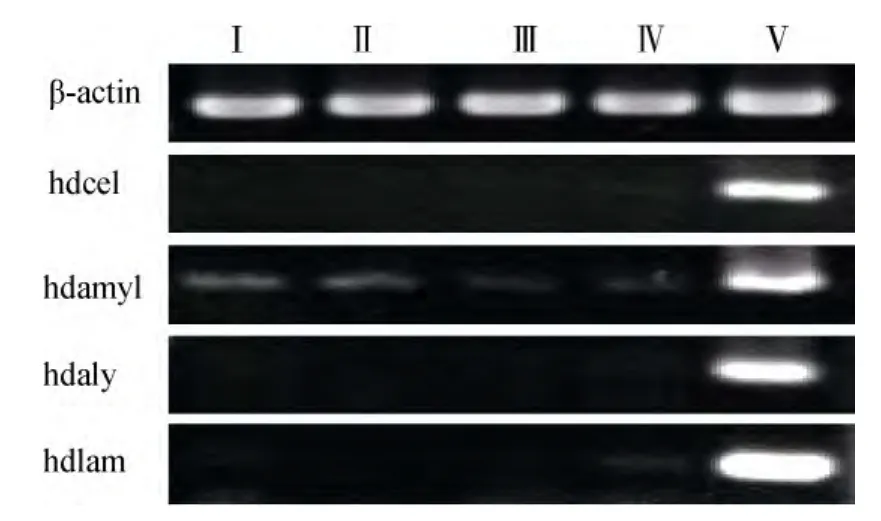
图4 皱纹盘鲍不同组织中4种多糖裂解酶基因的相对表达量Fig.4 Four kinds of polysaccharide lyase gene expression tested by Semi-quantitative PCR
自然状态下, 褐藻、红藻和绿藻都是鲍的常见食物, 但混合投喂实验表明皱纹盘鲍成体优先选择褐藻[20]。褐藻酸是褐藻特有的重要多糖组分。我国生产上用于喂养皱纹盘鲍的最常用藻类是海带, 且青岛、大连地区收获的海带褐藻酸含量最高可达干品的约 30%[21]。与淀粉、纤维素等多糖不同, 褐藻酸由古罗糖醛酸和甘露糖醛酸 2种单糖组成, 而非葡萄糖。褐藻酸中的α-L-古罗糖醛酸(M)和β-D-甘露糖醛酸(G)各自或相互交替或无规则地通过1, 4糖苷键或少量的1, 5糖苷键连接成长链状的多糖分子[21]。本研究定量分析的皱纹盘鲍褐藻酸酶是 α-1, 4-聚古罗糖醛酸裂解酶, 该酶只水解褐藻酸大分子中相邻L-古罗糖醛酸(M-M)间的α-1, 4糖苷键, 因此, 该酶的mRNA表达量可部分反映供试皱纹盘鲍对褐藻酸的消化利用情况。
实时定量PCR是定量研究基因表达的一种有效方法。本研究在转录水平对 4种多糖裂解酶基因在皱纹盘鲍“97”选育群体第 4代成体不同组织间的表达特征进行了定量分析, 同时测定了 PCR扩增产物的序列。本研究结果表明, 皱纹盘鲍“97”群体选育第4代2龄成体消化腺中表达最强的是褐藻酸酶基因, 其次为纤维素酶基因, 相比之下, α-淀粉酶和海带淀粉酶基因的表达量则低很多。2龄成鲍褐藻酸酶基因的相对表达量达到了α-淀粉酶和海带淀粉酶的50倍以上(表2), 而此前已有研究报道摄食海带的1龄幼鲍消化腺提取物对褐藻酸的水解活性高于对淀粉的水解活性[6]。综合上述结果可见, 在皱纹盘鲍消化腺中不仅褐藻酸酶mRNA表达量显著高于纤维素酶与淀粉酶(表 2), 而且褐藻酸酶的活力水平也显著高于淀粉酶[6]。据此推测成体皱纹盘鲍对褐藻酸的利用可能高于纤维素、淀粉等其他多糖。然而, 皱纹盘鲍喜食海带等褐藻与其消化腺中褐藻酸酶基因的高表达是否相关, 值得进一步研究。
本文的结果为进一步开展皱纹盘鲍“97”选育群体在不同发育期、摄食不同藻类及不同培育环境下的多糖水解酶基因表达研究奠定了基础。
[1] 赵洪恩. 鲍的增养殖[M]. 第一版. 沈阳: 沈阳出版社, 1999: 1-25.
[2] 聂宗庆, 王素平, 燕敬平, 等. 鲍科学养殖百问百答[M]. 北京: 中国农业出版社, 2011: 19-28.
[3] Clark A G, Jowett D A. Hydrolytic enzymes of the paua Haliotis iris, a marine gastropod (Note) [J]. New Zealand Journal of Marine and Freshwater Research,1978, 12(2): 221-222.
[4] 王运吉, 刘金珍, 孙勉英, 等. 鲍鱼酶的制备及其性质[J]. 生物化学与生物物理进展, 1990, 17(4): 302-304.
[5] 李太武, 丁明进. 皱纹盘鲍消化酶的研究[J]. 水产科学, 1995, 15(5): 3-7.
[6] 杨蕙萍, 童圣英. 皱纹盘鲍淀粉酶和褐藻酸酶的研究[J]. 水产学报, 1998, 22(40): 345-351.
[7] 康平, 汪秋宽, 宋琳琳, 等. 皱纹盘鲍内脏酶的酶学性质及褐藻胶裂解酶的分离纯化[J]. 水产学报, 2007,31(1): 15-22.
[8] 吴永沛, 何碧烟. 九孔鲍褐藻酸酶、琼脂酶及纤维素酶的提取纯化[J]. 海洋科学, 2002, 26(3): 4-7.
[9] 吴永沛, 蔡慧农. 金属离子和 pH值对九孔鲍几种消化酶活力的影响[J]. 海洋科学, 2003, 27(5): 66-69.
[10] 黄勃, 王林桂, 李二超. 杂色鲍与九孔鲍消化酶活力的比较[J]. 水产学报, 2003, 27(2): 119-123.
[11] Shimizu E, Ojima T, Nishita K. cDNA cloning of an alginate lyase from abalone, Haliotis discus hannai [J].Carbohydr Res, 2003, 338(24): 2841-2852.
[12] Kumagai Y, Ojima T. Enzymatic properties and the primary structure of a β-1, 3-glucanase from the digestive fluid of the Pacific abalone[J]. Comp Biochem Physio Part B, 2009, 154(1): 113-120.
[13] Suzuki K, Ojima T, Nishita K. Purification and cDNA cloning of a cellulase from abalone Haliotis discus hannai [J]. Eur J Biochem, 2003, 270(4): 771-778.
[14] Nikapitiya C, Oh C, Whang I, et al. Molecular characterization, gene expression analysis and biochemical properties of α-amylase from the disk abalone, Haliotis discus discus [J]. Comp Biochem Physio Part B, 2009, 152(3): 271-281.
[15] Nikapitiya C, Oh C, Zoysa M D, et al. Characterization of beta-1, 4-endoglucanase as a polysaccharidedegrading digestive enzyme from disk abalone, Haliotis discus discus [J]. Aquacult Int, 2010, 18(6): 1061-1078.
[16] 何庆国. 皱纹盘鲍 4种多糖裂解酶基因的表达研究[D]. 青岛: 中国科学院海洋研究所硕士学位论文, 2011.
[17] 李加琦. 皱纹盘鲍配套杂交体系的建立、评价及应用[D].青岛: 中国科学院海洋研究所博士学位论文, 2011.
[18] Li J Q, He Q G, Sun H, Liu X. Acclimation-dependent expression of heat shock protein 70 in Pacific abalone(Haliotis discus hannai Ino) and its acute response to thermal exposure[J]. Chinese Journal of Oceanology and Limnology. 2012, 30(1): 146-151.
[19] 纪冬, 辛绍杰. 实时荧光定量 PCR的发展和数据分析[J]. 生物技术通讯, 2009, 4: 598-600.
[20] 聂宗庆, 燕敬平. 皱纹盘鲍成体摄食习性的初步研究[J]. 水产学报, 1985, 9(1): 19-27.
[21] 纪明侯. 海藻化学[M]. 北京: 科学出版社, 1997:208-255.
