白细胞介素22诱导HaCaT细胞表达肝素结合表皮生长因子样生长因子的作用机制探讨
2015-11-29刘欣欣罗素菊郑焱许文娟李颖刘全忠
刘欣欣 罗素菊 郑焱 许文娟 李颖 刘全忠
白细胞介素22诱导HaCaT细胞表达肝素结合表皮生长因子样生长因子的作用机制探讨
刘欣欣 罗素菊 郑焱 许文娟 李颖 刘全忠
目的 探讨白细胞介素22(IL-22)诱导HaCaT细胞表达肝素结合表皮生长因子样生长因子(HBEGF)的相关作用机制。方法 用不同浓度的IL-22(12.5、25、50、100μg/L)干预处理HaCaT细胞,对照组选择等量磷酸盐缓冲液(PBS)处理。24 h后,提取HaCaT细胞总蛋白进行蛋白免疫印迹,检测丝裂原活化蛋白激酶-细胞外信号调节激酶1/2(MAPK-ERK1/2)通路中磷酸化ERK1/2(P-ERK1/2)的表达和转录激活因子途径(JAK/STAT)中磷酸化 JAK2(P-JAK2)和磷酸化 STAT3(P-STAT3)的表达。将HaCaT细胞分 4组,分别用 PBS、IL-22、MAPK-ERK1/2抑制剂PD98059、JAK2/STAT3通路抑制剂AG490与IL-22共同干预HaCaT细胞,24 h后,提取细胞总蛋白和总mRNA,分别用蛋白免疫印迹法和实时定量逆转录(RT)-PCR法检测不同处理组HB-EGF蛋白和mRNA水平的改变。采用SPSS16.0软件进行单因素方差分析检验组间差异,Bonferroni检验进行多重比较。结果 不同浓度的IL-22干预处理后,HaCaT细胞中P-ERK1/2、P-JAK2和P-STAT3蛋白表达均高于对照组(P<0.05)。HB-EGF蛋白水平(HB-EGF/内参照的灰度比值)在PD98059组和AG490组分别为0.183±0.020和0.199±0.011,与 IL-22组(0.924±0.032)相比,差异具有统计学意义(F值分别为37.700、36.400,均P<0.05)。HB-EGF mRNA水平在PD98059组和AG490组分别为1.034±0.072和0.989±0.038,与IL-22组(1.844±0.135)相比,差异具有统计学意义(F值分别为11.271、13.429,均P<0.05)。结论 IL-22可以引起HaCaT细胞中MAPK-ERK1/2和JAK2/STAT3这两条信号通路激活。IL-22诱导HaCaT细胞产生HB-EGF蛋白的作用机制可能与MAPK-ERK1/2和JAK2/STAT3这两条信号通路有关。
白细胞介素-22;成纤维细胞生长因子1;角蛋白细胞;丝裂原激活蛋白激酶类;Janus激酶2;STAT3转录因子;银屑病;HaCaT细胞
目前研究认为,银屑病的发病机制主要是由T细胞介导的以表皮角质形成细胞为靶点的免疫应答反应。在其发病过程中Th17、Th22细胞及其细胞因子发挥重要作用。白细胞介素22(IL-22)为Th22细胞分泌的主要细胞因子,参与调节机体免疫反应。国内外研究表明,银屑病患者外周血及皮损中IL-22水平较健康人高,且IL-22水平的高低与银屑病严重程度密切相关[1-3]。肝素结合表皮生长因子样生长因子(HB-EGF)是表皮生长因子家族中的一员,可促进细胞的增殖,在银屑病皮损中表达增高,并且其表达量与银屑病病情相关[4],提示其在银屑病表皮异常增殖中发挥重要作用。以往研究表明,细胞外调节蛋白激酶(ERK)和信号转导与转录激活因子3(STAT3)这两种信号通路蛋白在角质形成细胞增殖信号传导中至关重要[5]。我们的研究表明,IL-22可在基因和蛋白水平促进HaCaT细胞HBEGF的表达(未发表)。在本研究中,我们检测IL-22对丝裂原活化蛋白激酶(MAPK-ERK1/2)通路中磷酸化ERK1/2(P-ERK1/2)和转录激活因子途径(JAK/STAT)中磷酸化JAK2(P-JAK2)和磷酸化STAT3(P-STAT3)的影响,并通过抑制其信号传导检测其是否影响HaCaT细胞HB-EGF的表达,探讨其可能的作用机制。
材料和方法
一、实验材料
1.实验细胞:HaCaT细胞系德国柏林自由大学本杰明·富兰克林医学中心惠赠,为我实验室长期冻存细胞。
2.主要试剂:重组人IL-22(美国Protein Specialists 公 司),P-ERK1/2、P-JAK2、JAK2、PSTAT3、STAT3、辣根过氧化物酶标记(HRP)-羊抗兔的二抗(美国CST公司),β肌动蛋白、HRP-羊抗鼠的二抗、HRP-兔抗山羊二抗(北京中杉金桥公司),ECL发光显色液、荧光Mix(美国Invitrogen公司),PD98059、AG490(美国 Millipore公司),DMEM培养基(美国Gibico公司),Thermo逆转录试剂盒(美国Thermo公司),HB-EGF抗体、HB-EGF蛋白ELISA试剂盒(美国RD公司)。HB-EGF及β肌动蛋白的引物由生工生物工程(上海)股份有限公司合成。
3.主要仪器:酶联免疫检测仪(美国Biotek公司),凝胶成像系统仪(英国Cambridge公司),实时定量PCR仪(美国Bio-Rad公司),CO2孵育箱(美国Forma Scientific公司)。
二、实验方法
1.HaCaT细胞的复苏与培养:将冻存的HaCaT细胞复苏后,用含10%胎牛血清(FBS)的DMEM培养液,于5%CO2、37℃条件下培养。待HaCaT细胞90%融合后,用0.25%胰酶/乙二胺四乙酸(EDTA)消化进行传代培养。
2.HaCaT细胞的干预处理:将经传代培养后处于对数生长期的细胞消化后,以1×105/ml接种于6孔板,37℃、5%CO2孵育培养。待细胞70%~80%融合时,进行饥饿处理2~3 h后,更换新的培养液,分别用 12.5、25、50、100μg/L 重组人 IL-22 进行干预,对照组用等量磷酸盐缓冲液(PBS)干预。继续于37℃、5%CO2孵育培养 24 h。
3.蛋白免疫印迹检测信号通路相关蛋白:干预处理后的HaCaT细胞,用预冷PBS洗3遍,每孔加300μl细胞裂解液和2μl蛋白酶抑制剂苯甲基磺酰氟(PMSF)。冰上裂解30min,用EP管收集细胞裂解液离心10min。测蛋白浓度后进行Western印迹。取上清,10%聚丙烯酰胺凝胶蛋白电泳,每孔上样量 25μl,电泳 90min,稳流 300 mA 转膜 40min,转膜后的硝酸纤维素膜分别用兔抗人一抗(PERK1/2、P-JAK2、JAK2、P-STAT3、STAT3)4 ℃孵育过夜,后洗涤,用二抗(HRP标记的羊抗兔二抗)室温孵育2 h,ECL暗室曝光显色。检测P-ERK1/2、PSTAT3、P-JAK2的表达情况。每组实验重复3次。
4.细胞信号通路阻断剂阻断实验:
(1)细胞干预处理:对接种培养的HaCaT细胞分为4 组:①阴性对照组:PBS;②IL-22 组:50μg/L IL-22;③PD98059 组:50μmol/L PD98059+50μg/L IL-22;④AG490 组:50μmol/L AG490+50μg/L IL-22。抑制剂的选择及使用浓度参照文献[6-7]。
(2)蛋白免疫印迹检测HB-EGF蛋白水平的改变:干预培养24 h后,按上述方法提取各组细胞的总蛋白进行蛋白免疫印迹,检测HB-EGF蛋白水平的改变。实验重复3次。
(3)实时荧光定量RT-PCR检测HB-EGF基因水平的改变:干预处理24 h后吸去培养液,用PBS洗2遍,用Trizol试剂提取细胞总RNA,用紫外分光光度计测吸光度(A260nm/A280nm),检测RNA的纯度及浓度。应用逆转录试剂盒合成cDNA。荧光定量PCR 反应体系:25μl,冰上加样荧光定量 Mix12.5μl,上下游引物各 0.25μl,模板 cDNA 2μl,无 RNA 酶的双蒸水10μl。按照试剂盒说明设定反应条件50℃2min促使尿嘧啶-DNA糖基化酶(UDG)激活:然后95℃,2min预变性,1个循环;95℃15 s变性,60℃1min退火延伸,40个循环。进行熔解曲线分析判定PCR反应的特异性。HB-EGF上游引物:5′-GGCTCCCTCCTGCATCTG-3′,下游引物:5′-AGGAT GGTTGTGTGGTCATAGGT-3′。β肌动蛋白上游引物:5′-CCTGGCACCCAGCACAAT-3′,下游引物:5′-CTGATCCACATCTGCTGGAA-3′。合成的cDNA进行实时定量PCR扩增。每个样本设3个复孔。上述RT-PCR实验重复3次。
(4)ELISA法检测HB-EGF蛋白的表达:采用双抗体夹心ELISA法,参照试剂盒使用说明书进行。用酶标仪在450 nm波长处测量各孔的吸光度。每个样本重复3次。制作样品浓度标准曲线,并据其计算各样品的浓度。应用二喹啉甲酸(BCA)法测样品总蛋白浓度。统计不同样品HB-EGF蛋白浓度与总蛋白浓度的比值。
三、统计结果处理
结 果
一、IL-22干预后HaCaT细胞中P-ERK1/2、PSTAT3、P-JAK2蛋白的表达
免疫印迹结果显示,12.5、25、50、100μg/L IL-22干预处理后,HaCaT细胞MAPK通路中P-ERK1/2表达量、JAK2/STAT3通路中P-STAT3表达量、PJAK2表达量均较对照组升高(表1),且与IL-22浓度有一定相关关系。3次重复实验结果类似(图1、2)。参照课题组前期研究及信号通路蛋白表达选择50μg/L的IL-22进行信号通路阻断实验。
表1 IL-22干预后HaCaT细胞中P-ERK1/2、P-STAT3、P-JAK2蛋白的表达量(与β肌动蛋白灰度比值,±s)
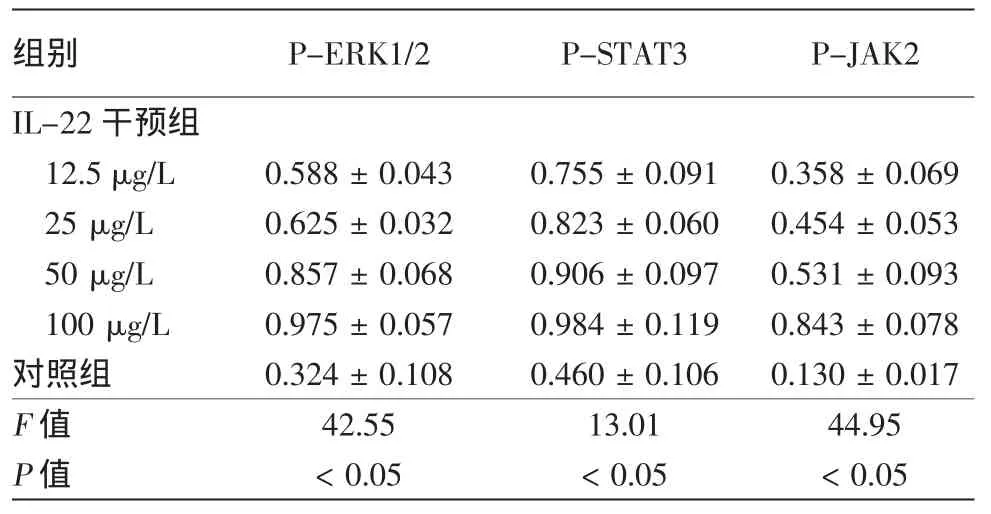
表1 IL-22干预后HaCaT细胞中P-ERK1/2、P-STAT3、P-JAK2蛋白的表达量(与β肌动蛋白灰度比值,±s)
注:n=3
组别 P-ERK1/2 P-STAT3 P-JAK2 IL-22干预组12.5μg/L 0.588±0.043 0.755±0.091 0.358±0.069 25μg/L 0.625±0.032 0.823±0.060 0.454±0.053 50μg/L 0.857±0.068 0.906±0.097 0.531±0.093 100μg/L 0.975±0.057 0.984±0.119 0.843±0.078对照组 0.324±0.108 0.460±0.106 0.130±0.017 F值 42.55 13.01 44.95 P值 <0.05 <0.05 <0.05
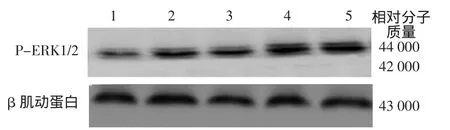
图1 白细胞介素22(IL-22)对HaCaT细胞MAPK通路蛋白ERK及P-ERK表达的影响 1:对照组;2~5:分别为12.5、25、50、100μg/L IL-22 组

图2 白细胞介素22(IL-22)对HaCaT细胞JAK2/STAT3通路蛋白表达的影响 1:对照组;2~5:分别为12.5、25、50、100μg/L IL-22组

图3 部分信号通路阻断HaCaT细胞中肝素结合表皮生长因子样生长因子的表达 1:对照组;2:50μg/L IL-22;3:50μg/L IL-22+PD98059;4:50μg/L IL-22+AG490
二、通路阻断实验结果
1.加入信号通路阻断剂后HB-EGF蛋白水平的改变:蛋白免疫印迹结果显示,在加入信号通路阻断剂后,HB-EGF蛋白表达量(HB-EGF/β肌动蛋白灰度比值)PD98059组为0.183±0.020,较IL-22组(0.924±0.032) 降低(F=37.700,P<0.05);AG490组(0.199±0.011)也较IL-22组降低(F=36.400,P<0.05)。结果见图3。
2.加入信号通路阻断剂后HB-EGF mRNA水平的变化:加入信号通路阻断剂后HB-EGF mRNA表达水平均较IL-22组减少。PD98059组HB-EGF mRNA表达水平(2-ΔΔCt)为1.034±0.072,较IL-22组(1.844±0.135)降低(F=11.271,P<0.05);同时AG490组(0.989±0.038)较IL-22组亦降低(F=13.429,P<0.05)。
三、不同干预处理组HB-EGF蛋白的浓度与总蛋白浓度的比值
在加入信号通路抑制剂后,HB-EGF蛋白表达均较IL-22组降低。HB-EGF与总蛋白浓度比值在对照组为(0.816±0.152)× 10-3,PD98059 组为(0.852±0.159)×10-3,AG490组为(1.049±0.166)×10-3,后两组与 IL-22组(2.067±0.160)× 10-3比较均降低,F值分别为20.933、5.414,均P<0.05。
讨 论
本实验研究结果显示,IL-22可诱导HaCaT细胞MAPK信号通路中P-ERK1/2蛋白表达增加,加入MAPK-ERK1/2通路特异性抑制剂PD98059后,HB-EGF蛋白和mRNA的表达较未加抑制剂组明显降低。提示MAPK-ERK1/2信号通路在IL-22促进HB-EGF的表达中发挥重要作用。同样浓度IL-22干预后,JAK2/STAT3信号通路中P-JAK2和P-STAT3蛋白水平均明显升高。加入JAK2/STAT3通路抑制剂AG490后,HB-EGF无论从蛋白水平还是基因水平均较无抑制组降低。
有研究显示,IL-22可通过促进HaCaT细胞PERK1/2和P-STAT3升高进而引起角蛋白17升高[8]。HB-EGF可促进角质形成细胞的增殖和迁移。研究表明,HB-EGF在正常皮肤表皮中不表达或表达量很低,而在银屑病患者皮损中表达升高,其表达水平与银屑病的严重程度有一定的相关性,提示其在银屑病表皮异常增殖中发挥重要作用[9]。IL-22受体广泛分布于免疫细胞中,参与调控角质形成细胞、内皮细胞、成纤维细胞等其他组织细胞的增殖和分化,尤其在角质形成细胞的增殖、分化及免疫中起重要作用[10]。在银屑病皮损中IL-22受体较正常皮肤增多,提示IL-22受体参与银屑病的表皮异常增殖[11]。因此我们推测IL-22通过与HaCaT细胞表面IL-22受体结合引起细胞内通路激活。
银屑病皮损的棘层和基底层角质形成细胞中存在ERK1/2的磷酸化,并且与角质形成细胞的过度增殖相关[12-13]。另外,ERK1/2的磷酸化可促进T细胞活化、增殖和抗凋亡作用[14]。研究表明,在银屑病患者的皮损中STAT3表达明显升高[15-16]。在银屑病患者机体内STAT3参与Th17细胞信号传导过程,与角质形成细胞过度增殖和炎性浸润有关[17]。
综上所述,IL-22可使HaCaT细胞HB-EGF、PERK1/2蛋白、P-JAK2和P-STAT3蛋白水平升高。MAPK-ERK1/2通路特异性抑制剂PD98059和JAK2/STAT3通路抑制剂AG490可明显抑制HBEGF的表达,提示IL-22可能通过MAPK-ERK1/2和JAK2/STAT3这两条通路诱导HB-EGF的表达。提示阻断IL-22信号通路传导可减少HB-EGF的表达,进一步研究可能为治疗银屑病提供一个新的治疗途径。
[1]Kagami S,Rizzo HL,Lee JJ,et al.Circulating Th17,Th22,and Th1 cells are increased in psoriasis[J].J Invest Dermatol,2010,130(5):1373-1383.
[2]Sabat R,Wolk K.Research in practice:IL-22 and IL-20:significance for epithelial homeostasis and psoriasis pathogenesis[J].J Dtsch Dermatol Ges,2011,9(7):518-523.
[3]史玉玲,徐晓光,毕新岭,等.白介素22及其相关因子在银屑病患者血清及外周血单一核细胞中的表达[J].中华皮肤科杂志,2011,44(4):238-240.
[4]Yoshida A,Kanno H,Watabe D,et al.The role of heparin-binding EGF-like growth factor and amphiregulin in the epidermal proliferation of psoriasis in cooperation with TNFα [J].Arch Dermatol Res,2008,300(1):37-45.
[5]Wang Z,Jin C,Li H,et al.GPR48-Induced keratinocyte proliferation occurs through HB-EGF mediated EGFR transactivation[J].FEBS Lett,2010,584(18):4057-4062.
[6]Lee H J,Lee H J,Sohn EJ,et al.Inhibition of connexin 26/43 and extracellular-regulated kinase protein plays a critical role in melatonin facilitated gap junctional intercellular communication in hydrogen peroxide-treated HaCaT keratinocyte cells[J/OL].Evid Based Complement Alternat Med,2012,2012:589365[2013-09-06].http://www.hindawi.com/journals/ecam/2012/589365/.
[7]Boissel JP,Ohly D,Bros M,et al.The neuronal nitric oxide synthase is upregulated in mouse skin repair and in response to epidermal growth factor in human HaCaT keratinocytes[J].J Invest Dermatol,2004,123(1):132-139.
[8]Zhang W,Dang E,Shi X,et al.The pro-inflammatory cytokine IL-22 up-regulates keratin 17 expression in keratinocytes via STAT3 and ERK1/2[J/OL].PLoS One,2012,7(7):e40797[2013-06-09].http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0040797.
[9]Zheng Y,Peng Z,Wang Y,et al.Alteration and significance of heparin-bindingepidermal-growth-factor-like growth factorin psoriatic epidermis[J].Dermatology,2003,207(1):22-27.
[10]Sonnenberg GF,Fouser LA,Artis D.Functional biology of the IL-22-IL-22R pathway in regulating immunity and inflammation at barrier surfaces[J].Adv Immunol,2010,107:1-29.
[11]Tohyama M,Hanakawa Y,Shirakata Y,et al.IL-17 and IL-22 mediate IL-20 subfamily cytokine production in cultured keratinocytes via increased IL-22 receptor expression [J].Eur J Immunol,2009,39(10):2779-2788.
[12]Takahashi H,Ibe M,Nakamura S,et al.Extracellular regulated kinase and c-Jun N-terminal kinase are activated in psoriatic involved epidermis[J].J Dermatol Sci,2002,30(2):94-99.
[13]Haase I,Hobbs RM,Romero MR,et al.A role for mitogen-activated protein kinase activation by integrins in the pathogenesis of psoriasis[J].J Clin Invest,2001,108(4):527-536.
[14]Laatikainen LE,Incoronato M,Castellone MD,et al.SOD3 decreases ischemic injury derived apoptosis through phosphorylation of Erk1/2,Akt,and FoxO3a[J/OL].PLoS One,2011,6(8):e24456[2013-06-14].http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0024456.
[15]Sano S,Chan KS,Carbajal S,et al.Stat3 links activated keratinocytes and immunocytes required for development of psoriasis in a novel transgenic mouse model[J].Nat Med,2005,11(1):43-49.
[16]Andrés RM,Hald A,Johansen C,et al.Studies of Jak/STAT3 expression and signalling in psoriasis identifies STAT3-Ser727 phosphorylation as a modulator of transcriptional activity [J].Exp Dermatol,2013,22(5):323-328.
[17]LiuH,Moroi Y,Yasumoto S,et al.Immunohistochemical localization of activated Stat3 and hTERT protein in psoriasis vulgaris[J].Eur J Dermatol,2006,16(2):205-207.
2014-04-24)
(本文编辑:尚淑贤)
Mechanisms underlying interleukin-22-induced expression of heparin-binding epidermal growth factor-like growth factor in HaCaT cells
Liu Xinxin*,Luo Suju,Zheng Yan,Xu Wenjuan,Li Ying,Liu Quanzhong.*Department of Dermatology,Tianjin Medical University General Hospital,Tianjin 300052,China
Luo Suju,Email:luosuju2005@163.com
ObjectiveTo investigate the mechanisms underlying interleukin-22(IL-22)-induced expression of heparin-binding epidermal growth factor-like growth factor(HB-EGF)in HaCaT cells.MethodsSome HaCaT cells were divided into several inverention groups treated with IL-22 at concentrations of 12.5,25,50,100μg/L,respectively and a control group treated with phosphate buffer saline (PBS).After 24-hour culture,total proteins were extracted from the HaCaT cells,and Western blot was performed to measure the expression of phosphorylated extracellular signalregulated kinase 1/2 (P-ERK1/2)in the mitogen-activated protein kinase (MAPK)-ERK1/2 pathway,as well as phosphorylated-JAK2(P-JAK2)and phosphorylated-signal transducer and activator of transcription 3 (P-STAT3)in the JAK2/STAT3 pathway.In a blocking experiment,some HaCaT cells were divided into 4 groups to be treated with PBS,IL-22,PD98059 (an inhibitor of MAPK-ERK1/2)combined with IL-22 (PD98059 group),AG490 (an inhibitor of JAK2/STAT3)combined with IL-22 (AG490 group),respectively.After 24-hour treatment,total proteins and mRNAs were extracted from the HaCaT cells followed by Western blot and real-time quantitative reverse transcription-PCR for the measurement of protein and mRNA expressions of HB-EGF respectively.Statistical analysis was carried out with the software SPSS 16.0 by one-way analysis of variance (ANOVA)for intergroup comparisons and by Bonferroni′s test for multiple comparisons.ResultsAfter treatment with IL-22 at the above 4 concentrations,the expressions of P-ERK1/2,P-JAK2 and P-STAT3 in HaCaT cells were all increased compared with the control group(allP<0.05).The protein and mRNA expression levels(expressed as the HB-EGF/β-actin ratio and 2-△△Ctrespectively)of HB-EGF were both significantly decreased in the PD98059 group and AG490 group than in the IL-22 group(protein:0.183±0.020 and 0.199±0.011 vs.0.924±0.032,F=37.700,36.400,respectively,bothP<0.05;mRNA:1.034±0.072 and 0.989±0.038 vs.1.844±0.135,F=11.271,13.429,respectively,bothP<0.05).ConclusionsIL-22 can activate the MAPK-ERK1/2 and JAK2/STAT3 signaling pathways in HaCaT cells,which may contribute to IL-22-induced expression of HB-EGF in HaCaT cells.
Interleukin-22;Fibroblast growth factor 1;Keratinocytes;Mitogen-activated protein kinases;Janus kinase 2;STAT3 transcription factor;Psoriasis;HaCaT cells
10.3760/cma.j.issn.0412-4030.2015.03.009
国家自然科学基金(81201231、81371732)
300052天津医科大学总医院皮肤科(刘欣欣、罗素菊、许文娟、刘全忠),肺癌研究所(李颖);西安交通大学第二医院皮肤科(郑焱)
罗素菊,Email:luosuju2005@163.com
