常山酮防治放射性肺损伤及其机制的研究*
2015-11-23王鹏巩琳琳王帅刘宁波庞青松赵路军王平
王鹏 巩琳琳 王帅 刘宁波 庞青松 赵路军 王平
·基础研究·
常山酮防治放射性肺损伤及其机制的研究*
王鹏 巩琳琳 王帅 刘宁波 庞青松 赵路军 王平
目的:研究常山酮对放射性肺损伤的防治作用,并探索其可能机制。方法:健康雌性C57BL/6J小鼠72只,随机分为对照组、照射组、常山酮组及照射联合常山酮组,每组18只。对照组不做处理;常山酮组每只小鼠予常山酮灌胃1次/d,连续1个月或至处死;联合组灌胃方法同常山酮组,并于灌胃至15 d时予全肺6MV-X线单次照射12 Gy;照射组予全肺照射,照射时间及剂量同联合组;照射后24 h、1、2、4、12、20周各组随机处死3只,留取肺组织,H&E染色观察肺组织形态、羟脯氨酸碱水解法测定羟脯氨酸含量、免疫组织化学法及RT-PCR法测定TGF-β1的表达水平。结果:H&E染色结果示联合组小鼠各时间点肺泡炎症及(或)肺纤维化程度较照射组均明显减轻。联合组肺组织羟脯氨酸含量低于照射组,至照射后20周达统计学差异(P= 0.037)。免疫组织化学及RT-PCR结果示照射后各时间点照射组及联合组肺组织中TGF-β1表达水平均高于对照组及常山酮组(均P<0.05);联合组TGF-β1蛋白表达水平于照射后2、4、12、20周显著低于照射组(均P<0.05),TGF-β1 mRNA水平于照射后4、12周显著低于照射组(均P<0.05)。结论:常山酮可抑制胸部照射后小鼠肺组织炎性及纤维化改变,这可能是通过抑制放射导致的肺组织中TGF-β1表达升高引起的,有望将常山酮开发为防治放射性肺损伤的新型药物。
常山酮 转化生长因子-β1 放射性肺损伤 羟脯氨酸
放射性肺损伤是影响胸部肿瘤放射治疗疗效的重要因素之一,近年来关于放射性肺损伤细胞及分子水平的研究越来越多,但放射性肺损伤的防治仍然是当前放疗学界研究的难点之一。转化生长因子-β(transforming growth factor beta,TGF-β)是一个具有多种功能的多肽类生长因子超家族,在组织纤维化的发生和发展过程中起着关键的调节作用[1],多项研究表明TGF-β信号通路的激活是放射性肺损伤发生的重要机制,阻断TGF-β的信号通路可抑制放射性肺损伤的发生[2-5],但目前的研究多是通过TGF-β中和抗体或TGF-β受体拮抗剂来阻断这一通路,临床可操作性差。常山酮(halofuginone)是一种从植物常山中获得的喹唑酮类药物,20世纪90年代,人们发现常山酮可以特异性地抑制成纤维细胞合成I型胶原纤维,是一种新型的I型胶原合成抑制剂[6]。之后多项实验表明常山酮可以阻断TGF-β信号通路从而具有抗纤维化作用[7],然而目前尚无常山酮防治放射性肺损伤研究的报道。
本研究拟建立小鼠放射性肺损伤模型,观察不同处理组小鼠放射性肺损伤情况,检测小鼠肺组织TGF-β表达情况,探讨常山酮在放射性肺损伤防治中的作用及可能机制,以期为研究常山酮防治放射性肺损伤提供实验依据。
1 材料与方法
1.1材料
1.1.1药物与试剂常山酮购自武汉驰飞化工有限公司,用PBS缓冲液稀释至125 μg/mL备用。小鼠TGF-β1单克隆抗体一抗浓缩液购自美国Abcam公司。免疫组织化学染色试剂及DAB显色剂购自北京中杉金桥生物技术有限公司。羟脯氨酸碱水解法试剂盒购自南京建成生物工程研究所。实时定量RTPCR试剂盒购自宝生物(大连)工程有限公司。
1.1.2实验动物C57BL/6J雌性小鼠72只,雌性,6周龄,体重20~30 g,购于北京维通利华实验动物技术有限公司,饲养于天津市肿瘤研究所动物实验室。
1.2方法
1.2.1实验分组及处理健康雌性C57BL/6J小鼠72只,随机分为对照组、胸部照射组(照射组)、常山酮组及照射联合常山酮组,每组18只。对照组不做处理;常山酮组予常山酮灌胃,每只小鼠25 μg/0.2 mL·d连续1个月或至处死;联合组灌胃同常山酮组,并于灌胃至15 d时予全肺6MV-X线单次照射12 Gy;照射组予全肺照射,照射时间及剂量同联合组。
1.2.2观察指标胸部照射后24 h、1周、2周、4周、12周、20周各组分别随机处死3只小鼠(对照组也同时处死3只小鼠),留取新鲜肺组织,左肺浸于10%福尔马林溶液中固定,制作石蜡切片行H&E染色观察肺组织形态、免疫组织化学法检测TGF-β1水平;右肺液氮速冻后,装入标好的冻存管,-80℃冰箱保存,行羟脯氨酸碱水解法测定肺组织中羟脯氨酸的含量,并行实时定量RT-PCR法测定TGF-β1的相对表达水平。所应用的TGF-β1 cDNA引物序列上游:5'-CTGCTGACCCCCACTGATAC-3',下游:5'-GAAAG CCCTGTATTCCGTCTC-3',内参GAPDH cDNA引物序列上游:5'-CGGGAAACTGTGGCGTGAT-3',下游:5'-AGTGGGTGTCGCTGTTGAAGT-3'。
1.2.3免疫组织化学结果判定光学显微镜下观察各组切片的免疫组织化学染色结果并拍摄数码影像。根据文献[8]采用AB值定量记分法:A表示显色深浅:0为无显色,1为浅黄色,2为棕黄色,3为粽褐色;B为每个视野染色细胞比例:1为阳性细胞≤10%,2为11%~50%,3为51%~75%,4为>75%。每张切片观察5个高倍视野,计算AB值平均值作为该切片的最后评分。
1.3统计学处理
应用SPSS 16.0软件进行统计分析。小鼠各组间差异比较采用方差分析,方差齐时采用LSD-t检验,方差不齐时采用Dunnett's T3检验。P<0.05为差异有统计学意义。
2 结果
2.1各组小鼠肺组织H&E染色结果
对照组及常山酮组小鼠肺组织各个时间点肺泡结构清晰,肺泡壁薄,肺泡间隔无增宽及充血,无炎性细胞浸润及出血现象。单纯胸部照射组小鼠照射后24 h肺泡水肿、出血,部分肺泡腔充满粉染均质水肿液,肺泡内大量游离的中性粒细胞和巨噬细胞;照射后1周仍可见明显肺泡出血与水肿,肺泡塌陷,可见到成纤维细胞;照射后2周肺泡炎症表现较前有所减轻,成纤维细胞增生,肺泡间隔略增宽,偶见斑片状的纤维化改变;照射后4周肺泡腔缩小,部分肺泡腔内可见红细胞及透明膜形成,肺泡间隔明显增宽,可见大量成纤维细胞;照射后12周肺泡腔明显缩小,
可见胶原纤维沉积及大量的成纤维细胞增生,肺纤维化明显形成;照射后20周肺泡结构明显破坏,可见肺实变;放疗联合常山酮组小鼠各时间点肺泡炎症及肺纤维化均较单纯胸部照射组明显减轻(图1)。
2.2各组小鼠肺组织羟脯氨酸含量测定结果
对照组及常山酮组肺组织羟脯氨酸含量随时间变化不明显,且在各时间点无显著性差异(均P>0.3);胸部照射组及联合组羟脯氨酸含量均随时间延长升高,照射后24 h、1周、2周、4周、12周、20周照射组肺组织羟脯氨酸含量明显高于对照组(P值分别为0.018、0.005、0.002、<0.001、<0.001、0.016);联合组羟脯氨酸含量在照射后24 h、1周、2周、4周、12周有低于胸部照射组的趋势(P值分别为0.248、0.343、0.408、0.365、0.076),在照射后20周显著低于胸部照射组(P=0.037,表1及图2)。
2.3各组小鼠肺组织TGF-β1免疫组织化学测定
对照组及常山酮组肺组织TGF-β1呈弱阳性表达,主要分布于肺上皮细胞、肺泡巨噬细胞、血管内皮细胞和肺成纤维细胞中,各时间点两组之间比较无显著性差异(均P>0.5)。单纯胸部照射组和联合组肺组织均可见大量黄色染色区域,照射后24 h至20周各时间点胸部照射组肺组织TGF-β1表达水平均明显高于对照组(均P<0.001),而联合组肺组织TGF-β1的表达水平于照射后2周、4周、12周、20周显著低于照射组(P值分别为0.001、<0.001、0.001、0.007),照射后24 h、1周有低于照射组趋势(P值分别为0.093、0.129)(表2及图3)。
2.4各组小鼠肺组织TGF-β1 mRNA转录水平RTPCR检测
对照组与常山酮组肺组织中TGF-β1mRNA各个时间点表达水平无明显差异(均P>0.7);照射后24 h至20周各时间点胸部照射组肺组织TGF-β1mRNA水平均明显高于对照组(P值分别为0.04、0.20、0.141、0.021、0.016、0.055)。照射后4周、12周常山酮联合胸部照射组肺组织TGF-β1的相对表达水平明显低于胸部照射组(P值分别为0.048、0.02),照射后24 h、1周、2周、20周有低于胸部照射组的趋势(P= 0.667、0.383、0.21、0.234)(表3及图4)。

▶图2各组小鼠不同时间点肺组织羟脯氨酸含量变化Figure 2Comparison of levels of hydroxyproline in each group at different time points
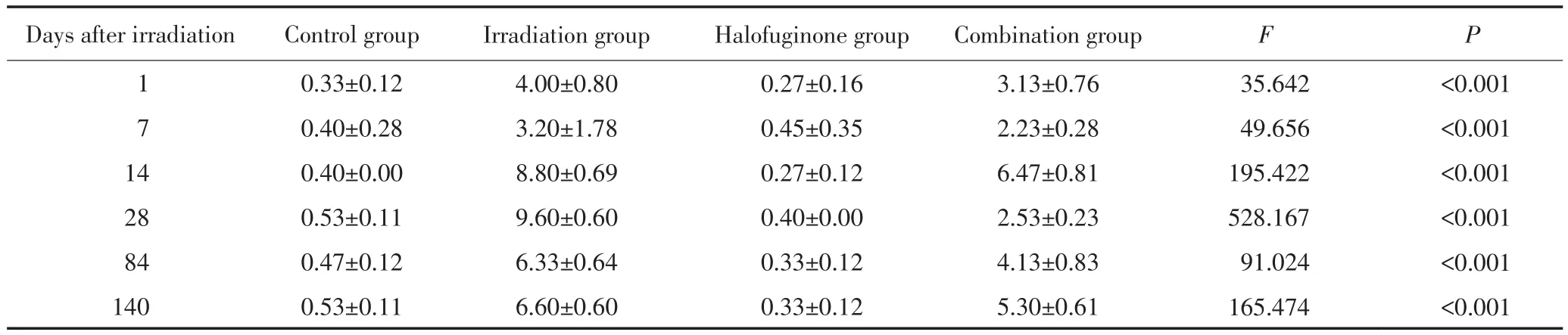
表2 各组小鼠不同时间点肺组织TGF-β1蛋白表达水平免疫组织化学评分Table 2Comparison of TGF-β1 expression scores in each group at different time points

图3 各组小鼠不同时间点肺组织TGF-β1蛋白表达情况(S-P×400)Figure 3TGF-β1 expression in lung tissue(S-P×400)

表3 各组小鼠不同时间点肺组织TGF-β1 mRNA相对表达水平Table 3Comparison of TGF-β1 mRNA levels in each group at various time points
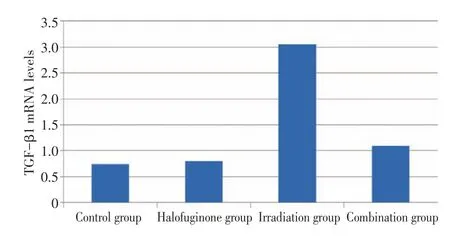
图4 照射后12周各组小鼠肺组织TGF-β1 mRNA水平Figure 4Comparison of TGF-β1 mRNA levels of each group at 12 weeks after irradiation
3 讨论
放射性肺损伤是胸部肿瘤放射治疗的常见并发症,据报道30%接受肺癌根治性放疗的患者会发生放射性肺炎[9]。放射性肺炎的发生不仅限制了肿瘤根治放疗剂量的提高,降低疗效,也影响了患者的生存质量,甚至可导致治疗相关性死亡,因此对于放射性肺损伤的发病机制及防治方法的研究探讨具有重要的临床意义。常山酮可特异性地抑制成纤维细胞合成I型胶原纤维,抑制纤维化的形成。多项研究表明常山酮对肝脏、胰腺纤维化、系统性硬化症、胶原病、术后瘢痕形成等也都有明显防治效果[9-11]。同时常山酮可以减轻放射线引起的纤维化,如Dabak等[12]的研究发现联合应用常山酮后可显著减轻放疗引起的小鼠食管和下咽的纤维化,Xavier等[7]的研究则证实常山酮可明显抑制放射引起的小鼠下肢的纤维化,且该作用主要是通过抑制TGF-β通路实现的。而早在1996年,Nagler等[13]通过动物实验证实常山酮可明显降低博来霉素引起的肺纤维化。对于放射线引起的肺纤维化,常山酮是否有防治作用?目前鲜有报道。
放射性肺损伤的过程大体可分为三个阶段:潜在期、急性肺炎期、慢性肺纤维化期。潜在期常发生在放疗后数小时至数天内,患者无任何临床表现,电镜下可看到Ⅰ型、Ⅱ型肺泡上皮细胞及表皮细胞的损伤,主要表现为线粒体、内质网的膨胀及浆膜的破裂;急性肺炎期大约发生在放疗后2周至数月内,此期以肺泡损伤为主,表现为间质水肿、渗出、炎性细胞浸润、肺泡腔的改变、肺泡间隔增宽;晚期则以肺泡间隔进行性的纤维化为特点最终将导致广泛的肺泡闭塞甚至肺组织实变,往往为不可逆的改变[14]。本研究建立小鼠放射性损伤模型,通过组织病理学H&E染色方法观察到放疗后各时间点小鼠放射性肺损伤的典型演变过程,并证实常山酮可以在一定程度减轻放疗后小鼠肺组织急性炎症反应及慢性纤维化改变。羟脯氨酸是胶原蛋白所特有的氨基酸,其含量可以反映总体胶原纤维的水平,因此测定羟脯氨酸含量可以用来评价纤维化的程度。本研究中,放疗后24 h、1周、2周、4周、12周,尤其是放疗后12周,联合组小鼠肺组织羟脯氨酸含量有小于胸部照射组趋势;放疗后20周联合组羟脯氨酸含量与胸部照射组相比明显降低。这一结果提示常山酮可以抑制放疗引起的肺组织纤维化的形成。然而,常山酮并没有明显降低放疗后24 h、1周、2周、4周肺组织羟脯氨酸含量,分析原因可能与实验动物数量过少有关,也可能是因为放射性肺纤维化是放疗后中晚期的慢性过程,早期难以观察到明显的差别。
TGF-β是一个具有多种功能的多肽类生长因子超家族,在组织纤维化的发生和发展过程中起着关键的调节作用,近年来研究发现TGF-β与放射肺损性伤的发生也密切相关。国内外许多学者研究发现放疗前后血浆中TGF-β1水平的变化可以预测放射性肺损伤[15],来自中国医学科学院肿瘤医院的一项数据表明TGF-β的基因多态性与放射性肺炎也有一定的相关性[16]。而基础实验中发现TGF-β信号通路的激活是放射性肺纤维化发生的关键过程,小鼠肺组织受到照射后发生肺纤维化的同时伴有TGF-β1水平升高,应用抗TGF-β1抗体或TGF-β受体的拮抗剂阻断TGF-β1的信号传导可以明显减轻放射性肺损伤的发生[2-3,5,17]。Rube等[4]的研究显示小鼠肺组织中TGF-β1水平在照射后最初几个小时内即释放(照射后1、3、6 h),12 h后显著增加,照射后2周和4周达高峰,照射后8周、16周、24周逐渐下降,且TGF-β1主要表达于肺组织中炎性细胞的浸润区域及成纤维细胞中。本研究中通过免疫组化法及RTPCR法检测照射后不同时间点肺组织中TGF-β1变化水平,均观察到照射后24 h TGF-β1即开始升高,且大致于照射后2周至4周达高峰,这与Rube等[4]的结果比较一致,同时本研究发现联合应用常山酮后,小鼠放射性肺损伤减轻的同时也伴随着TGF-β1水平的下降,免疫组织化学法示照射后2~20周各时间点联合组小鼠肺组织TGF-β1水平显著低于照射组,而RT-PCR结果示照射后4~12周各时间点联合组小鼠肺组织TGF-β1 mRNA水平显著低于照射组。这一结果提示常山酮抑制放射性肺损伤发生的机制可能和降低TGF-β的表达水平有关。然而本研究中TGF-β1蛋白及mRNA水平在各时间点并非完全一致,一方面可能是由于本研究采用的免疫组织化学评分及RT-RCR法均为半定量方法,可能会对实验结果造成一定的误差;另一方面,蛋白表达本身为多步
骤调控过程,真核生物基因表达的转录和翻译发生的时间和位点存在时空间隔[18],可能也是造成TGF-β1转录和翻译水平于各时间点不完全一致的原因。
本研究建立C57小鼠放射性肺损伤模型,通过对放疗后多个时间点观察发现常山酮在一定程度上抑制了放射性肺损伤的发生,且这一抑制作用可能和降低TGF-β1的表达水平有关;同时常山酮和TGF-β中和抗体或TGF-β受体拮抗剂相比成本低,临床可操作性较强,有望成为其防治放射性肺损伤的新型药物。然而由于本研究动物数量较少,且放射性纤维化的形成是多个通路相互影响的复杂的过程,尚需要大样本的实验进一步探索常山酮防治肺纤维化的作用并探讨其具体机制。
1Bowen T,Jenkins RH,Fraser DJ.MicroRNAs,transforming growth factor beta-1,and tissue fibrosis[J].J Pathol,2013,229(2):274-285.
2Flechsig P,Dadrich M,Bickelhaupt S,et al.LY2109761 attenuates radiation-induced pulmonary murine fibrosis via reversal of TGF-beta and BMP-associated proinflammatory and proangiogenic signals[J].Clin Cancer Res,2012,18(13):3616-3627.
3Ding NH,Li JJ,Sun LQ.Molecular mechanisms and treatment of radiation-induced lung fibrosis[J].Curr Drug Targets,2013,14(11):1347-1356.
4Rube CE,Uthe D,Schmid KW,et al.Dose-dependent induction of transforming growth factor beta(TGF-beta)in the lung tissue of fibrosis-prone mice after thoracic irradiation[J].Int J Radiat Oncol Biol Phys,2000,47(4):1033-1042.
5Anscher MS,Thrasher B,Zgonjanin L,et al.Small molecular inhibitor of transforming growth factor-beta protects against development of radiation-induced lung injury[J].Int J Radiat Oncol Biol Phys,2008,71(3):829-837.
6Nagler A,Rivkind AI,Raphael J,et al.Halofuginone-an inhibitor of collagen type I synthesis-prevents postoperative formation of abdominal adhesions[J].Ann Surg,1998,227(4):575-582.
7Xavier S,Piek E,Fujii M,et al.Amelioration of radiation-induced fibrosis:inhibition of transforming growth factor-beta signaling by halofuginone[J].J Biol Chem,2004,279(15):15167-15176.
8Yang WT,Xu LZ.The standard of immunohistochemistry scoring[J].China Oncology,1996,6(4):229-231.[杨文涛,许良中.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996(04):229-231].
9Halevy O,Genin O,Barzilai-Tutsch H,et al.Inhibition of muscle fibrosis and improvement of muscle histopathology in dysferlin knock-out mice treated with halofuginone[J].Histol Histopathol,2013,28(2):211-226.
10 Karadeniz CK,Karakoyun B,Yuksel M,et al.The antifibrotic drug halofuginone reduces ischemia/reperfusion-induced oxidative renal damage in rats[J].J Pediatr Urol,2013,9(2):174-183.
11 Beco L,Heimann M,Olivry T.Is feline acquired reactive perforating collagenosis a wound healing defect?Treatment with topical betamethasone and halofuginone appears beneficial[J].Vet Dermatol,2010,21(4):434-436.
12 Dabak H,Karlidag T,Akpolat N,et al.The effects of methylprednisolone and halofuginone on preventing esophageal and hypopharyngeal fibrosis in delivered radiotherapy[J].Eur Arch Otorhinolaryngol,2010,267(9):1429-1435.
13 Nagler A,Firman N,Feferman R,et al.Reduction in pulmonary fibrosis in vivo by halofuginone[J].Am J Respir Crit Care Med,1996,154(4 Pt 1):1082-1086.
14 Trott KR,Herrmann T,Kasper M.Target cells in radiation pneumopathy[J].Int J Radiat Oncol Biol Phys,2004,58(2):463-469.
15 Zhao L,Wang L,Ji W,et al.Elevation of plasma TGF-beta1 during radiation therapy predicts radiation-induced lung toxicity in patients with non-small-cell lung cancer:a combined analysis from Beijing and Michigan[J].Int J Radiat Oncol Biol Phys,2009,74(5):1385-1390.
16 Niu X,Li H,Chen Z,et al.A study of ethnic differences in TGFbeta1 gene polymorphisms and effects on the risk of radiation pneumonitis in non-small-cell lung cancer[J].J Thorac Oncol,2012,7(11):1668-1675.
17 Hakenjos L,Bamberg M,Rodemann HP.TGF-beta1-mediated alterations of rat lung fibroblast differentiation resulting in the radiation-induced fibrotic phenotype[J].Int J Radiat Biol,2000,76(4):503-509.
18 De Sousa AR,Penalva LO,Marcotte EM,et al.Global signatures of protein and mRNA expression levels[J].Mol Biosyst,2009,5(12):1512-1526.
(2014-11-22收稿)
(2015-01-15修回)
(编辑:杨红欣)
Study of halofuginone in ameliorating radiation injury of lung
Peng WANG,Linlin GONG,Shuai WANG,Ningbo LIU,Qingsong PANG,Lujun ZHAO,Ping WANG
Lujun ZHAO;E-mail:tjdoctorzhao@126.com
Objective:To investigate the inhibitory effects of halofuginone on radiation-induced pulmonary injury and to explore the therapeutic mechanism of this drug.Methods:A total of 72 healthy female C57BL/6 mice were randomized into 4 groups,namely, control,irradiation,halofuginone,and irradiation plus halofuginone groups,with 18 mice in each group.No treatment was performed in the control group.In the halofuginone group,the halofuginone lavage was conducted once a day,with a continuous course treatment for a month or until sacrifice of the mice.In the therapeutic alliance group,the treatment mode was the same as that in the halofuginone group.Then,a 6MV-X ray single fraction irradiation was performed after the completion of a 15-day intragastric administration.At 24 h,1 week,2 weeks,4 weeks,12 weeks,and 20 weeks after the irradiation,3 mice from each group were randomly sacrificed,and total lung tissues were harvested.The lung was dissected to prepare pathological sections.The sections were stained with hematoxylin and eosin staining(H&E)to explore morphologic changes.The protein and mRNA expression levels of TGF-β1 were analyzed by a combination of immunohistochemistry and polymerase chain reaction.The level of hydroxyproline was also measured.Results:The outcomes of H&E staining showed that halofuginone markedly ameliorated the acute pulmonary inflammation and fibrosis induced by irradiation.The combination group had a lower level of hydroxyproline than the irradiation group,with statistically significant differences at 20 weeks after irradiation(P=0.037).The protein and mRNA expression levels of TGF-β1 were higher in the irradiation and combination groups than in the control group and(or)halofuginone group at different time points(P<0.05).The combination group had lower TGF-β1 protein expression than the irradiation group at different time points,with statistically significant differences at 2,4,12,and 20 weeks after the irradiation(P<0.05).Meanwhile,TGF-β1 mRNA level was lower in the combination group than in the irradiation group only at 4 and 12 weeks after the irradiation(P<0.05).Conclusion:Halofuginone can ameliorate the irradiation-induced lung inflamma-
halofuginone,transforming growth factor-β1,radiation injury of lung,hydroxyproline

10.3969/j.issn.1000-8179.20141969
天津医科大学肿瘤医院放疗科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060)
*本文课题受国家自然科学基金资助项目(编号:30970864),天津市抗癌重大专项攻关计划项目(编号:12ZCDZSY15900)资助
赵路军tjdoctorzhao@126.com
Department of Radiation Therapy,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China
This work was supported by the National Natural Science Foundation of China(No.30970864)and Tianjin Municipal Project of Tackling Key Problem for Cancer Therapy(No.12ZCDZSY15900)
tion and fibrosis probably by inhibiting the radiation-induced TGF-β1 expression.Therefore,halofugione is expected to be a therapeutic drug for preventing irradiation injury of the lung.
王鹏专业方向为胸部肿瘤的放射治疗与生物转化医学相关研究。
E-mail:wangpeng_orange@163.com
