低档绿茶多糖的酶法辅助提取及抗氧化活性研究
2015-10-28何晓梅许星云乔德亮
何晓梅,张 颖,许星云,史 珊,乔德亮
(1.皖西学院生物与制药工程学院,安徽六安237012;2.植物细胞工程安徽省工程技术研究中心,安徽六安237012)
低档绿茶多糖的酶法辅助提取及抗氧化活性研究
何晓梅1,2,张颖1,许星云1,史珊1,乔德亮1
(1.皖西学院生物与制药工程学院,安徽六安237012;2.植物细胞工程安徽省工程技术研究中心,安徽六安237012)
以皖西低档绿茶为原料,通过酶法辅助浸提茶多糖,然后对浸提液进行醇沉、真空干燥得粗多糖,比较三种不同方法对粗多糖脱蛋白效果,并研究茶多糖的体外抗氧化活性。结果表明:酶法辅助浸提的最优条件:料液比1∶30(g/mL)、酶解温度45℃、酶解时间120min、纤维素酶添加量12mg/g,果胶酶添加量12mg/g、浸提1次,茶多糖得率达到5.414%。三氯乙酸法、sevage法、木瓜蛋白酶法对粗多糖中蛋白的最大脱除率分别为84.14%、69.45%、74.34%,多糖损失率分别为18.56%、24.01%、12.34%。相对而言,木瓜蛋白酶法条件温和,更适合茶多糖脱蛋白。另外,茶多糖具有较强的还原能力以及对羟基自由基的清除能力,对亚硝基具有一定的清除作用。
茶多糖,纤维素酶,果胶酶,脱蛋白,抗氧化活性
皖西地区茶叶资源丰富,霍山、金寨、舒城、六安等地都是产茶大县,茶叶是农村经济的主导产业之一。其中名优茶产量只占茶叶总产量20%左右,占总产值的80%以上。夏秋茶和粗老茶滞销,茶农的收入受到极大的影响。茶叶中的主要生理活性物质有茶多酚、茶多糖、茶氨酸、咖啡碱等,茶多糖是茶叶中继茶多酚开发之后的又一热点课题。茶多糖是一种酸性糖蛋白,并结合有大量的矿质元素,为水溶性复合物,易溶于热水,不溶于高浓度的有机溶剂。目前,其功效的研究集中在降血糖[1-2]、降血脂[3]、抗氧化[4]、增强免疫力、治疗心血管疾病等方面,近些年来发现茶多糖还具有治疗糖尿病的功效[5]。研究表明,茶多糖在粗老茶中含量比嫩茶中含量高[6-7]。目前对皖西粗老低档绿茶多糖的相关研究未见报道,若能从中提取茶多糖并进行相关研究,发掘其中的价值,对于皖西粗老茶叶的综合利用具有极大的意义。
本实验以皖西粗老低档绿茶为原料,通过酶法辅助浸提茶多糖并进行纯化,初步研究茶多糖的体外抗氧化活性,为皖西粗老绿茶的深度开发提供理论依据。
1 材料与方法
1.1材料与仪器
低档绿茶市售;酶制剂:纤维素酶(≥30U/mg)、果胶酶(30U/mg)、木瓜蛋白酶(20U/mg)Ruibio分装;葡萄糖标准品(≥98%) 贵州迪大科技有限责任公司;亚硝酸钠标准品北京莱耀生物科技有限公司;牛血清白蛋白上海生工生物工程有限公司;考马斯亮蓝G250、重蒸酚、石油醚、无水乙醇、三氯乙酸、氯仿、正丁醇、浓硫酸、铁氰化钾、三氯化铁、对氨基苯磺酸、盐酸萘乙二胺、水杨酸、过氧化氢、邻苯三酚等试剂均为分析纯;水蒸馏水。
FA1004B电子分析天平新芝生物科技有限公司;HH-S4数显控温水浴锅金坛市华龙实验仪器厂;DHG-9420B上海琅珄智能型电热恒温鼓风干燥箱上海嘉措仪器设备有限公司;TU-1901双光束紫外可见分光光度计北京普析通用仪器有限责任公司;SY-2000型旋转蒸发器、SHZ-D(Ⅲ)型循环水真空泵上海亚荣生化仪器厂;GL-21M高速冷冻离心机湖南长沙湘仪离心机仪器有限公司;VD23真空干燥箱上海摩亿科贸有限公司。
1.2实验方法
1.2.1茶叶的预处理将新鲜的低档茶叶除梗,粉碎,过筛得30~60目的粉末,用石油醚索氏提取2h,40℃烘干;再用70%乙醇于70℃浸提2h,抽滤,40℃烘干,保存进行后续实验。
1.2.2茶叶粗多糖的提取准确称取一定质量的预处理茶叶粉末,按照一定的水茶比加入蒸馏水和一定质量分数的酶,于一定温度下水浴提取一定时间后,升温灭酶活10min,抽滤,离心得滤液,取出部分滤液测定浸提液中茶多糖含量,剩余滤液减压浓缩为原体积的1/4,然后向浓缩液中加入95%的乙醇至乙醇终浓度为80%[8],4℃过夜,离心,收集沉淀,真空干燥得粗多糖。
1.2.2.1单因素实验纤维素酶添加量的确定:分别准确称取5.000g经预处理的茶叶粉末21份,按0、2、4、6、8、10、12、14mg/g的量加入纤维素酶(每个水平3个平行实验),在料液比1∶30、酶解温度50℃下酶解120min,升温灭酶活10min,抽滤,离心得滤液,进行后续实验。
果胶酶添加量的确定:在纤维素酶添加量确定的基础上取样,按0、2、4、6、8、10、12、14mg/g的量加入果胶酶酶解浸提,确定果胶酶加入量。
酶解时间的确定:在纤维素酶加入量和果胶酶加入量确定的基础上取样,分别酶解提取40、60、80、100、120、140min,以确定酶解时间。
酶解温度的确定:在纤维素酶加入量、果胶酶加入量和酶解时间确定的基础上取样,分别于35、40、45、50、55℃下酶解提取,以确定酶解温度。
1.2.2.2正交实验在1.2.2.1单因素实验的基础上,以纤维素酶添加量(A)、果胶酶添加量(B)、酶解时间(C)和酶解温度(D)为考察对象,以茶多糖得率为考察指标,设计L9(34)正交实验(见表1),确定酶法辅助浸提茶多糖的最佳工艺条件。
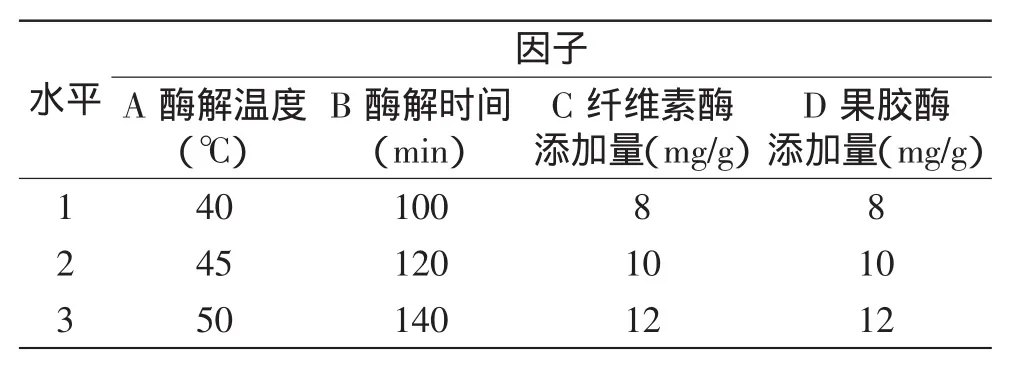
表1 正交实验水平表Table 1 Orthogonal experiment level table
1.2.3茶叶粗多糖脱蛋白
1.2.3.1三氯乙酸法脱蛋白精确量取7份茶多糖溶液10mL,分别加入三氯乙酸晶体0.01、0.02、0.03、0.04、0.05、0.06、0.07g,快速混匀,4℃静置过夜,然后按照5000r/min离心10min,丢弃沉淀,收集上清液,再次将其定容至10mL的容量瓶中,测定多糖的含量及蛋白质含量。
1.2.3.2sevag法脱蛋白[9]将粗多糖研磨,用适量蒸馏水溶解,精确量取茶多糖样品液30mL,sevage试剂(三氯甲烷∶正丁醇=4∶1)6mL,剧烈振摇30min,再在5000r/min的条件下离心10min,去除下层和沉淀部分,测定上清液中的多糖和蛋白质含量。上清液按上述方法继续进行第二次脱蛋白,测定多糖与蛋白质含量。如此重复上述步骤,脱蛋白进行第三次、第四次、第五次、第六次,分别测定其上清液中多糖与蛋白质含量。
1.2.3.3木瓜蛋白酶法脱蛋白[10]精确量取6份10mL多糖样品液于锥形瓶中,调节其pH至6.0,再分别向其中加入浓度为0.25%、0.50%、0.75%、1.00%、1.25%、1.50%的木瓜蛋白酶液10mL,将混合液于55℃的水浴锅中保温1.5h,然后于沸水浴中5min灭酶活,5000r/min离心10min,除去沉淀,得脱蛋白液,分别测定其中的多糖含量及蛋白质含量。
1.2.4精制茶多糖的体外活性研究将脱蛋白的多糖溶液透析,减压浓缩,加入95%乙醇醇沉过夜,离心,真空干燥得精制茶多糖。
1.2.4.1茶多糖还原力的测定根据文献[11],多糖还原力的测定采用普鲁士蓝法,量取1.0mL浓度为40、80、120、160、200μg/mL的多糖溶液于5支试管中,依次加入2.5mL pH6.6的磷酸盐缓冲液和2.5mL 1.0%的铁氰化钾溶液,混匀后置于50℃水浴20min,然后加入2.5mL 10%的三氯乙酸溶液,混匀,反应30min后,4000r/min离心10min。各移取2.5mL上清液于另一试管中,加入2.5mL蒸馏水及0.5mL 0.1%的三氯化铁溶液,混匀,静置10min后,测定OD700nm。以VC作阳性对照。
1.2.4.2茶多糖对亚硝基(NO2-)清除能力的测定根据文献[12-13],茶多糖对NO2-清除能力的测定采用盐酸萘乙二胺比色法。分别准确吸取1mL浓度为40、80、120、160、200μg/mL的多糖溶液于5支具塞试管中,加入2mL 10μg/mL的NaNO2标准溶液、2mL pH3.0的柠檬酸缓冲液,摇匀后于37℃水浴中保温1h。取出后加入2mL 4g/L对氨基苯磺酸,摇匀静置5min,再加入lmL 2g/L盐酸萘乙二胺,混匀静置15min,以VC作阳性对照,测定550nm处吸光度。
NO2-清除率(%)=[(A0-A)/A0]×100
式中:A0为空白对照吸光值;A为不同浓度反应液(茶多糖或VC)吸光值。
1.2.4.3羟基自由基(·OH)清除能力的测定根据文献[14],采用Fenton反应法测定茶多糖对·OH的清除能力。取编号的试管6支,依次分别加入1.0mL 6mmol/L FeSO4、2.0mL 6mmol/L水杨酸溶液和2.0mL浓度为0、0.2、0.4、0.6、0.8、1.0mg/mL的茶多糖溶液,最后加入2.0mL 6mmol/L H2O2室温下反应1h,测定510nm处吸光度,计算清除率。其中以蒸馏水为空白对照,以VC作阳性对照。
清除率(%)=(A0-A)/A0×100
式中:A0为空白对照液的吸光度;A为加入茶多糖或VC溶液后的吸光度。
1.2.5茶多糖及蛋白质含量的测定茶多糖含量测定采用苯酚-硫酸法。根据吸光度值(0.2~0.8)与浓度值(<100μg/mL)线性关系良好,以减小浓度的相对误差,提高测定的准确度,对文献[15]葡萄糖标准液浓度取值范围略有修改,其葡萄糖标准曲线方程为:y= 0.016x-0.018,R2=0.9995。
茶多糖得率(%)[15]=[(C样品×提取液总体积×换算因子)/(茶样质量×103)]×100
多糖损失率(%)=(脱蛋白前茶多糖含量-脱蛋白后茶多糖含量)/脱蛋白前茶多糖含量×100
蛋白质含量测定采用Bradford法,以牛血清蛋白做标准曲线。其标准曲线方程为:y=0.1646x-0.1739,R2=0.9992,蛋白质浓度在10~100μg/mL范围内线性关系良好。
蛋白脱除率(%)=(脱蛋白前蛋白质含量-脱蛋白后蛋白质含量)/脱蛋白前蛋白质含量×100
2 结果与分析
2.1酶法辅助浸提单因素实验
2.1.1单一酶添加量对茶多糖得率的影响纤维素酶催化纤维素分解,果胶酶分解果胶质,从而破坏茶叶细胞壁,使茶叶内的成分更容易溶解、扩散。由图1可知,在酶实验添加量范围内,多糖的得率随着酶添加量的增加而增加。纤维素酶添加量从6~10mg/g时茶多糖的得率增加比较明显,但增加幅度比较平缓。果胶酶添加量从4~10mg/g时茶多糖的得率增加比较明显。两者都是随着酶浓度的增加茶多糖得率趋于稳定。可能原因是酶量过高,底物浓度不能对酶达到饱和,致使酶的作用受到抑制[16]。另外,相比于果胶酶,纤维素酶的加入对茶多糖得率影响大些。
2.1.2单一酶酶解时间对茶多糖得率的影响由图2可知,茶多糖的得率随酶解时间的增加而增加。酶解时间在40~60min时,茶多糖得率低且增加不明显,可能原因是茶叶粉末仍处于溶胀阶段;在60~120min时茶多糖得率增加明显;酶解时间达到120min后茶多糖得率增加不明显。长时间的浸提往往导致大量杂质溶出,另外耗费能源也越多,故采用酶解时间120min。
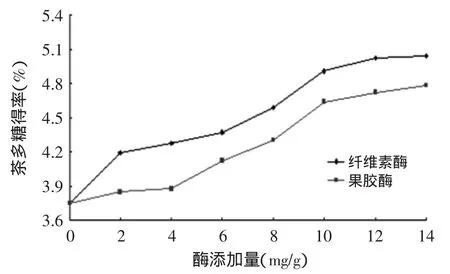
图1 酶添加量对茶多糖得率的影响Fig.1 Effect of enzymolysis concentration on extraction of tea polysaccharide

图2 酶解时间对茶多糖得率的影响Fig.2 Effect of enzymolysis time on extraction of tea polysaccharide
2.1.3单一酶酶解温度对茶多糖得率的影响由图3可知,在35~55℃范围内,对于纤维素酶和果胶酶,随酶解温度的升高,茶多糖得率呈现出先增加后下降的趋势,酶解温度为45℃时,茶多糖的得率达到最高,与文献[17]结果一致。这是由于开始随温度升高,酶反应速度加快,茶多糖得率增加,之后随温度进一步升高,引起酶蛋白变性,酶活力降低,茶多糖得率降低。

图3 酶解温度对茶多糖得率的影响Fig.3 Effect of enzymolysis temperature on extraction of tea polysaccharide
2.1.4正交实验优化茶多糖提取工艺按照表1的因素水平,进行四因素三水平正交实验L9(34),正交实验结果和极差分析见表2。由表2可知,各因素对绿茶粗多糖得率影响主次顺序为:A>C>B>D,即酶解温度对绿茶粗多糖得率影响最大,依次是纤维素酶添加量,酶解时间,果胶酶添加量影响最小。双酶作用下的得率比单酶作用下的得率有了明显的提高,茶多糖提取的最佳工艺组合为A2B2C3D3,即酶解温度45℃,酶解时间120min,纤维素酶添加量12mg/g,果胶酶添加量12mg/g。在此条件下进行茶多糖提取的验证实验,3组平行实验的结果分别是5.415%、5.420%、5.408%,平均得率为5.414%。
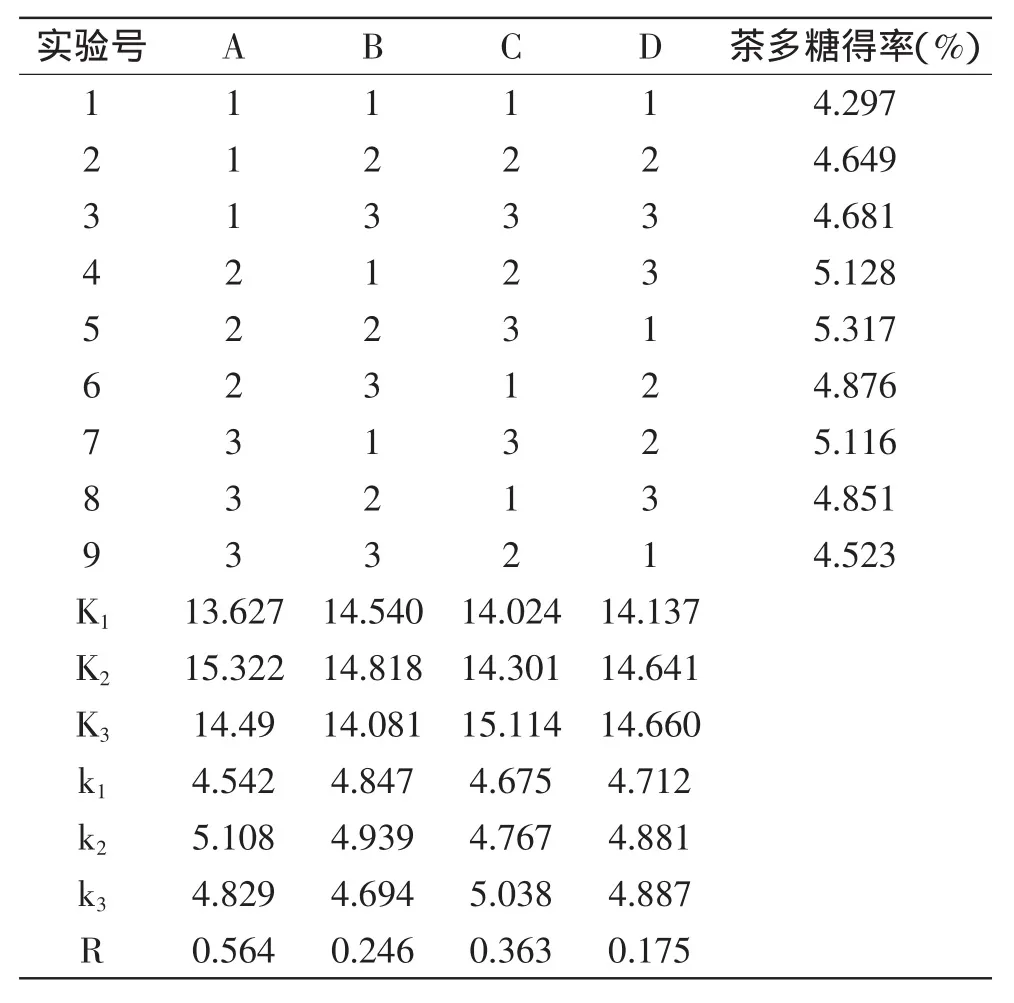
表2 正交实验设计及方差分析Table 2 Design and results of orthogonal experiment
2.2粗多糖不同脱蛋白方法比较
2.2.1三氯乙酸法脱蛋白效果由图4可知,三氯乙酸添加量小于3×10-3g/mL时,其蛋白脱除率上升速度极快,特别是在添加量为(2~3)×10-3g/mL之间。当三氯乙酸添加量为3‰时其对粗多糖蛋白脱除率达到78.02%,多糖损失率为9.45%。当大于3×10-3g/mL时,蛋白脱除率几乎处于平稳趋势,三氯乙酸添加量对蛋白的去除效果不明显;然而随着三氯乙酸添加量的增大,多糖损失率呈缓慢平稳上升趋势。三氯乙酸添加量达到7‰时,其对蛋白的脱除率为84.14%,其多糖损失率为18.56%。三氯乙酸与蛋白质形成不可逆沉淀,反应较为剧烈,浓度过高,多糖结构也有可能被破坏[18],继而影响其活性。

图4 TCA法脱蛋白效果Fig.4 Results of removal of protein from trichloroacetic acid method
2.2.2sevage法脱蛋白效果sevage法是根据蛋白质在三氯甲烷溶剂中变性的特点来脱除蛋白的。由图5可知,使用sevage法1次后其蛋白脱除率高达32.71%,多糖损失率为9.31%。第5次脱蛋白率达68.23%,多糖损失率达22.34%。其后,其脱蛋白效果不再呈现优势,逐渐趋于平稳态。第7次蛋白脱除率为69.45%,而多糖损失率高达24.01%。与三氯乙酸法比较,三氯甲烷有毒,且其脱蛋白效果不及三氯乙酸,多糖损失率相对较高。

图5 Sevage法脱蛋白效果Fig.5 Results of removal of protein from sevage
2.2.3木瓜蛋白酶法脱蛋白效果由图6可知,随着酶添加量的逐渐增加,蛋白质脱除率及茶多糖的损失率都在逐渐增大。当酶添加量小于5‰时,每增加一梯度,蛋白质脱除率变化都比较明显,尤其是(2.5~5.0)×10-3g/mL之间。在5.0×10-3g/mL酶添加量的情况下,其蛋白脱除率高达74.34%,多糖损失率为12.34%。当酶添加量大于5.0×10-3g/mL后,蛋白脱除率变化呈现平稳趋势。相比与三氯乙酸法和Sevag法,酶法脱蛋白率高,多糖损失率低,无污染。

图6 木瓜蛋白酶法脱蛋白效果Fig.6 Protein removal effect of papain method
2.3茶叶多糖的体外活性检测
比较3种不同方法脱蛋白效果,选取木瓜蛋白酶法脱蛋白液透析,浓缩,醇沉,离心,真空干燥(40℃)制得精制茶多糖。
2.3.1茶叶多糖还原力的测定普鲁士蓝法测定原理表明:吸光度与多糖还原能力成正比。根据1.2.4.1方法,茶多糖和VC还原力测定结果如表3。

表3 茶多糖和VC还原力的测定Table 3 Determination of reducing power of tea polysaccharide and VC
由表3可以看出,随着茶叶多糖浓度的增加,其还原力逐渐加强。茶叶多糖浓度在120~160μg/mL时,其还原力与50μg/mL的抗坏血酸还原力相当。
2.3.2茶叶多糖对亚硝基的清除作用人或动物摄取的食物中含有或多或少的亚硝酸盐,亚硝酸盐在酸性环境(人或动物的胃)中容易合成亚硝胺,亚硝胺是一类化学致癌物,清除亚硝酸盐是减少致癌的有效途径[19]。茶叶多糖对NO2-的清除作用见图7,在实验浓度范围内,随着茶多糖浓度的增加,其清除NO2-的能力逐渐增强,但比同浓度VC的清除作用弱。

图7 茶多糖和VC对NO2-的清除作用Fig.7 Scavenging effect of tea polysaccharides and VCon NO2-
2.3.3茶叶多糖对羟基自由基(·OH)的清除能力由图8可知,茶多糖对羟自由基具有较好的清除作用,浓度达到0.2mg/mL时,其清除率达到约75%,其后基本保持不变,而VC浓度达到0.6mg/mL时,其清除率达到约75%。虽然随着浓度的增加,茶多糖对·OH的清除率低于VC,但较其他天然提取物仍具有优势[20-21]。

图8 茶多糖和VC对·OH的清除作用Fig.8 Scavenging effect of tea polysaccharides and VCon·OH
3 结论
3.1以皖西粗老低档绿茶为原料,通过单因素和正交实验,确定酶辅助浸提茶多糖的最佳工艺条件为:酶解温度45℃,酶解时间120min,纤维素酶添加量12mg/g,果胶酶添加量12mg/g,茶水比1∶30(g/mL),浸提1次,茶多糖得率达到5.414%。
3.2比较三氯乙酸法、sevage法、木瓜蛋白酶法对粗多糖脱蛋白效果:木瓜蛋白酶法更适合茶多糖脱蛋白,条件温和,蛋白脱除率高,且多糖损失率低。
3.3茶多糖体外抗氧化活性表明:其具有较强的还原能力以及对羟基自由基的清除能力,对亚硝基具有一定的清除作用。
[1]陈建国.茶多糖的提取及其药理作用研究概况[J].中草药,2000,31(7):6-7.
[2]陈萍,朱丽云,金晖.茶多糖的分离制备及其对ALX模型小鼠的降糖作用研究[J].食品科技,2013,38(5):194-196.
[3]韦璐,秦小明,林华娟,等.金花茶多糖的降血脂功能研究[J].食品科技,2008(7):247-249.
[4]聂少平,谢明勇,罗珍.茶叶多糖的抗氧化活性研究[J].天然产物研究与开发,2005,17(5):549-552.
[5]潘见,陈彦,方伟,等.具有抗氧化活性茶多糖TPS-Ⅱ的分离纯化及其性质研究[J].食品科学,2009,30(3):25-28.
[6]陈建国,胡欣,梅松.茶叶中茶多糖的提取和测定方法[J].中国卫生检验杂志,2004,14(4):432-433.
[7]汪东风,谢晓凤,王泽农,等.粗老茶中的多糖含量及其保健作用[J].茶叶科学,1994,14(1):73-74.
[8]陈义勇,窦祥龙,黄友如,等.响应面法优化超声-微波协同辅助提取茶多糖工艺[J].食品科学,2012,33(4):100-103.
[9]王传名,董祺,管从胜.日照绿茶粗多糖脱蛋白工艺研究[J].食品工业科技,2010,31(8):274-276.
[10]梁军,夏永刚,杨炳有.麻黄多糖中蛋白含量测定及脱蛋白方法的比较[J].中医药学报,2011,39(2):73-75.
[11]陈欣,龚兰,刘冠卉.食用真菌多糖提取条件的优化及其还原力的比较[J].食品科学,2010,31(14):140-144.
[12]李莉梅,李恒,朱苗,等.野生仙人掌多糖对DPPH·、NO2-的清除能力及其还原力研究[J].广东农业科学,2013(15):121-123.
[13]陈莉华,龙进国,谭林艳,等.红果参多糖的提取纯化及抗氧化活性研究[J].天然产物研究与开发,2013(25):170-173.
[14]周向军,高义霞,袁毅君.乌龙茶多糖提取工艺及抗氧化作用研究[J].中国酿造,2011(8):80-84.
[15]何晓梅,沈涛涛,陈壮壮,等.响应面法优化皖西粗老绿茶茶多糖提取工艺[J].皖西学院学报,2014,30(2):76-79.
[16]程雅芳,杨洋,温富雄.响应面分析法优化酶提取甜茶茶多酚工艺[J].食品科学,2012,33(10):10-15.
[17]杨蓉生,陈炼红,唐俊妮,等.复合酶法提取红雪茶粗多糖工艺优化研究[J].食品工业科技,2012,33(12):285-288.
[18]朱美静,童群义.猴头多糖脱蛋白方法的研究[J].河南工业大学学报:自然科学版,2005,26(4):25-27.
[19]李佳颖,韩照祥,顾宏新.洋葱提取液对亚硝酸盐清除作用的研究[J].化学工程与装备,2012(4):25-27.
[20]李朝阳,刘魁,韩忠宵,等.大蒜多糖的酶法提取及其抗氧化性研究[J].食品科学,2008,29(1):117-120.
[21]徐胜龙,杨建雄.柿子醇提取物的体外抗氧化研究[J].食品科学,2008,29(4):131-134.
Enzymatic-assisted extraction process and antioxidant activities of tea polysaccharide from low quality green tea
HE Xiao-mei1,2,ZHANG Ying1,XU Xing-yun1,SHI Shan1,QIAO De-liang1
(1.College of Biology and Pharmaceutical Engineering,West Anhui University,Liu’an 237012,China;2.Engineering Technology Research Center of Plant Cell Engineering,Liu’an 237012,China)
Low quality green tea as material and enzymatic extraction as assisted method for extraction,the research extracted alcohol precipitation,vacuum dried crude tea polysaccharides,and compared the three methods of removing protein from crude tea polysaccharides,as well as studied vitro antioxidant activities of the tea polysaccharides.The result showed that optimal conditions of enzymatic assisted extraction:ratio for water and material was 1∶30(g/mL),enzymatic temperature 45℃,enzymatic time 120min,cellulose enzyme loadings 12mg/g,pectinase loadings 12mg/g,and extraction time once.Tea polysaccharides extraction ratio could be 5.414%.Maximum removal rate for crude polysaccharides deproteinization through trichloroacetic acid method,sevage method,and papain method was 84.14%,69.45%,and 74.34%respectively.Polysaccharides loss rate was 18.56%,24.01%,and 12.34%respectively.Comparatively papain method was with a mild condition and best fits for tea polysaccharides deproteinization.In addition,tea polysaccharides had better reducing capacity and free radical scavenging ability of·OH,as well as certain reducing ability to NO2-.
tea polysaccharides;cellulose enzyme;pectinase;deproteinization;vitro antioxidant activities
TS272
A
1002-0306(2015)10-0153-06
10.13386/j.issn1002-0306.2015.10.023
2014-06-06
何晓梅(1974-),女,硕士研究生,讲师,研究方向:天然产物研究与开发。
安徽省自然科学基金项目(KJ2013B341);省级大学生创新创业项目(AH201310376027);国家自然科学基金项目(31271853);六安市定向委托项目(2012LWA011);皖西学院党建创新活动项目(WXXYDJ12003);皖西学院“生物质炼制”科技创新平台项目(004013010)。
