RP-HPLC法测定酪蛋白水解物中ACE抑制肽的含量
2015-10-28胡志和孙振刚武文起冯永强
赵 勇,胡志和,*,孙振刚,武文起,冯永强,薛 璐
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津300134;2.天津海河乳业有限公司,天津300402)
RP-HPLC法测定酪蛋白水解物中ACE抑制肽的含量
赵勇1,胡志和1,*,孙振刚2,武文起2,冯永强2,薛璐1
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津300134;2.天津海河乳业有限公司,天津300402)
目的:为了建立定量检测酪蛋白水解物中的血管紧张素转换酶(ACE)抑制肽的反相高效液相色谱(RP-HPLC)方法。方法:酪蛋白先经过胃蛋白酶水解、再经过胰蛋白酶水解,用风味蛋白酶和离子交换树脂对水解物先后进行脱苦和脱盐处理。建立标准品十肽酪氨酸-谷氨酰胺-赖氨酸-苯丙氨酸-脯氨酸-谷氨酰胺-酪氨酸-亮氨酸-谷氨酰胺-酪氨酸(YQKFPQYLQY)的RP-HPLC检测方法,运用外标法测定酪蛋白水解物中的ACE抑制肽YQKFPQYLQY的含量。结果:标准品十肽YQKFPQYLQY质量浓度在2.5~4.5mg/mL(R2=0.95496)范围内与峰面积呈良好的线性关系。酪蛋白水解物中所含十肽质量分数为4.96694%±0.00131%。结论:本液相检测方法操作简便、快速,适用于ACE抑制肽YQKFPQYLQY的定量检测分析。
酪蛋白,水解物,血管紧张素转换酶抑制肽,定量检测,反相高效液相色谱法(RP-HPLC)
高血压与冠心病等心脑血管疾病有十分紧密的相关性[1],全世界的高血压平均发病率呈逐年上升的趋势,高血压对人类的生命健康构成了巨大威胁[2]。目前治疗高血压一般使用合成药物,药物治疗高血压虽然有一定疗效,但可能引起肾脏损伤等毒副作用[3-4]。此外,长期服用药物会产生药物依赖或抗药性。Maruyama等[5]从酪蛋白水解物中提取出具有抑制血管紧张素转换酶(ACE)活性的十二肽苯丙氨酸-苯丙氨酸-缬氨酸-丙氨酸-脯氨酸-苯丙氨酸-脯氨酸-谷氨酸-缬氨酸-苯丙氨酸-甘氨酸-赖氨酸(FFVAPFPEVFGK)。Nakamura等[6-7]从酸奶中分离出两个三肽缬氨酸-脯氨酸-脯氨酸(VPP)和异亮氨酸-脯氨酸-脯氨酸(IPP),体外和体内检测证明具有ACE活性抑制作用。人们陆续发现食物蛋白质经过水解后所得到的小肽具有很好的降压效果,并且无毒副作用,因此,食物源ACE抑制肽逐渐成为国内外研究的热点话题[8]。
目前,ACE活性抑制肽主要采用体内和体外两种方法进行检测[9]。体内检测即用原发性高血压大鼠(SHR)进行灌胃,测定灌胃前后的大鼠尾动脉收缩压,来判断ACE活性抑制肽的作用效果[10]。体外检测最常用的方法是Cushman和Cheung[11]提出并建立的紫外分光光度法,ACE可以催化马尿酰-组氨酰-亮氨酸(HHL)分解产生马尿酸(Hip)和二肽组氨酸-亮氨酸(HL),ACE抑制肽通过抑制ACE活性致使Hip生成量减少,在228nm测定Hip的紫外吸收值,并计算得到ACE抑制肽的抑制率和IC50(ACE活性抑制率达到50%时,所需抑制剂的浓度值,IC50用以表示ACE活性抑制肽的作用效果[12]。但是这两种检测ACE活性抑制肽的方法不能够快速、定量确定样品中ACE活性抑制肽的含量。廖晓慧等[13]通过建立RP-HPLC法对重组大肠杆菌发酵液中的降压肽进行定量测定,得到了快速、稳定的检测方法。Yamada等[14]采用RP-HPLC法对牛乳酪蛋白水解物中的ACE活性抑制肽甲硫氨酸-赖氨酸-脯氨酸(MKP)进行含量测定。此外,醋酸艾塞那肽[15]、胸腺五肽[16]、蚂蟥多肽[17]和β-酪啡肽[18]等肽类都可以通过高效液相色谱法进行灵敏、精准的定量检测。
本实验室在前期工作中,先用胃蛋白酶,再用胰蛋白酶水解牛乳酪蛋白,获得两个具有ACE活性抑制作用的酪蛋白片段(十肽YQKFPQYLQY和二肽酪氨酸-丝氨酸(YS))[19]。本研究采用RP-HPLC法对酪蛋白双酶水解物中所含的ACE抑制肽(十肽:YQKFPQYLQY)进行定量测定,为水解酪蛋白制备ACE抑制肽提供快速的检测和监测方法。
1 材料与方法
1.1材料与仪器
酪蛋白(酪蛋白含量≥80%) 新西兰TATUA公司;胃蛋白酶(10000U/g)、胰蛋白酶(10000U/g)、NHippuryl-His-Leuhydrate(HHL)、Angiotensin Converting Enzyme from rabbit lung(ACE,来源于兔肺)美国Sigma公司;风味蛋白酶(15000U/g)丹麦Novo公司;001×7强酸性苯乙烯系阳离子交换树脂、201×7强减性苯乙烯系阴离子交换树脂南开大学化工厂;三氟乙酸(色谱纯) 天津南开允公合成技术有限公司;乙腈(色谱纯) 美国J T Baker公司;超纯水SMART系列超纯水系统制;十肽标准品(YQKFPQYLQY) 批号BV11101201,经过HPLC检测和MS检测,纯度99.08%,分子量1377.58,上海楚肽生物技术有限公司合成;氯化钠、硼酸、硼砂、乙酸乙酯均为分析纯,天津市赢达稀贵化学试剂厂;氢氧化钠分析纯,天津市风船化学试剂科技有限公司;盐酸分析纯,天津市化学试剂批发公司国。
Vydac 218TP54 C18液相分析型色谱柱(250mm× 4.6mm,5μm) 美国Grace公司;FA1104N电子天平上海精密科学仪器有限公司;FE20实验室pH计梅特勒-托利多仪器(上海)有限公司;EMS-8A加热磁力搅拌器天津市欧诺仪器仪表有限公司;L535-1低速离心机长沙湘仪离心机仪器有限公司;3-18K高速冷冻离心机美国Sigma公司;冷冻干燥机北京博医康实验仪器有限公司;NF膜实验机系统海得科膜分离技术(北京)有限公司;6000u中空纤维膜组件天津膜天膜工程技术有限公司;SMART-N SMART系列超纯水系统上海康雷分析仪器有限公司;TU-1810DPC紫外可见分光光度计北京普析通用仪器有限责任公司;1500 Q05/2000ES全自动四元梯度高效液相色谱仪(配有UV1000紫外检测器) 美国SSI/Alltech公司。
1.2实验方法
1.2.1酪蛋白水解产物的制备
1.2.1.1胃蛋白酶水解底物质量浓度为7g/100mL,水解温度为37℃,pH3.0,酶与底物的质量比为1∶100,水解时间为3h。水解过程中滴加1mol/L HCl溶液或1mol/L NaOH溶液维持pH3.0,3h后煮沸灭酶结束反应[20]。
1.2.1.2胰蛋白酶水解将经胃蛋白酶水解后的酶解液降温至48℃,调整pH7.7,用胰蛋白酶继续水解,酶与底物的质量比为1∶500,水解过程中滴加1mol/L HCl溶液或1mol/L NaOH溶液维持pH7.7,3h后煮沸灭酶结束反应[21]。
1.2.1.3风味蛋白酶水解将经胰蛋白酶水解后的酶解液灭酶后冷却至50℃,调整pH6.8,用风味蛋白酶水解,酶底比([E]/[S])为2800U/g,水解时间为3h。水解过程中滴加1mol/L HCl溶液或1mol/L NaOH溶液维持pH6.8,3h后煮沸灭酶结束反应,冷却至室温,调节pH至7.0,用4000r/min转速离心15min,收集上清液[22-23]。
1.2.1.4水解物的超滤利用截留分子量为6000u的中空纤维膜组件,对收集的上清液进行循环超滤[24-26]。在25℃条件下,将压力控制在0.05~0.10MPa,收集滤出物,即得到分子量在6000u以下的溶液。
1.2.1.5超滤物的脱盐将超滤后所得到的溶液先经过强酸性苯乙烯系阳离子交换树脂,再经过强减性苯乙烯系阴离子交换树脂进行脱盐[27-28]。阳离子交换树脂和阴离子交换树脂装柱体积各为35mL,超滤溶液上样体积为150mL,流速为5.0mL/min。将脱盐后的溶液进行冷冻干燥,制成粉末待用。
1.2.2水解产物中目标肽的检测
1.2.2.1色谱条件[13,16,18]用1500 Q05/2000ES型全自动四元梯度高效液相色谱仪(配有UV1000紫外检测器)对水解产物进行分析,色谱柱:Vydac 218TP54 C18液相分析型色谱柱(250mm×4.6mm,5μm);流动相A:含0.1%三氟乙酸的超纯水;流动相B:含0.1%三氟乙酸的乙腈;流速:1.0mL/min;检测波长:220nm;柱温:30℃;进样量:10μL。十肽梯度洗脱程序见表1。

表1 十肽YQKFPQYLQY梯度洗脱程序Table 1 Gradient elution condition of decapeptide YQKFPQYLQY
1.2.2.2目标肽标准品溶液的制备及标准曲线制作准确称取标准品十肽(YQKFPQYLQY),加超纯水配制浓度为2.5、3、3.5、4、4.5、5mg/mL溶液,然后经过0.45μm的微孔滤膜过滤,得到不同质量浓度的标准品溶液。按照1.2.2.1的色谱条件检测标准肽的各浓度下峰面积,然后用峰面积和浓度制作标准曲线。
1.2.2.3样品中目标肽的检测准确称取自制样品粉末20.0mg,加超纯水配制成20mg/mL的溶液,经过0.45μm的微孔滤膜过滤,充分摇匀。然后按照1.2.2.1的条件分别对自制样品中的十肽进行检测。目标肽含量计算公式如下。
目标肽的质量分数(%)=水解物中目标肽的质量/水解物的质量×100
1.2.3水解产物及十肽的ACE抑制率及半数抑制浓度(IC50)的测定
1.2.3.1ACE抑制率的体外检测采用HHL法[29]进行体外ACE抑制率的检测,方法见表2。1mol/L HCl溶液:作为反应终止剂,用超纯水配制;100mmol/L硼酸-硼砂缓冲溶液:其中含300mmol/L NaCl,用超纯水配制,调pH至8.3;5mmol/L HHL试剂:将25mg HHL溶解于硼酸-硼砂缓冲溶液;0.1U/mL ACE试剂:将0.25U的ACE溶解于2.5mL硼酸-硼砂缓冲溶液;抑制剂:将待测样品用硼酸-硼砂缓冲溶液配制成不同浓度。按表2将各试剂分别加入到5mL离心管中并混匀,每管做3个平行。待反应结束后,向离心管中加入1.7mL乙酸乙酯进行萃取,经过充分振荡混匀后,在4000r/min、15min、4℃条件下离心。离心结束后,吸取1mL上层乙酸乙酯层于试管中,在120℃经过30min烘干,取出后,向试管中加入3mL超纯水,经过20s振荡混匀后,在228nm条件下检测吸光度,所测样品的ACE抑制率计算公式为:
ACE抑制率(%)=(B-A)/(B-C)×100
式中:A为ACE抑制剂和ACE同时存在时的吸光度;B为不加ACE抑制剂的吸光度,即对照;C为ACE和HHL空白反应的吸光度,即空白。

表2 ACE抑制率体外检测方法(μL)Table 2 Detection method of ACE activity inhibition peptide in vitro(μL)
1.2.3.2IC50的测定称取标准品十肽YQKFPQYLQY,用硼酸-硼砂缓冲液配制成浓度为5、10、20、40、60μg/mL的溶液。称取水解产物冷冻干燥后所制得的粉末,用缓冲液配制成浓度为0.1、0.2、0.3、0.6、1.0mg/mL的溶液,分别测定各溶液的ACE抑制率,以ACE抑制率为纵坐标,以质量浓度为横坐标绘制ACE抑制率曲线,并计算得出IC50值。
1.3数据处理
运用软件Origin 8.0,以十肽标准溶液质量浓度为横坐标,以峰面积为纵坐标制作十肽标准品标准曲线。根据样品所测得的峰面积,运用2.2中所列十肽质量分数计算公式计算得到样品中十肽质量分数。运用软件Microsoft Excel,以质量浓度为横坐标,以ACE抑制率为纵坐标,分别制作十肽质量浓度与ACE抑制率关系曲线(或酪蛋白水解产物质量浓度与ACE抑制率关系曲线),拟合方程,然后令ACE抑制率=50%,即纵坐标y=50,移项得到一个仅有x的一元二次方程ax2+bx+c=0,通过一元二次方程求根公式计算得到,舍去不在质量浓度范围内的根,得到的另一根x即为IC50值。
2 结果与分析
2.1十肽标准曲线
将1.2.2.2配制好的质量浓度分别为2.5、3、3.5、4、4.5mg/mL的十肽系列标准溶液按照1.2.2.1中表1条件注入液相色谱仪,以峰面积为纵坐标,以质量浓度为横坐标进行线性回归,得十肽的回归方程为:y= 0.9347x-0.92592,R2=0.95496,结果见表3、图1、图2。保留时间平均值为19.3596min,标准偏差为0.1126min,相对标准偏差(RSD)为0.58%,峰面积百分比平均值为96.1714%,标准偏差为0.1327%,RSD为0.14%。

表3 十肽标准品峰面积与相应质量浓度Table 3 Peak area of decapeptide standard substance and corresponding concentration
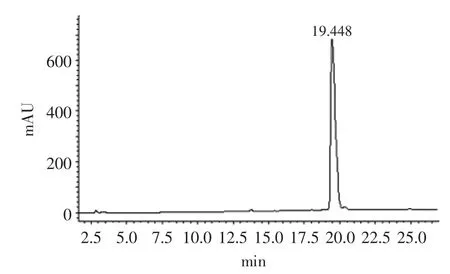
图1 2.5mg/mL十肽标准品液相色谱图Fig.1 Liquid chromatograph of 2.5mg/mL decapeptide standard substance

图2 十肽标准品标准曲线Fig.2 Standard curve of decapeptide standard substance
2.2样品中十肽含量的测定
将1.2.2.3配制好的浓度为20mg/mL的样品溶液按照1.2.2.1中表1条件注入液相色谱仪,记录所得峰面积,根据所制作的标准曲线计算样品中所含十肽的含量。按照相同条件重复进样4次,所得保留时间平均值为19.598min,标准偏差为0.099min,RSD为0.50%,峰面积平均值为25993,标准偏差为2452,RSD为9.43%,样品中十肽质量浓度平均值为0.99339mg/mL,标准偏差为0.00026mg/mL,RSD为0.026%,样品中十肽质量分数平均值为4.96694%,标准偏差为0.00131%,RSD为0.026%,结果见表4、图3。

表4 样品中十肽含量测定结果Table 4 Determination results of decapeptide in sample

图3 样品中十肽含量液相色谱图Fig.3 Liquid chromatograph of decapeptide in sample
2.3标准品及酪蛋白水解产物的ⅠC50值
2.3.1十肽YQKFPQYLQY的IC50值通过一元二次回归分析,得到回归方程为y=-0.0225x2+2.1623x+27.396(R2=0.9709),计算得到十肽的IC50值为11.75μg/mL。

图4 十肽质量浓度与ACE抑制率关系曲线Fig.4 Decapeptide concentration curve with ACE inhibition rate
2.3.2酪蛋白水解产物的IC50值通过一元二次回归分析,得到回归方程为y=-148.70x2+243.29x-2.2954(R2=0.9955),计算得到酪蛋白水解产物的IC50值为0.27mg/mL。
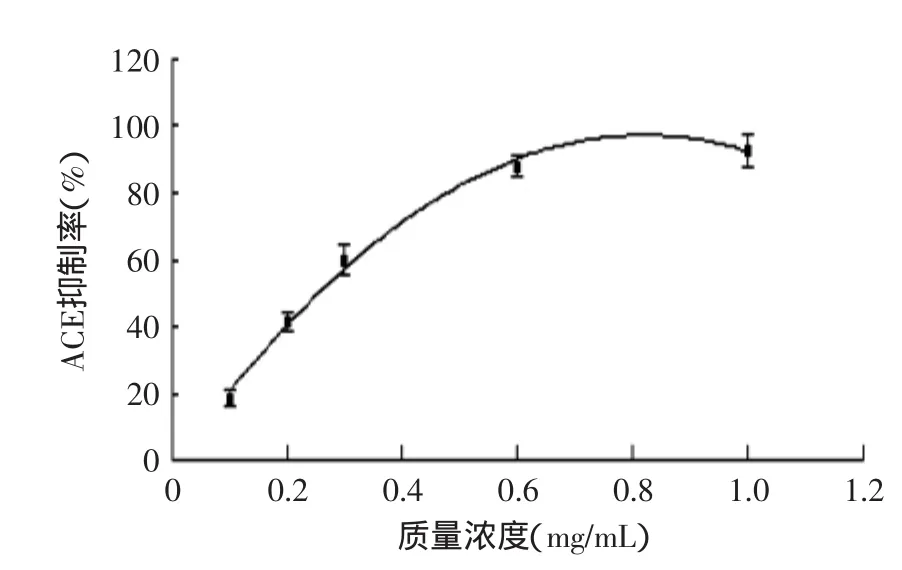
图5 酪蛋白水解产物质量浓度与ACE抑制率关系曲线Fig.5 Casein hydrolyzate concentration curve with ACE inhibition rate
由图4、图5可以看出十肽和酪蛋白水解物的ACE抑制率随着质量浓度的升高而增加,所以十肽和水解物都具有一定的质量浓度-效应关系。由十肽的IC50值为11.75μg/mL可知十肽具有较高的ACE抑制效果,酪蛋白水解物的IC50约为十肽的23倍,说明水解物的ACE活性抑制作用低于十肽。结合RP-HPLC检测结果可知,当酪蛋白水解物的IC50为0.27mg/mL时,其中所含十肽的质量分数为4.96694% ±0.00131%。
3 结论
酪蛋白先经过胃蛋白酶(pH3.0)水解3h后,再胰蛋白酶(pH7.7)水解3h,水解物经风味蛋白酶脱除苦味,经过6000u的中空纤维膜组件得到分子质量在6000u以下的混合多肽,通过离子交换树脂除盐,得到具有ACE抑制作用的水解物,其IC50为0.27mg/mL。应用RP-HPLC法对水解物中所含十肽进行定量检测分析,测得水解物中所含十肽YQKFPQYLQY的质量分数为4.96694%±0.00131%,RSD为0.026%。经过体外ACE抑制检测,十肽的IC50值为11.75μg/mL。因此,采用RP-HPLC法,可以快速地进行定量检测酪蛋白水解产物中所含有的ACE抑制肽(十肽:YQKFPQYLQY),操作简便。在实际生产中,可用于目标肽的检测和监测。
[1]陈绍行,沈卫峰.高血压治疗现状[J].国际心血管病杂志,2006,33(2):67-69.
[2]揭红波.浅谈心血管疾病的发病机理与预防[J].中外医疗,2011(5):184.
[3]Suh H J,Whang J H,Kim Y S,et al.Preparation of angiotensin I converting enzyme inhibitor from corn gluten[J].Process Biochemistry,2003,38(3):1239-1244.
[4]任锦,曹刚,张瑞洁,等.ACE抑制肽的合成及其活性研究[J].药学学报,2011,46(1):58-63.
[5]Maruyama S,Suzuki H.A peptide inhibitor of angiotensin I-converting enzyme in the tryptic hydrolysate of casein[J]. Agricultural Biology and Chemistry,1982,46(5):1393-1394.
[6]Nakamura Y,Yamamoto N,Sakai K,et al.Purification and Characterization of Angiotensin I-Converting Enzyme Inhibitors from Sour Milk[J].Journal of Dairy Science,1995,78(4):777-783.
[7]Nakamura Y,Yamamoto N,Sakai K,et al.Antihypertensive effect of sour milk and peptides isolated from it that are inhibitors to angiotensin I-converting enzyme[J].Journal of Dairy Science,1995,78(6):1253-1257.
[8]Li G H,Le G W,Shi Y H,et al.Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J].Nutrition Research,2004,24(7):469-486.
[9]张艳,胡志和.乳蛋白源ACE抑制肽的研究进展[J].食品科学,2008,29(10):634-640.
[10]赵延华,龚吉军,李振华,等.ACE抑制肽研究进展[J].粮食与油脂,2011(6):44-46.
[11]Cushman D W,Cheung H S.Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology,1971,20(7):1637-1648.
[12]蒋菁莉,任发政.食源性降血压肽的评价方法[J].中国乳品工业,2006,34(6):36-39.
[13]廖晓慧,孙海燕,刘冬,等.反相高效液相色谱法测定重组大肠杆菌发酵液中降血压肽的含量[J].时珍国医国药,2007,18(8):1817-1818.
[14]Yamada A,Sakurai T,Ochi D,et al.Novel angiotensin I-converting enzyme inhibitory peptide derived from bovine casein[J].Food Chemistry,2013,141(4):3781-3789.
[15]宗欣欣,朱梅,刘津爱,等.HPLC法测定醋酸艾塞那肽注射液中有关物质及主药的含量[J].沈阳药科大学学报,2011,28(10):791-796.
[16]朱红燕,邱利焱.HPLC法测定注射用胸腺五肽的含量[J].江西中医药,2011(6):58-59.
[17]钟山,尹玉华,杨得坡.RP-HPLC法测定中药材蚂蟥中蚂蟥多肽的含量[J].分析实验室,2013,32(11):1-3.
[18]徐梦虬,袁永俊,张黎明.高效液相色谱法测定β-酪啡肽[J].中国乳品工业,2009,37(4):55-57.
[19]胡志和,杨铭,王佳佳,等.一种ACE抑制肽及其制备方法:中国,201310239898.3[P].2013-09-04.
[20]张艳,胡志和,闫星,等.胃蛋白酶水解酪蛋白制备ACE抑制肽的条件[J].食品科学,2010,31(14):42-46.
[21]张艳.乳酪蛋白组分分离及水解物ACE抑制活性的研究[D].天津:天津商业大学,2010.
[22]王佳佳,胡志和,蒋毅.富含ACE抑制肽的酪蛋白水解物及其功能性酸奶对SHR血压的影响[J].食品工业科技,2013,34(10):345-351,356.
[23]王佳佳,胡志和,赵悦.利用电子舌对富含ACE抑制肽的酪蛋白水解物的脱苦评价[J].食品科学,2013,34(4):212-216.
[24]Miguel M,Contreras M M,Recio I,et al.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J]. Food Chemistry,2009,112(1):211-214.
[25]赵骏,宫霞,郭本恒.乳酪蛋白源ACE抑制肽的分离纯化[J].中国乳品工业,2006,34(6):8-11.
[26]姜瞻梅,田波,霍贵成.超滤法分离酪蛋白酶解物中的ACE抑制肽[J].食品与发酵工业,2006,32(10):59-61.
[27]姜瞻梅,田波,霍贵成.酪蛋白源ACE抑制肽的精制[J].食品工业科技,2007,28(2):187-189.
[28]谢小莉,崔克娇,王崇辉,等.离子交换在1,3-丙二醇发酵液脱盐中的应用[J].精细与专用化学品,2011,19(8):4-7.
[29]申晓文,牟光庆.酪蛋白源ACE抑制肽的评价方法和研究进展[J].食品工业科技,2010,31(9):375-381.
Quantitative determination of ACE inhibitory peptides in casein hydrolyzate by RP-HPLC
ZHAO Yong1,HU Zhi-he1,*,SUN Zhen-gang2,WU Wen-qi2,FENG Yong-qiang2,XUE Lu1
(1.Tianjin Key Laboratory of Food and Biotechnology,College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China;2.Tianjin Haihe Dairy Co.,Ltd.,Tianjin 300402,China)
The purpose was to establish a method for quantitative determination angiotensin converting enzyme(ACE)inhibitory peptides in hydrolyzate of casein using reversed-phase high performance liquid chromatography(RP-HPLC).Casein was hydrolyzed by pepsin,and then was hydrolyzed by trypsin.With flavourzyme for debittering of casein hydrolyzate.Salts of casein hydrolyzate were removed by ion exchange resin.The RPHPLC method to detect decapeptide YQKFPQYLQY was established.Using external standard method to determine YQKFPQYLQY of casein hydrolyzate.Results showed that,the linear range of decapeptide was 2.5~4.5mg/mL(R2=0.95496).The decapeptide concentration in the casein hydrolyzate was 4.96694%±0.00131%. Therefore,the RP-HPLC was simple and rapid,suitable for the quantitative detection of ACE inhibitory peptides YQKFPQYLQY.
casein;hydrolyzate;angiotensin converting enzyme inhibitory peptide;quantitative determination;reversed phase-high performance liquid chromatography(RP-HPLC)
TS252.4
A
1002-0306(2015)10-0054-05
10.13386/j.issn1002-0306.2015.10.002
2014-08-29
赵勇(1989-),男,硕士研究生,研究方向:食品生物技术。
胡志和(1962-),男,硕士,教授,研究方向:专用功能食品。
天津市科技支撑项目(14ZCZDNC00017);天津市高等学校创新团队项目(TD12-5049);天津市应用基础与前沿技术研究计划重点项目(14JCZDJC34500)。
