甘薯叶中咖啡酰奎尼酸类物质的分离纯化和高效液相色谱法分析
2015-10-28朱亚珠
朱亚珠
(浙江国际海运职业技术学院,浙江舟山316021)
甘薯叶中咖啡酰奎尼酸类物质的分离纯化和高效液相色谱法分析
朱亚珠
(浙江国际海运职业技术学院,浙江舟山316021)
以甘薯叶为研究材料,通过半制备高效液相色谱(HPLC)分离纯化得到6种咖啡酰奎尼酸类物质产品,并采用核磁共振(NMR)和电喷雾飞行时间质谱(ESI-TOF/MS),对不同甘薯叶多酚的具体组成成分及多酚含量进行检测分析。结果表明,甘薯叶多酚主要为咖啡酰奎尼酸及其衍生物。不同品种的甘薯叶多酚组成基本相同,主要成分为3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA,但含量有所差异。本实验采用高效液相色谱法准确、重现性好,并结合对不同品种紫薯叶酚类物质含量进行比较,能够为生产原料选择和工艺提供质量控制依据。
甘薯叶,多酚,咖啡酰奎尼酸,纯化,高效液相色谱
甘薯[Ipomoea batatas(L.)Lam.]是世界上重要的粮食、饲料、工业原料及新型能源用块根作物,广泛种植于世界各国[1]。目前有关甘薯营养价值的研究较多,日本已将其列为抗癌食品[2]。但是,对于甘薯茎叶研究却远不及对甘薯的研究深入。现代医学研究表明,甘薯叶具有抗氧化,抗过敏,促进胃肠蠕动,刺激消化,治疗便秘,促进胆固醇排泄,防止心血管脂肪沉积,维持动脉血管弹性,保护消化道、呼吸道及关节腔润滑等功效[3-6]。我国,甘薯叶资源十分丰富,但目前基本上作为废弃物被抛弃,若能变废为宝,将甘薯叶进行深加工,具有十分重要的经济价值和现实意义[7-8]。
随着现代营养科学的发展,人们发现多酚类物质对人体有着重要的生理功能,具有很强的抗氧化效果。甘薯叶中含有大量的富含还原性酚羟基的多酚类物质,其活性成分及功能逐渐受到学者的关注[9-13]。目前国内外已有一些关于甘薯叶多酚组成分析的报道[14-15],但很少涉及到不同品种甘薯叶间多酚含量及其成分的比较,阻碍了我国针对不同品种紫薯资源的深层次开发。本文采用半制备型HPLC从甘薯叶中分离纯化甘薯叶多酚单体化合物,并利用HPLC对不同甘薯叶多酚的具体组成成分进行分析,以期为我国甘薯叶的开发利用提供一定的理论基础。
1 材料与方法
1.1材料与仪器
10份甘薯亲本材料浙江省舟山市,2012年7月,叶龄5个月,由舟山市普陀区勾山富都生态农场提供(表1);3-CQA(绿原酸,3-O-Caffeoylquinic acid,CAS号327-97-9,纯度>98%)购于美国Sigma公司;Folin-Ciocalteu试剂、4-咖啡奎宁酸(4-CQA,4-OCaffeoylquinic acid,CAS号905-99-7,纯度>98%)、5-咖啡奎宁酸(5-CQA,5-O-Caffeoylquinic acid,CAS号906-33-2,纯度>98%) 购于日本Fluka公司;3,4-咖啡奎宁酸(3,4-diCQA,3,4-di-O-caffeoylquinic acid)、3,5-咖啡奎宁酸(3,5-diCQA,3,5-di-O-caffeoylquinic acid)、4,5-咖啡奎宁酸(4,5-diCQA,4,5-di-O-caffeoylquinic acid)根据Liu等[16]的方法制备;甲醇、甲酸(色谱纯)、无水乙醇等其他试剂(分析纯) 购于南京化学试剂有限公司。
BL-220H分析天平日本岛津公司;Agilent 1100高效液相色谱仪美国安捷伦公司;TSKgel ODS-80 TsQA色谱柱(4.6mm×250mm) 日本Tosoh公司;YMCPACK ODS-A色谱柱(10mm×250mm,5μm,) 日本YMC公司;HH-4数显恒温水浴锅江苏国华电器有限公司;AKTA Purifier 10蛋白纯化系统美国通用电气公司;micrOTOF-QIII电喷雾飞行时间质谱仪(ESI-TOF/MS) 美国Applied Biosystems公司;Bruker DRX-500MHz核磁共振仪(NMR) 德国Bruker公司;MODULYOD-230冷冻干燥机美国。

表1 实验所用甘薯主要育种亲本及来源地Table 1 Names and origins of main sweet potato parents used in this study
1.2实验方法
1.2.1样品处理在甘薯大田封垄期,取5株甘薯植株的顶部展开叶,每株取2片,共取10片,冷冻后在冷冻干燥机内真空冷冻干燥24h,混合均匀,4℃保存。
1.2.2提取方法分别称取10种甘薯叶粉末(甘薯叶用研钵充分捣碎),依据实验室之前确定的甘薯叶多酚最佳提取工艺[16]:提取温度80℃,料液比1∶50,乙醇浓度70%,提取40min,提取2次,得甘薯叶乙醇提取液。
1.2.3甘薯叶多酚单体化合物的分离纯化及结构鉴定采用半制备型HPLC分离纯化甘薯叶的酚类单体化合物。甘薯叶乙醇提取液经0.22μm微孔滤膜过滤后,采用AKTA纯化系统制备各CQA单体[17]。色谱柱为YMC-PACK ODS-A色谱柱(10mm×250mm,5μm);检测波长为280nm;进样量为500μL,每管收集5mL;洗脱条件为40%(v/v)甲醇,流速2.0mL/min。根据紫外检测器的实时监测收集洗脱液,多次上样,将出峰时间相同的物质富集起来,浓缩并冷冻干燥,制备得到的化合物进行ESI-TOF/MS和NMR分析。
ESI-TOF/MS在Thermo Scientific TSQ Quantum Ultra三重四级杆质谱仪上采用电喷雾离子源(ESI),在负离子模式下进行检测,具体参数:干燥气为N2,温度270℃;干燥气体积流量4L/min,压力9psi;毛细管电压4kV。
NMR在Bruker DRX-500核磁共振谱仪上以D2O为溶剂进行,采用5mm TXI H探头,工作频率为500MHz,在300K温度下测定。
1.2.4甘薯叶多酚的组成分析甘薯叶多酚的组成分析采用HPLC法[16]。取甘薯叶乙醇提取液,用去离子水适当稀释,0.22μm微孔滤膜过滤,滤液即为HPLC分析液。色谱条件:TSKgel ODS-80 TsQA色谱柱;柱温40℃;进样体积为20μL;采用梯度洗脱,流动相A为水,流动相B为甲醇,流动相C为5‰(v/v)甲酸溶液,流速为0.5mL/min,洗脱梯度如表2所示。根据保留时间和特征吸收色谱与3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA标准品对照定性,采用外标法定量。

表2 HPLC检测的洗脱梯度Table 2 Scheme of elution gradient for HPLC analysis
1.2.5混合标准品溶液的制备精确称取干燥至恒重的3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA标准品,分别制备浓度为0.1、0.05、0.01、0.005、0.0025g/L的系列混合标准液,进行HPLC检测,以浓度(g/L)为x,以峰面积为y,绘制标准曲线,计算回归方程。
1.2.6检出限的测定在相同色谱条件下,测定不同质量浓度混合标准溶液。HPLC方法对标准品的检出限是指不断稀释标样溶液直至HPLC在280nm波长检出的色谱峰信号(峰高)与噪音比在3∶1时所对应的标样浓度,以不同浓度为横坐标,峰面积为纵坐标。
1.2.7精密度、稳定性、重复性和加标回收率的测定精密度:移取混合对照品20μL,连续进样6次,以峰面积计算相对标准偏差(RSD),考察仪器的精密度。
稳定性:精密移取10μL制备得到的样品溶液,2、4、8、16、32h各测定一次。
重复性:称取同一产地同一品系紫薯叶粉末5份,按1.2.2制备溶液,精密移取20μL进样。
加标回收率:精确称取已知6种单体酚类含量的紫薯叶粉末7份,其中2份加入1.2.5中的混合对照品溶液0.1mL,2份加入稀释10倍的混合对照品溶液0.2mL,2份加入稀释10倍的混合对照品溶液0.1mL,1份留作空白。然后按照1.2.2提取方法制备试样,在1.2.4的色谱条件进样10μL。
1.2.8甘薯叶多酚含量的测定甘薯叶多酚含量测定采用Folin-Ciocalteu法[18-19]。取0.5mL样品液(适当稀释)与1.0mL的Folin-Ciocalteu试剂混匀,静置5min,加入2.0mL饱和Na2CO3溶液,30℃水浴反应1h,冷却后测定反应液在765nm波长处吸光度。甘薯叶多酚含量为每克甘薯叶原料中所含多酚的量(以绿原酸计,mg/g)。
1.2.9不同种甘薯叶多酚紫外扫描测定以不同品种的甘薯叶为材料,按1.2.4中的色谱条件对10种甘薯叶中多酚类物质的组成和含量进行分析、比较。
1.3数据分析
利用统计软件SPSS对不同品系甘薯叶多酚总含量和酚类单体化合物的物质含量数据进行方差分析和LSD多重比较。
2 结果与分析
2.1甘薯叶多酚的HPLC分析
甘薯叶粉末用70%乙醇在80℃浸提40min,浸提2次,合并提取液。提取液经稀释和0.22μm微孔滤膜过滤,按1.2.4进行HPLC分析。从图1可见,采用TSKgel ODS-80 TsQA色谱柱和水-甲醇-甲酸(5‰,v/v)为流动相,分离效果好,峰形对称。经与标样保留时间及紫外全扫描图谱比较,可以确定其中3-CQA、4-CQA、5-CQA分别对应化合物A、B、C,保留时间分别为14.21、21.46、22.06min;保留时间为31.34、33.02、38.89min的D、E、F色谱峰为未知成分。
2.2甘薯叶多酚单体成分的制备与结构解析
利用AKTA纯化系统和YMC-PACK ODS-A色谱柱分别对甘薯叶多酚单体成分进行分离纯化,收集各组分,经浓缩、冷冻干燥得到化合物1~6(图2,浓度均为0.1g/L)。化合物1~6经HPLC分析,峰形清晰、单一,纯度均在95%以上;化合物1~3经过与标样保留时间及紫外全扫描图谱比较,分别确定为3-CQA,4-CQA,5-CQA。化合物1~3的NMR分析如表3所示,同时3种化合物的LC-MS分析均为m/z 515[M-H]-。经NMR和ESI-TOF/MS分析,以及参照相关文献[17,20-23],得到化合物4~6分别为3,4-diCQA、3,5-diCQA和4,5-diCQA。

图1 甘薯叶多酚提取液的HPLC色谱图Fig.1 HPLC-DAD chromatogram of polyphenols extract from sweet potato leaves
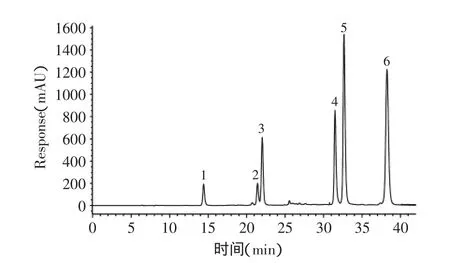
图2 混合酚类标准品(0.1g/L)的HPLC色谱图Fig.2 HPLC-DAD chromatogram of prepared standard solutions of polyphenolic compounds

表3 6种单体酚类物质标准曲线Table 3 Standard curves of 6 kinds of polyphenol monomers
2.3HPLC法测定甘薯叶多酚单体成分的含量
2.3.1甘薯叶多酚中单体的标准曲线与线性范围精确移取1.2.5中的混合标准品1mL进行梯度稀释,稀释后标准品和1.2.2中的样品溶液在1.2.4色谱条件下进样20μL,3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA均能够得到良好的分离。根据保留时间和色谱峰的比对,样品中测得了6种对应的单体酚类物质,分别为3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA。酚类化合物回归方程如表4所示,各对照品浓度与峰面积的相关性良好,R2>0.999。
2.3.2分析方法的评价精密度:3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA峰面积RSD分别为1.03%、0.82%、0.99%、1.21%、1.17%、0.79%,说明仪器精密度良好。
稳定性:3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA的峰面积的RSD分别为0.97%、0.99%、1.21%、1.51%、1.14%、0.87%,表明待测液中的6种多酚成分在32h内稳定性良好。
重复性:3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA的峰面积的RSD分别为0.88%、0.75%、1.67%、1.82%、1.42%、0.97%,方法重现性良好。
加标回收率:3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA的回收率分别为99.87%、99.47%、99.62%、99.80%、99.77%、99.91%,RSD分别为0.68%、0.79%、1.55%、1.43%、1.48%、0.94%,说明本方法可行。
2.3.3不同种甘薯叶多酚紫外扫描分析甘薯叶多酚的HPLC分析结果如图1所示,有6种组成成分。紫外扫描结果如图3所示,表明,峰A、B、C、D、E、F均在326nm处有最大吸收,同时在296nm处有一肩峰。结合甘薯叶HPLC分析结果以及紫外扫描结果,判断甘薯叶多酚物质主要为咖啡酰奎尼酸类物质,组分峰A、B、C、D、E、F分别为3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA。这与国外的研究结果基本一致[20-23]。同时,结果表明不同品种甘薯叶的咖啡酰奎尼酸类物质组成相同,但各咖啡酰奎尼酸类物质的含量有差异(表5)。

表4 6种单体酚类物质标准曲线Table 4 Standard curves of 6 kinds of polyphenol monomers

表5 甘薯叶中咖啡酰奎尼酸类物质的含量Table 5 Caffeoylquinic acid concentrations in sweet potato leaves
2.4不同种甘薯叶多酚含量分析
采用Folin-Ciocalteu法,对10种不同品种甘薯叶乙醇提取物的多酚含量进行分析、比较,不同品种甘薯叶乙醇提取物的多酚含量具体见表6。实验发现,不同甘薯叶品系间多酚含量差异显著(p<0.05),变化范围为41.52~182.86mg/g,其中台农71最高,烟薯27含量最低。本实验是在同田条件下种植不同甘薯品系,其多酚种类和含量均有差异。据此认为,甘薯中多酚含量和组成不仅与环境有关,也可能由其遗传背景所决定[21]。

表6 不同品种甘薯叶的多酚含量Table 6 Total polyphenol content of different varieties of sweet potato leaves
3 结论
根据前人对甘薯叶中化学成分的研究,甘薯叶多酚为一类由奎尼酸和不同数目的咖啡酸缩合而成的酚酸类化合物[21]。根据甘薯叶中咖啡酰奎尼酸类化合物特性的不同,本实验采用半制备型HPLC从甘薯叶中分离纯化得到6种咖啡酰奎尼酸单体,即3-CQA、4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA。该方法简便易行,分离效果良好,纯化率高,可用于高纯度咖啡酰奎尼酸类物质类单体的制备。同时,本实验以甲醇和甲酸为流动相进行梯度洗脱,采用HPLC-DAD和TSKgel ODS-80 TsQA色谱柱,建立了一种快速检测和分析甘薯叶中咖啡酰奎尼酸类物质的HPLC方法,具有稳定性高、重复性好的优点,并有望用于不同种类甘薯叶的初步鉴定。
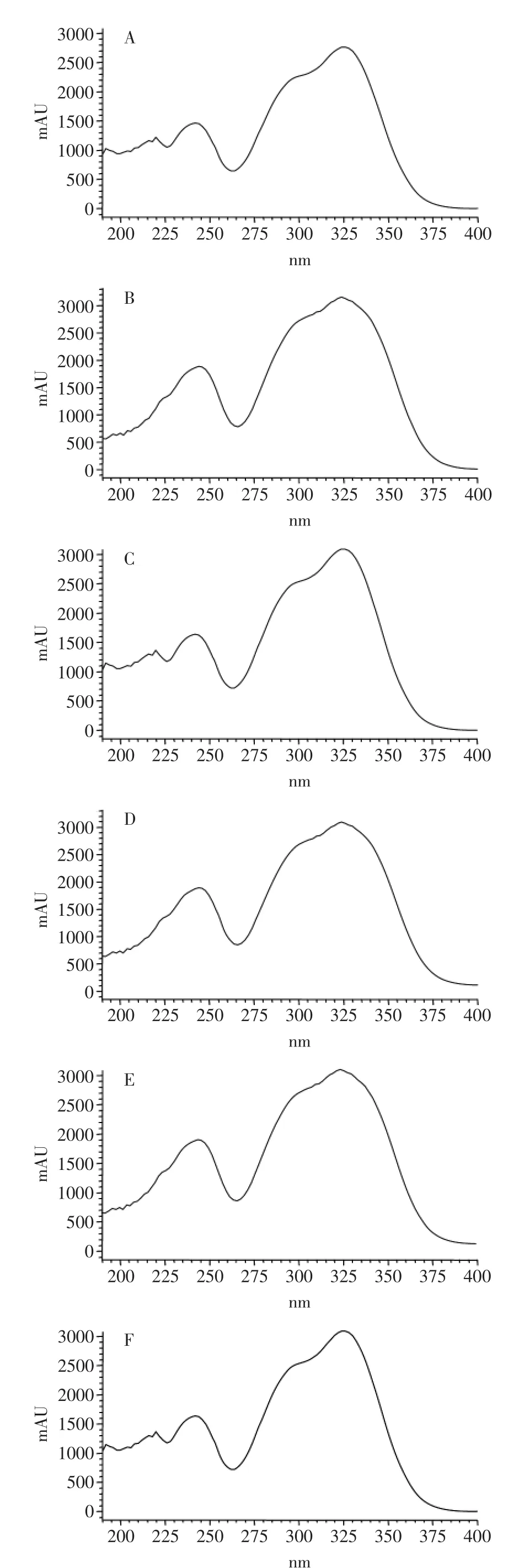
图3 峰A~F的紫外扫描谱图Fig.3 The UV spectra of peak A~F
本实验发现,甘薯叶中酚类单体主要为咖啡酰奎尼酸类化合物,其中3,5-diCQA的含量最高。此外,不同酚类单体在不同品系中含量也不相同,说明甘薯中的多酚含量和组成不仅受环境影响,也与其遗传背景有一定的联系,这为选育不同类型优良甘薯品系提供了依据。
[1]李强,刘庆昌,翟红,等.中国甘薯主要亲本遗传多样性的ISSR分析[J].作物学报,2008,34(6):972-977.
[2]刘丽香.甘薯叶中多酚提纯工艺及抗氧化活性研究[D].南京:南京农业大学,2008.
[3]罗丽萍,高荫榆,洪雪娥,等.甘薯叶柄藤类黄酮的抗肿瘤作用研究[J].食品科学,2006,27(8):248-250.
[4]高莹,张坤生,任云霞.甘薯叶提取物提取工艺及其抑菌作用的研究[J].食品研究与开发,2007,28(1):74-78.
[5]王友升,董银卯,宋彦,等.甘薯叶中清除自由基活性物质的提取·保存与定性分析[J].安徽农业科学,2008,36(1):4-7.
[6]Huang XQ,Tu ZC,Xiao H,et al.Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of sweet potato(Ipomoea batatas L.)leaves flavonoid[J].Food and Bioproducts Processing,2013,91(1):1-6.
[7]Jung JK,Lee SU,Kozukue N,et al.Distribution of phenolic compounds and antioxidative activities in parts of sweet potato(Ipomoea batata L.)plants and in home processed roots[J]. Journal of Food Composition and Analysis,2011,24(1):29-37.
[8]Johnson M,Pace RD.Sweet potato leaves:properties and synergistic interactions that promote health and prevent disease[J].Nutrition Reviews,2010,68(10):604-615.
[9]Liao WC,Lai YC,Yuan MC,et al.Antioxidative activity of water extract of sweet potato leaves in Taiwan[J].Food Chemistry,2011,127(3):1224-1228
[10]Bovell-Benjamin AC.Sweet potato:a review of its past,present,and future role in human nutrition[J].Advances in Food and Nutrition Research,2007,52:1-59.
[11]Chen CM,Li SC,Chen CY,et al.Constituents in purple sweet potato leaves inhibit in vitro angiogenesis with opposite effects ex vivo[J].Nutrition,2011,27(11-12):1177-1182.
[12]李鑫,王征.高效液相色谱法测定甘薯叶中的绿原酸含量[J].湖南农业大学学报,2009,35(2):130-132.
[13]Lachmana J,Hamouz K,Šulca M,et al.Cultivar differences of total anthocyanins and anthocyanidins in red and purplefleshed potatoes and their relation to antioxidant activity[J].Food Chemistry,2009,114(3):836-843.
[14]Ishida H,Suzuno H,Sugiyama N,et al.Nutritive evaluation on chemical components of leaves,stalks and stems of sweet potatoes(Ipomoea batatas poir)[J].Food Chemistry,2000,68(3):359-367.
[15]王建玲,刘学庆.特用甘薯的研究进展及综合开发利用[J].杂粮作物,2000,20(3):43-49.
[16]Liu LX,Sun Y,Laura T,et al.Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J.Tseng[J].Food Chemistry,2009,112:35-41.
[17]孙怡,张鑫,张文芹,等.苦丁茶冬青苦丁茶中多酚类物质的分离纯化与结构解析[J].食品科学,2011,32(11):60-63.
[18]刘丽香,Laura T,梁兴飞,等.Folin-Ciocalteu比色法测定苦丁茶中多酚含量[J].茶叶科学,2008,28(2):101-106.
[19]Zhang X,Xu F,Gao Y,et al.Optimising the extraction of tea polyphenols,(-)-epigallocatechingallate and theanine from summer green tea by using responsesurface methodology[J]. International Journal of Food Science and Technology,2012,47(10):2151-2157.
[20]Clifford MN,Johnston KL,Knight S,et al.Hierarchical scheme for LC-MSn identification of chlorogenic acids[J]. Journal of Agricultural and Food Chemistry,2003,51(10):2900-2911.
[21]Clifford MN,Knight S,Kuhnert N.Discriminating between the six isomers of dicaffeoylquinic acid by LC-MSn[J].Journal of Agricultural and Food Chemistry,2005,53(10):3821-3832.
[22]Bravo L,Goya L,Lecumberri E.LC/MS Characterization of phenolic constituents of mate(Ilex paraguariensis,St.Hil.)and its antioxidant activity compared to commonly consumed beverages[J].Food Research International,2007,40(3):393-405.
[23]Inbaraj BS,Lu H,Kao TH,et al.Simultaneous determination of phenolic acids and flavonoids in Lycium barbarum Linnaeus by HPLC-DAD-ESI-MS[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51(3):549-556.
Purification of caffeoylquinic acids from sweet potato leaves and their analysis by high performance liquid chromatography
ZHU Ya-zhu
(Zhejiang International Martime College,Zhoushan 316021,China)
Six caffeoylquinic acid(CQA)derivatives were separated by semi-preparative high performance liquid chromatography(HPLC)from sweet potato leaves.The structures of prepared monomers were confirmed by 1H NMR and electrospray ionization time-of-flight mass spectrometry(ESI-TOF-MS),and the components and total polyphenol contents of different sweet potato leaves were analyzed.The results demonstrated that sweet potato leaf polyphenols were mainly caffeoylquinic acid and its derivatives.The composition of different varieties of sweet potato leaves were basically the same,the main component were six CQA derivatives,including 3-CQA,4-CQA,5-CQA,3,4-diCQA,3,5-diCQA and 4,5-diCQA,and the contents of total polyphenol were different in various groups.Overall,this HPLC method was accurate for investigation of the polyphenol contents and components in sweet potato leaves,and lay down a base for the choice of production material.
sweet potato leaves;polyphenols;caffeoylquinic acids;purification;HPLC
TS201.2
A
1002-0306(2015)10-0073-06
10.13386/j.issn1002-0306.2015.10.006
2014-07-21
朱亚珠(1962-),女,硕士研究生,副教授,主要从事食品加工工艺方面的研究。
浙江省科技厅公益技术应用研究项目(2011C33014)。
