酶联适体分析法检测动物源性食品中的卡那霉素残留
2015-10-28赵秋伶史素青张尤华于晓艳
赵秋伶,史素青,张尤华,于晓艳
(1.辽宁工程技术大学矿业技术学院,辽宁葫芦岛125105;2.西北大学化学与材料学院,陕西西安710069)
酶联适体分析法检测动物源性食品中的卡那霉素残留
赵秋伶1,史素青2,张尤华1,于晓艳1
(1.辽宁工程技术大学矿业技术学院,辽宁葫芦岛125105;2.西北大学化学与材料学院,陕西西安710069)
建立了基于核酸外切酶Ⅰ的酶联适体分析法,用于测定动物源性食品中的卡那霉素残留。核酸适体和卡那霉素结合后,不再被核酸外切酶Ⅰ剪切,而能进一步联结辣根过氧化物酶(HRP),催化四甲基二苯胺底物显色,以450nm的吸光度与浓度的线性关系确定卡那霉素的检出限。考察了包被浓度、竞争反应时间、核酸外切酶I用量及封闭液等因素对检测的影响。在优化的实验条件下,建立的方法对卡那霉素检测有高灵敏度,检测限为3.26μg/L,线性范围5~100μg/L;在4种肉类中添加5.0、20.0、50.0μg/kg的卡那霉素时,加标回收率可达75.8%~90.6%,相对标准偏差RSD为4.2%~7.8%。该方法无需大型仪器,操作简单,可用于动物源性食品中卡那霉素残留的快速检测。
卡那霉素,核酸适体,酶联适体分析,动物源性食品
卡那霉素是第一代广谱氨基糖苷类抗生素[1],由于用药方便、价格便宜,在农业、畜牧业和水产业中应用广泛,常常被添加到饲料中促进动物的生长发育[2]。但是,残留在畜产品中的卡那霉素被人类长期食用后,会对人体产生不同程度的损害[3]。欧盟、美国和中国等许多国家对该类抗生素在食品中的残留限量都作了明确规定[4-5]。
酶联免疫吸附分析(ELISA)能满足大批量样品和现场快速检测等要求,在食品安全分析等领域有广泛的应用[6-7]。但抗体易受外界条件的影响,检测结果假阳性率高,制约了ELISA的实际应用。核酸适体是高亲和性和特异性结合目标分子的核苷酸序列片段[8-9]。由于具有选择性高、易合成、易修饰和相对稳定的优点[10-11],用核酸适体代替抗体发展ELISA,可以降低ELISA的成本,同时降低假阳性率,在食品安全分析领域有广阔的应用前景[12]。实际上,核酸适体在兽药残留分析中的应用尚处于起步阶段。除一些抗生素外,其他兽药类的核酸适体还尚未被筛选[13-14]。
核酸适体作为识别元素的酶联分析法(Enzyme Linked aptamer Assay,ELAA)在抗生素残留分析中的应用已有一定的基础,竞争型ELAA已被成功建立并用于检测赭曲霉素A[15],检测原理和抗体做识别元素的检测完全相同,且都是显色浅者为阳性。而具有新型检测机理的ELAA研究甚少。本文利用异硫氰酸荧光素(FITC)标记的固相核酸适体作为识别元素,以期建立外切核酸酶I依赖的酶联适体分析法检测动物源性食品中的卡那霉素残留,丰富核酸适体免疫分析法的实际应用,为保障我国动物源性食品质量安全提供一种有效的技术手段。
1 材料与方法
1.1材料与仪器
硫酸卡那霉素、硫酸新霉素、硫酸链霉素、硫酸庆大霉素、硫酸奈替米星、硫酸阿米卡星和恩诺沙星美国Sigma公司,使用前用水配成100mg/L储备液;核酸外切酶I(Exonuclease I),10×Exonuclease I buffer大连宝生物工程有限公司;链霉亲和素修饰的酶标板、四甲基二苯胺(Tetramethylbenzidine)底物显色液美国Thermo Scientific公司;Anti-Fluorescein(FITC)-HRP美国Millipore公司;检测卡那霉素的ELISA试剂盒北京中检维康技术公司;寡核苷酸大连宝生物工程有限公司;试样(猪肉、猪肝、鸡肉、鱼肉) 购于市场;实验用水18.2MΩ·cm超纯水;其他试剂均为分析纯。
Milli-Q超纯水系统美国Millipore公司;电子分析天平梅特勒-托利多仪器有限公司;高速冷冻离心机、微量可调移液器德国Eppendorf公司;SpectraMax Paradigm多功能酶标仪美国Molecular Devices公司;摇床、MSl Minishaker旋涡混合器和Ultra-Turrax T25均质器德国IKA公司。
1.2实验方法
1.2.1溶液的配制及缓冲液带生物素(biotin)和异硫氰酸荧光素(FITC)标签的寡核苷酸序列A:5′-biotin-CACGCACGTCCATGATGGGGG TTGAGGCTA(FITC)AGCCGA-3′下划线部分是卡那霉素的核酸适体,经由高效液相色谱纯化,首先用水配成100μmol/L储备液。
PBS缓冲液:0.1mol/L,pH=7.4。
PBST缓冲液:0.1mol/L,pH=7.4,含2mmol/L MgCl2和0.12%Tween20。
结合缓冲液:20mmol/L Tris-HCl,pH=8.0,含50mmol/L NaCl,5mmol/L KCl和5mmol/L MgCl2。
PBSE缓冲液:0.01mol/L的PBS,pH=4.0,含0.4mmol/L的EDTA和2%三氯乙酸。
1.2.2检测DNA的固定实验在包被缓冲液PBS中进行,首先向PBS中加入检测DNA(A),使得A的浓度为125nmol/L。链霉亲和素标记的酶标板的凹槽用200μL洗涤缓冲液PBST洗涤三次,每次5min。然后在酶标板的每个凹槽中加入100μL 125nmol/L的A,置于37℃摇床,反应2h。A的5′端是生物素标签,通过生物素和链霉亲和素的特异相互作用A包被到链霉亲和素标记的酶标板的凹槽。凹槽用200μL PBST缓冲液洗涤三次,每次5min,以去除未反应或吸附的A。然后加1%BSA做封闭反应,反应时间1h,反应完毕用PBST洗涤3次。检测DNA(A)包被的酶标板立即用于下步反应。
1.2.3酶联核酸适体法的检测卡那霉素储备液用结合缓冲液稀释成系列浓度,分别加入到包被了A的酶标板的凹槽中,每口100μL,室温孵育50min,核酸适体和卡那霉素充分反应。接着在反应液中加入1.2μL核酸外切酶I(Exo I,5U/μL)和11μL 10×Exo I缓冲液,在37℃孵育30min,未和卡那霉素作用的核酸适体被Exo I剪切,反应完毕弃去反应液,用200μL PBST洗涤缓冲液洗涤三次,每次5min,在洗涤的过程中被Exo I剪切掉的带FITC标签的单核苷酸全部被去除。然后每口加100μL按1∶5000稀释的Anti-FITCHRP,37℃反应30min,移去反应液,洗涤三次,最后每口加100μL四甲基二苯胺(TMB)底物显色液,反应20min,加25μL 2mol/L的H2SO4终止反应,反应液由蓝变黄,用酶标仪测450nm的吸光度,同时用相机拍照。
1.2.4实验条件的优化
1.2.4.1DNA(A)的包被浓度的优化考察了使用25、50、75、100、125、150、200nmol/L的A包被酶标板后(无封闭步骤),外切核酸酶I(exo I)过量时,检测1000μg/L的卡那霉素的A450值。
1.2.4.2封闭液的优化核酸适体在最优包被量125nmol/L的条件下,exo I过量时,用BSA、明胶、乳粉、酪蛋白等封闭液封闭后,考察检测0μg/L卡那霉素的A450(空白)。
1.2.4.3exo I的用量的优化当DNA包被浓度为125nmol/L,封闭液为1%BSA时,考察exo I用量为0.5、0.8、1.0、1.2、1.5、1.8μL(5U/μL)时,检测0μg/L卡那霉素的A450(空白)。
1.2.4.4反应时间的优化当DNA(A)和exo I用量一定时,考察20、30、40、50、60、70min下DNA(A)和100μg/L卡那霉素反应时对A450的影响。
1.2.5特异性实验为了考察该方法的特异性,选择与其结构类似的其他氨基糖苷类抗生素(新霉素、链霉素、庆大霉素、奈替米星和阿米卡星)及非氨基糖苷类药物恩诺沙星作为对照参照物。在相同的测试条件下,当卡那霉素的浓度为50μg/L,而其他糖苷类抗生素为100μg/L时,比较450nm处的净吸收值,并计算交叉反应率;当卡那霉素及对照物的浓度为100μg/L,测定450nm处的净吸收值,交叉反应率为P/N。净吸收值的计算见式(1),交叉反应率见式(2)。

1.2.6样品的提取与净化称取5g(精确至0.01g)试样50mL离心管中,加入10.0mL磷酸盐缓冲液(PBSE)均质2min,于平板振荡器上振荡提取10min,离心10min(4500r/min),将上清液转移到另一个50mL离心管中。在残渣中再加入10.0mL PBSE,重复上述操作,合并上清液,用1.0mol/L的NaOH调pH为8.0±0.2,0.22μm滤膜过滤,待测定。
1.2.7样品的添加回收实验选择猪肉、猪肝、鸡肉和鱼肉四种肉类试样进行样品添加回收实验。向样品中分别添加5.0、20.0、50.0μg/kg三个水平的卡那霉素标准液,室温下放置过夜后用1.2.6方法处理,用建立的方法检测。
1.2.8检出限(LOD)的确定根据LOD的定义,检出限为空白加3倍标准偏差对应的卡那霉素质量浓度。
2 结果与分析
2.1检测原理
检测原理如图1所示,检测DNA(A)的5′端标记了生物素基团(biotin),通过生物素和链霉亲和素的特异相互作用,A被固定到链霉亲和素标记的酶标板,A中下划线序列为卡那霉素的核酸适体,另一部分为辅助序列。当加入卡那霉素时,核酸适体和卡那霉素特异性结合导致核酸适体构象发生变化,将不再被核酸外切酶I剪切,3′端第七个碱基上标记的异硫氰酸荧光素基团(FITC)被保留下来,它能进一步捕获Anti-FITC-HRP(带HRP标签的FITC抗体),最终,HRP能催化无色的TMB底物溶液显蓝色,如果加入2mol/L的H2SO4,产物由蓝色变成黄色。相反,没有卡那霉素,当加了核酸外切酶I时,核酸外切酶I从3′端开始将核酸适体的碱基序列一个一个的水解,FITC跟着掉下来。联结HRP的linker被切掉,在洗涤步骤中被洗走,后面的步骤无法进行,TMB底物无颜色显现。A中绿色部分为辅助序列,因为这段序列的存在,反应离固相表面有一定距离,消除了空间障碍,反应效率更高。

图1 检测卡那霉素的酶联适体分析传感示意图Fig.1 Sensing principle of enzyme-linked aptamer assay for kanamycin
2.2实验条件的优化
2.2.1DNA(A)的包被浓度的优化首先对DNA(A)的包被浓度进行优化,实验结果见图2:开始时随A浓度的增加,A450(450nm处的吸光度)增大,这是因为随着A浓度的增加,固定到酶标板上的A数量增多,参与反应的A的数量也增加。当A浓度为125nmol/L时,A450值最大,表明参与反应的A数量达最大值,此时微孔板已被A饱和。所以,本实验中DNA包被浓度采用125nmol/L。

图2 不同浓度DNA(A)包被酶标板对检测结果的影响Fig.2 Influences of DNA(A)concentration coating onto microplate wells on detection results
2.2.2封闭液的优化非特异性吸附引起的背景颜色较深,同时由于检测限的定义与空白值的大小紧密相关[16],因此试图通过封闭液的优化来降低空白值。根据实验结果(图3):封闭液的种类和浓度均会影响空白值,综合考虑,1%BSA做封闭液时,空白检测值最小(A450=0.125),因此选择1%BSA作为封闭液。
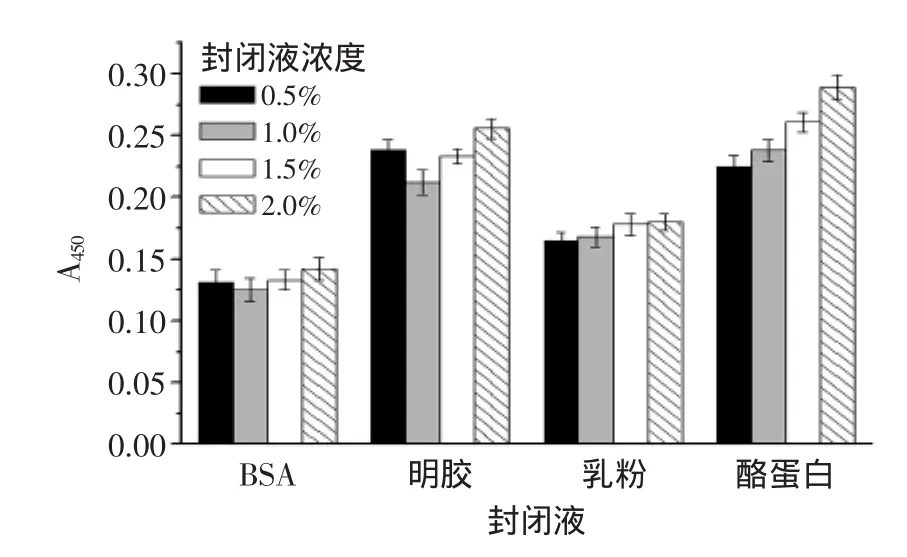
图3 封闭液对空白测定值的影响(n=3)Fig.3 Influences of blocking solutions on determination of blank value(n=3)
2.2.3exo I的用量的优化实验结果表明(图4):exo I用量为1.2μL时,A450(空白)值已达最小,以后也不再降低,表明此时微孔板上包被的DNA(A)已被exo I完全剪切。所以,本实验中exo I的用量采用1.2μL。

图4 卡那霉素的用量对空白测定值的影响(n=3)Fig.4 Influences of exocluease I’s dosage on determination of blank value(n=3)
2.2.4反应时间的优化结果见图5。随着反应时间的增加,A450随之增大,且在50min时达到最大,说明此时反应程度已达最大;此后A450不再增加,甚至稍有降低,说明此时有副反应发生,导致反应程度降低。因此,确定最佳反应时间为50min。

表1 交叉反应的实验结果(n=3)Table 1 The experimental results of cross reaction(n=3)

图5 反应时间对检测结果的影响(n=3)Fig.5 Influences of reaction time on determination results(n=3)
2.3实验结果与标准曲线
在优化的实验条件下,考察了此显色体系对梯度稀释的卡那霉素的响应。随着卡那霉素浓度的增加,溶液颜色逐渐加深,450nm的吸光度值逐渐增大(图6)。在5~100μg/L范围内,A450与卡那霉素质量浓度呈良好的线性关系(见图7),标准曲线方程为y= 0.0136x+0.162,相关系数R2=0.992。该方法的LOD值为3.26μg/L。该酶联适体分析法的灵敏度远低于欧盟规定的限量标准120μg/L[17],即满足定量检测要求。

图6 TMB底物显色体系对不同浓度卡那霉素的吸光度响应Fig.6 Response of absorbance change at 450nm of TMB substrate system upon analyzing different concentrations of kanamycin

图7 校正曲线(n=5)Fig.7 Calibration curve(n=5)
2.4方法特异性分析
特异性分析的实验结果见图8,可见,除卡那霉素外,即使其他抗生素的浓度提高了2倍,其吸光度值也无明显的提高。从误差线可知,核酸适体对对照试剂有微弱信号,但非常小,在系统误差范围内,可以忽略。交叉反应率见表1,由表1数据可知交叉反应率均小于4%,表明该方法对卡那霉素的检测具有较高的特异性。

图8 不同物质作用下TMB体系吸光度变化值(n=3)Fig.8 Absorbance value changes of TMB system under the action of different substances(n=3)

表2 回收率实验(n=5)Table 2 The experiment results of recovery(n=5)
2.5实际样品的添加回收实验
选择猪肉、猪肝、鸡肉和鱼肉四种肉类试样进行添加回收实验,以验证本方法应用于实际样品检测的准确度,同时采用ELISA试剂盒进行对照。计算各水平的回收率和相对标准偏差,结果如表2所示。核酸外切酶I依赖的酶联适体法检测卡那霉素在四种肉类产品的加标回收率为75.8%~90.6%,相对标准偏差为4.2%~7.8%,且检测结果与ELISA方法一致。表明本方法准确度和灵敏度良好,能够满足动物原性食品中卡那霉素残留检测的要求。
3 结论
以单链DNA作为识别核酸适体,建立了检测卡那霉素的核酸外切酶Ⅰ依赖的酶联核酸适体分析方法。在优化的实验条件下,在5~100μg/L范围内,450nm处的吸光度与浓度成良好线性关系,检测限为3.26μg/L。在实际样品肉类中添加适量的卡那霉素后,添加回收率75.8%~90.6%,相对标准偏差为4.2%~7.8%。该方法能用于动物源性食品中卡那霉素残留的检测,且方法简单,结果准确,可满足大批量样品和现场快速检测等要求。
[1]胡小莉,刘绍璞,罗红群,等.氨基糖苷类抗生素分析方法的研究进展[J].分析科学学报,2005,21(3):316-415.
[2]程国栋,崔向云,吴小慧,等.牛奶中卡那霉素残留量的测定[J].中国乳品工业,2014,42(9):47-49.
[3]Bai X,Hou H,Zhang B,et al.Label-free detection of kanamycin using aptamer-based cantilever array sensor[J]. Biosens and Bioelectron,2014,56:112-116.
[4]葛志容,李元平,黄冠胜,等.食品中农业化学品残留限量[M].北京:中国标准出版社,2006:264,656.
[5]林维宣.各国食品中农药兽药残留限量规定[M].大连:大连海事大学出版社,2002:1314-1376.
[6]Jiang X X,Shi H Y,Wu N,et al.Development of an enzymelinked immunosorbent assay for diniconazole in agricultural samples[J].Food Chem,2011,125:1385-1389.
[7]Walsh R B,Kelton D F,Hietala S K,et al.Evaluation of enzyme-linked immunosorbent assays performed on milk and serum samples for detection of neosporosis and leukosis in lactating dairy cows[J].Can Vet J,2013,54:347-352.
[8]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase. Science,1990,249(4968):505-510.
[9]Fang X,Tan W.Aptamers generated from cell-SELEX for molecular medicine:a chemical biology approach[J].Accounts Chem Res,2010,43(1):48-57.
[10]Tan X,Chen T,Xiong X,et al.Semiquantification of ATP in live cells using nonspecific desorption of DNA from graphene oxide as the internal reference[J].Anal Chem,2012,84(20):8622-8627.
[11]Xiao Y,Piorek B D,Plaxco K W,et al.A reagentless signalonarchitectureforelectronic,aptamer-basedsensorsvia targetinduced strand displacement[J].J Am Chem Soc,2005,127(51):17990-17991.
[12]Cruz-Aguado J A,Penner G.Determination of ochratoxin A withaDNAaptamer[J].JAgricFoodChem,2008,56:10456-10461.
[13]Niazi J H,Lee S J,Gu M B.Single-stranded DNA aptamers specific for antibiotics tetracyclines[J].Bioorg Med Chem,2008,16:7245-7253.
[14]梁淼,刘锐,苏荣欣.面向食品安全分析的核酸适配体传感技术[J].化学进展,2012,24(7):1378-1387.
[15]Cruz-Aguado J A,Penner G.Determination of ochratoxin A withaDNAaptamer[J].JAgricFoodChem,2008,56:10456-10461.
[16]张洁琼,高淑霞,王硕,等.双抗体夹心酶联免疫吸附法检测杏仁过敏原苦杏仁球蛋白[J].食品科学,2013,34(16):173-177.
[17]刘信嘉,江颖妍,李美英,等.卡那霉素A酶联适配体检测方法研究[J].分析化学,2013,41(9):1428-1433.
Enzyme-linked aptamer assay for detection of kanamycin residues in animal derived food
ZHAO Qiu-ling1,SHI Su-qing2,ZHANG You-hua1,YU Xiao-yan1
(1.College of Mining Industry Technology,Liaoning Technical University,Huludao 125105,China;2.College of Chemistry&Materials Science,Northwest University,Xi’an 710069,China)
Exonuclease I-based enzyme-linked aptamer assay for the detection of kanamycin residues in animal derived food was established in this paper.Aptamer binding with kanamycin could no longer be digested by exonuclease I,but could further specifically capture the horseradish peroxidase(HRP)that catalyzed methyenedianiline substrate to produce color change.Determination of the limit of detection was based on linear relationship between absorbance value at 450nm and the concentration of kanamycin.The effects of coated concentration,competitive reaction time,dosage of exonuclease I and blocking solutions on the detection were investigated.The results showed that under the optimal conditions,the established exonuclease I-depended enzyme-linked aptamer analysis of kanamycin have high sensitivity,the detection limit was 3.26μg/L with linear ranging from 5 to 100μg/L.When kanamycin of 5.0,20.0 and 50.0μg/kg were added to four animal derived foods,the recovery rates ranged from 75.8%to 90.6%,the relative standard deviation for RSD ranged from 4.2%to 7.8%.The method had simple operation without need large instrument and could be used for fast detection of kanamycin residues in animal derived foods.
kanamycin;aptamer;enzyme-linked aptamer assay;animal derived food
TS201.3
A
1002-0306(2015)10-0086-05
10.13386/j.issn1002-0306.2015.10.009
2014-12-03
赵秋伶(1979-),女,博士,讲师,研究方向:化学生物学与食品安全分析。
国家自然科学基金(21004047);陕西省青年科技新星人才项目(2014KJXX-62)。
