mir-181c靶向作用Smad7在神经母细胞瘤中的调控机制研究
2015-10-22王莉华
李 勇 王莉华
郑州大学附属郑州中心医院神经外科 郑州 450000
研究表明miRNA 参与多种生物过程[1],有许多关于miRNA 对神经母细胞瘤(Neuroblastoma,NB)组织下调机制的研究的报道[2-3]。我们先前的研究发现miR-181c抑制NB细胞的生长,然而,miR-181c对NB 的靶向调控机制有待于进一步研究。
1 实验步骤
1.1 细 胞 系 和 转 染 人 类NB 细 胞 系SK-N-SH 和SHSY5Y。MiR-181c模 块,Smad7siRNA 和 反 义siRNA 购 买 于上海基因制造公司。基因编码Smad7放大和插入pcDNA3向量(上 游:5“CGAAGCTTATGTTCAGGACCAAACGATCTGCGC 3”;下游:5“CCCTCGAGGGGCGCAGATCGTTTGGTCCTGAACAT 3”)。使用Lipofectamine TM 2000细胞转染试剂(英杰公司)进行细胞转染。
1.2 绿色荧光蛋白报告基因分析 扩增Smad7的野生型3‘UTR,并插入到pcDNA3/EGFP媒介的下游。Smad7DE 突变体3‘UTR(UGAAUGA 突变为AGUAAGA)进行扩增,并克隆到载体pcDNA3/EGFP 的下游。对于EGFP 报告基因的分析,使用mir-181c模块或ASO-mir-181c和野生型Smad7的3'UTR 或突变体3'UTR 进行细胞共转染。RFP表达质粒转染效率增高。在转染48h后,通过一个F-4500荧光分光光度计来测定裂解的细胞和GFP密度。
1.3 免疫蛋白印迹分析 在6孔板中培养细胞,密度为30×104个细胞/孔,并且在第2天细胞数量达到大约80%的时候进行细胞转染。转染后48h,用RIPA 缓冲液,在4度裂解细胞30min。使用BCA方法测定蛋白质浓度并且用20μg的蛋白质上样来进行SDS-PAGE分析。一抗是兔抗人Smad7的抗体(1:500,Abcam 公 司,美 国)和 兔 抗 人GAPDH 抗 体(1:1 000,Abcam 公司,美国)。二抗是羊抗兔IgG 结合辣根过氧化物酶(1:1 000,Abcam 公司,美国)。使用的ECL Plus Western印迹检测系统(GE Healthcare)检测结合的抗体,并使用高性能的化学发光膜(GE Healthcare)上进行检测。
1.4 RNA 的提取和实时定量PCR 根据制造商的说明方案,使用Trizol提取总的RNA。使用1μg的RNA 进行逆转录。对于miRNA 的逆转录反应,使用特定的miR-181c RT 引物,然后用于总RNA 的逆转录,Oligo(dT)作为一个通用的引物。使用SYBR GreenPCR 混合物进行实时定量PCR。所有使用的引物如下:miR-181cRT primer:5’CTCAAC TGGTGTCGTGGAGTCGGCAATTCAGTTGAGACTCACCG 3’;miR-181c forward primer:5’ACACTCCAGCTGGGAACATTCAACCTG 3’;Reverse primer:5’TGGTGTCGTGGAGTCG 3’;Smad7sense:5’TCTGCTCCTGGATCTCCCTGA GATG 3’;Smad7antisense:5’GCTTGCTGGCCTAATAGCAGAGCTT3’。
1.5 肿瘤细胞存活实验(MTT) 铺96孔板,4000个/每孔转染细胞。在转染48h 后,用MTT 培养4h。加入DMSO100μL,解除MTT 并将细胞放置摇晃10min。用分光光度计测定吸光值A(波长570nm)。细胞增殖率(%)=ATest/AControl×100%。
1.6 Transwell小室迁移试验和侵袭试验 无血清培养基培养24h,消化细胞并离心收集细胞,细胞悬液(细胞密度2.5×104)250μL 加入transwell上室,腔室底部则加入750μL的含有10%~20%血清的培养液。20h后取出transwell小室,使用棉签轻轻擦拭小室上层细胞,使用4%多聚甲醛固定transwell小室。取出固定好的小室,使用自来水冲洗小室,结晶紫染色15min冲洗。将染好色的小室经梯度酒精脱水,风干后取下膜层,用中性树脂封片,显微镜下计数即可。
1.7 统计学分析 数据分析选用SPSS 13.0软件,所有数据采用mean±SD,两组间比较采用双样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 mi-181c的直接目标基因Smad7 为了探索mir-181c对NB 细胞的调控机制,使用生物信息学技术我们预测了mi-181候选目标基因,认为候选基因对癌有潜在作用。我们挑选了Smad7,MAT2A,CDKN2AIP,TGFB1 当作候选靶向基因。为了确定这些基因是否被mir-181c调控,我们首先检测mir-181c控制3'UTR 段绿色荧光蛋白的(Green Fluorescent Protein GFP)强 度。如 图4B 示,mir-181c 减 少3'UTR 段Smad7、CDKN2AIP 和TGFB1 的GFP 强 度,而MAT2A 除外。另外,蛋白印迹法(Western blot)分析表明,mir-181c蛋白水平上减少对Smad7 和CDKN2AIP 的表达,而对TGFB1 和MAT2表达增高。鉴于mir-181c对Smad7的表达影响较CDKN2AIP显著,我们选择了Smad7作为进一步 研 究 对 象。Figure 1D 示,mir-181c 的 结 合 位 点 在Smad7 3'UTR,而且产生了多个突变位点。我们用mir-181c对野生型/3'UTR 段突变的Smad7重新转染细胞,发现mir-181c减少Smad 3'UTR 段GFP强度,对突变的Smad7 3'UTR段GFP强度没有影响。在蛋白水平上,mir-181c对Smad7 mRNA 的表达减少约40%。这些数据表明mir-181c直接靶向作用于Smad7,mir-181c可抑制Smad7的表达。

图1 mi-181c的直接目标基因Smad7
2.2 Smad7 介导mir-181c在NB 细胞中的抗肿瘤作用Smad7作为mir-181c的直接靶向基因,我们试图确定mir-181c是否引诱Smad7可以调节其生物学行为,我们用mir-181c模块和Smad7 过度表达载体pcDNA3/Smad7(无Smad7 3'UTR)共同转染细胞发现,两者均能控制Smad7表达量。通过Western blot和RT-PCR 验证了Smad7 的表达。MTT 和Transwell侵袭实验分析表明,Smad7过度表达可以恢复细胞活力,促进迁移和侵袭能力。对修复细胞活性,迁移和入侵能力。此外,进一步验证Smad7在NB 细胞中的作用,我们用siRNA 技术抑制了Smad7的表达。我们发现Smad7的敲除抑制细胞的生长,迁移和入侵。总而言之,这些数据表明,Smad7 蛋白可能作为的mir-181c在NB肿瘤发生的重要介质。
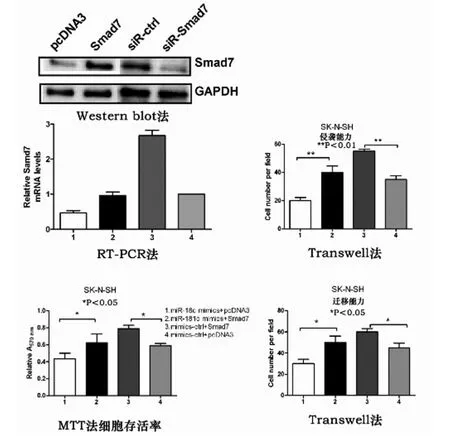
图2 Smad7介导mir-181c在NB细胞中抗肿瘤作用
3 讨论
先前关于miR-181家族靶标基因研究主要是5p段结合位点干扰基因的研究[4],最近研究人员用信息预测靶点法预测结合位点,进一步用突变3′段绑定结合位点干扰基因表达,检测靶点位目的基因表达率,发现miRNA-9靶定MMP-14基因3′段,并抑制其表达,对NB 起到抑制作用[5]。miR-181簇在癌症中起到的不同作用主要取决于它的靶向基因,通过靶向基因调节miRNA 的功能。为了了解mir-181c在NB细胞系中的抑癌作用机制,进一步研究靶向结合位点和碱基突变对基因表达的影响,本实验用EGFP 检测3'UTR段Smad7绿色荧光蛋白(GFP)强度,发现mir-181c结合位点在Smad73'UTR 段,而且有多个结合位点(本研究发现有6个结合位点,Smad73'UTR1460-1466),而且发现mir-181c对突变的Smad73'UTR 段GFP 强度没有影响(图1),验证了Smad7是mir-181c的直接靶向基因,并确定了3'UTR 段靶向位点,进一步明确mir-181c对Smad7起负表达作用。
通过功能研究(图2),证实Smad7 和pcDNA3/Smad7(Smad7超表达载体-无Smad7 3'UTR)对NB细胞促进生长,迁移和入侵作用。本实验两个细胞系均转染Smad7和pcDNA3/Smad7后MTT/Transwell结果示对NB细胞有积极作用,重要的是mir-181c-mmics+pcDNA3 组对NB细胞的抑制作用最显著,说明mir181c与超表达的Smad7 起到抑制NB细胞生长,迁移和侵袭作用,由此可以说明Smad7直接诱导mir-181c产生抗肿瘤作用。然而,以往研究结果表明,Smad7在EGF信号通路中起负性调控作用,在乳腺癌中抑制TGF-β1的表达,从而抑制肿瘤细胞生长[6],与本次实验数据形成了鲜明的对比。这个结果表明,Smad7 具有组织特性,在不同肿瘤中起到不同的作用。由此我们可以假设,mir-181c可能在乳腺癌和NB中起到不同的作用。
实质性证据表明,Smad的肿瘤抑制作用与TGF-β信号通路有关。Smad7在恶性肿瘤演变过程中的扮演不同的角色(抑癌/促癌)。Smad7通过防止信号转导复合物的活化抑制TGF-β1通路[7]。Smad7具有竞争性抑制作用外,还能够调节TGF/BMP 通路中Smurf遍在蛋白。Smurf2 连接到Smad7蛋白,降低信号传导,进而调节Smad7的遍在蛋白化和降解Smad。然而,到目前为止Smad7的功能仍然不清楚。通 过抑 制TGF-β,Smad7 过 度 表 达 抑 制 骨 和 肺 转 移[8-9]。Smad7同时通过减少MMP-2和MMP-9的分泌[10]抑制黑色素瘤细胞的生长和肿瘤发生。与此相反,Smad7的可诱发大肠癌转移[11-12]。符合Smad7 在结直肠癌促转移作用,我们的数据还表明,Smad7蛋白促进NB 细胞生长,迁移和侵袭。因此,Smad7蛋白功能机制有待进一步研究。
总之,我们研究证明了mir-181c通过Smad7 的表达抑制,调控NB 细胞的生长和转移,充当一种肿瘤抑制基因。这些结果为基因治疗NB患者奠定了重要基础。
[1] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[2] Guo J,Dong Q,Fang Z,et al.Identification of miRNAs that are associated with tumor metastasis in neuroblastoma[J].Cancer biology &therapy,2010,9(6):446-452.
[3] Terrile M,Bryan K,Vaughan L,et al.miRNA expression profiling of the murine TH-MYCN 10neuroblastoma model reveals similarities with human tumors and identifies novel candidate miRNAs[J].PloS one,2011,6(12):e28 356.
[4] Lima RT,Busacca S,Almeida GM,et al.MiRNA regulation of core apoptosis pathways in cancer[J].Eur J Cancer,2011,47(2):163-174.
[5] Zhang H,Qi M,Li S,et al.mircroRNA-9targets matrix metalloproteinase 14to inhibit invasion,metastasis,and angiogenesis of neuroblastoma cells[J].Mol Cancer Ther,2012,11(7):1 454-1 466.
[6] Kim S,Han J,Lee SK,et al.Smad7acts as a negative regulator of the epidermal growth factor(EGF)signaling pathway in breast cancer cells[J].Cancer letters,2012,314(2):147-154.
[7] Itoh S,Landstrom M,Hermansson A,et al.Trans-forming growth factor beta1induces nuclear export of inhibitory Smad7[J].The Journal of biological chemistry,1998,273(44):29 195-29 201.
[8] Javelaud D,Mohammad KS,McKenna CR,et al.Stable overexpression of Smad7in human melanoma cells impairs bone metastasis[J].Cancer research,2007,67(5):2 317-2 324.
[9] Azuma H,Ehata S,Miyazaki H,et al.Effect of Smad7expression on metastasis of mouse mammary carcinoma JygMC(A)cells[J].Journal of the National Cancer Institute,2005,97(23):1 734-1 746.
[10] Javelaud D,Delmas V,Moller M,et al.Stable overexpression of Smad7in human melanoma cells inhibits their tumorigenicity in vitro and in vivo[J].Oncogene,2005,24(51):7 624-7 629.
[11] Halder SK,Rachakonda G,Deane NG,et al.Smad7induces hepatic metastasis in colorectal cancer[J].British journal of cancer,2008,99(6):957-965.
[12] Li Q,Zou C,Han Z,et al.MiRNA-25functions as a potential tumor suppressor in colon cancer by targeting Smad7[J].Cancer letters,2013,335(1):168-174.
