国内多菌灵的研究进展
2015-10-21魏中华徐娟郭明霞石爱民孙继政
魏中华 徐娟 郭明霞 石爱民 孙继政
摘要 介绍了多菌灵的理化性质、在植物体内的残留情况、对微生物和动物的影响以及与其降解有关的因素,并对今后的研究方向进行了展望。
关键词 多菌灵;杀菌剂;研究进展
中图分类号 S482.2 文献标识码 A 文章编号 0517-6611(2015)03-125-03
Research Progress of Carbendazim in China
WEI Zhonghua, XU Juan, GUO Mingxia, SHI Aimin* et al
(China West Normal University, Nanchong, Sichuan 637000)
Abstract The physical and chemical properties of carbendazim, residue in plants, effects on microbes and animal were introduced, as well as the factors related to the degradation and the research direction was forecasted.
Key words Carbendazim; Fungicides; Research progress
基金项目 四川省教育厅重点项目(07ZA122)。
作者简介 魏中华(1989-),男,山东滨州人,硕士研究生,专业:动物学。*通讯作者,教授,博士,硕士生导师,从事昆虫系统学研究。
收稿日期 20141205
多菌灵又称棉萎灵、卡菌丹、霉斑敌、苯并咪唑44号,是一种高效低毒内吸性光谱杀菌剂,属苯并咪唑类化合物,化学性质稳定,有内吸治疗和保护作用。它是一种被广泛使用的广谱杀菌剂,对多种作物由真菌(如半知菌、多子囊菌)引起的病害有防治效果,是苯并咪唑菌灵杀菌剂和代谢物,可用于叶面喷施、拌种和土壤处理。
多菌灵原是1967年由美国杜邦公司开发的杀菌剂苯菌灵的中间产物。在1970年,我国沈阳化工研究院张少铭等科学家也独立发现了多菌灵的杀菌这一性质。到20世纪70年代中期时,中国、联邦德国已先后实现多菌灵的工业化生产,到20世纪80年代时,多菌灵在我国已发展成为工业化产量最大的内吸杀菌剂品种之一。
高浓度多菌灵对植物体内的多种酶存在影响,在美国和欧盟国家是禁用农药,在我国和其他一些国家则允许使用。在美化市容的情况下,一些娱乐场所如高尔夫果岭在一些国家可允许使用。随着对多菌灵的研究,科学家发现高浓度的多菌灵对动物存在危害,可损伤某些动物的睾丸导致不孕不育,影响动物的内分泌发生紊乱。笔者介绍了多菌灵对微生物、植物、动物的影响及其降解方面的研究进展,旨在为多菌灵的安全使用提供借鉴。
1 多菌灵的化学本质及其理化性质
1.1 化学本质
英文通用名:Carbendazim。
中文名:多菌灵、棉萎灵、苯并咪唑、贝芬替、2(甲氧基氨基甲酰)苯并咪唑、甲基1H苯并咪唑2基氨基甲酸酯、卡菌丹、霉斑敌、苯并咪唑44号。
英文别名:methyl benzimidazol1Hbenzimidazol2ylcarbamate;carbendazol;bavistin;derosal;delsene;methl2benzimidazolecarbamate;1Hbenzimidazole2carbamic acid methyl ester;2Benzimidazolecarbamic acid methyl ester。
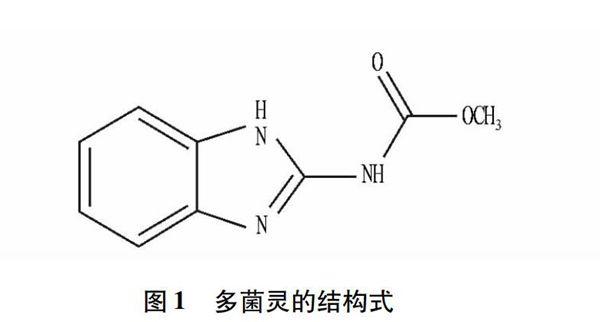
化学分子式:C9H9N3O2。
结构式见图1。相对分子质量:191.19。
图1 多菌灵的结构式
1.2 物理和化学性质
该产品为无味的粉末产品,当温度达到215~217 ℃时开始升华,温度大于290 ℃时熔融,当温度达到306 ℃时开始分解,该产品不溶于水,微溶于丙酮、氯仿和其他的有机溶剂。可溶于无机酸及醋酸,并形成相应的盐。该产品的纯品为白色结晶固体,原药为棕色粉末状。多菌灵的化学性质稳定,其原药可贮存2~3年并且有效成分不变。低浓度的多菌灵对动物和农作物无较大影响。
1.3 防治对象和作用
到目前为止,多菌灵已被用于防治多种植物、瓜果、蔬菜的病症,例如:豆类的炭疽病、白粉病、疫病,大葱和韭菜的灰霉病,茄子黃萎病,黄瓜的菌核病,蔬菜苗期的立枯病等[1]。此外,还用于水果保鲜,在纺织、纸张、皮革、制鞋、涂料工业中作防霉剂等。在南方主要用于防治水稻、蔬菜类的病害,而在北方主要用于防治小麦、棉花、蔬菜类的由真菌引起的病害。
1.4 作用机制
多菌灵可用于防治粮、果、蔬菜、棉、油、花卉、树木的多种真菌病害,其作用机制是干扰脱氧核糖核酸(DNA)的合成,特别是与核苷的生成过程受阻有关。在病原物细胞分裂过程中,多菌灵可与纺锤丝的微管蛋白质相结合从而对有丝分裂进行干扰。但是纺锤丝微管蛋白质的细微改变都可降低多菌灵与微管蛋白质的结合力,因而易引起抗药性。苯菌灵、甲基托布津等在生物体内外的降解或代谢也可转化为多菌灵,从而起杀菌作用。
2 对微生物、植物、动物的影响研究
2.1 对微生物的影响
2.1.1 对土壤微生物的影响。
徐瑞福等采用吸收法就多菌灵对土壤微生物的呼吸作用的影响进行了研究。结果表明,多菌灵加入土壤以后,在较短的时间内对土壤中的微生物产生抑制作用,但7 d以后,这种抑制作用逐渐减弱直至消失,因此,一般情况下,生产上用药将不会对土壤生态系统产生不利影响。土壤微生物呼吸动态变化曲线表明,土壤中的微生物生长符合生物增长的逻辑斯谛曲线[2]。
徐晓锋等也证实了多菌灵对土壤中不同的酶具有促进或抑制作用[3]。肖丽等采用PCRDGGE方法研究多菌灵对土壤中细菌群落结构的影响。结果表明,多菌灵影响并改变土壤细菌群落的种类和结构组成,导致土壤中细菌多样性的降低[4-5]。但这种影响是短暂的,因为多灵菌的重复使用会使土壤微生物产生抗性。
多菌灵能提高土壤中荧光假单胞杆菌的群体数量(试验效果不是很理想)从而提高棉花对黄萎病的防治效果。
2.1.2 对草履虫的影响。
采集草履虫对其进行富集培养,测定单位体积内的数量之后加入同浓度的多菌灵进行培养一段时间,再测定不同多菌灵浓度溶液中草履虫的数量。结果表明多菌灵对草履虫1 h內急性毒性最大无致死浓度为0.075 mg/L,最小全致死的浓度为37.500 mg/L;在一定剂量范围内,多菌灵对草履虫的生殖作用表现为低浓度时促进、高浓度时抑制作用[6]。这与内分泌干扰物量效效应相似。
2.1.3 对致病菌的影响。
研究发现多菌灵的使用可能会增加某种病菌抗药性的增加,也可能随着长时间重复用药导致某种病菌的抗性降低。2006~2010年匡静等在油菜菌核病菌对多菌灵抗药性监测中发现江苏省各地均有多菌灵抗性菌株的分布并且抗性率呈下降趋势[7]。现今,已发现并分离出多种多灵菌抗性菌株。
2.2 对植物的影响
2.2.1 在水稻体内残留。
采用田间试验方法,研究了多菌灵在水稻体内的最终残留量。试验分为消解动态试验和最终残留试验。经过样品处理、提取净化、测谱,结果表明,长沙、杭州和长春3地多菌灵在田水和植株中的半衰期较短,均小于4 d,在稻田土壤中的半衰期相对较长,为6.20~7.27 d,但相对旱地中多菌灵半衰期较短,游子涵等报道多菌灵在油菜土壤中的半衰期为3200 d[8],张玉婷等研究多菌灵在小麦土壤中的半衰期为26.60~34.50 d[9]。在收获的水稻中多菌灵主要集中于稻秆和谷壳,末次施药21 d 后均还高于0.5 mg/kg,因此,以施用过多菌灵的稻秆和谷壳作为饲料有一定的风险;糙米中多菌灵残留量极少,且远低于 MRL,是比较安全的。有研究结果表明,22%多菌灵悬浮剂在水稻上最高使用浓度为346.5 g/hm2,对水750 L最多施用3次,安全间隔期为2100 d[10]。
2.2.2 在柑橘、香蕉、芒果储藏期的降解残留。
为了使多菌灵在柑橘、香蕉和芒果贮藏期的使用更加安全合理,李海飞等研究了多菌灵在柑橘、香蕉、芒果储藏期的降解残留。结果表明柑橘、香蕉和芒果3种水果的果肉中多菌灵的残留量随着时间延长呈现先增加后减少的动态残留规律,但是果肉中多菌灵残留量却随着时间的延长先增加后减少。用最大浓度1 000.000 mg/L处理后柑橘、香蕉和芒果果肉中的多菌灵残留量达到最大但是均低于我国标准规定的最大残留限量(015 mg/kg)[11],说明多菌灵在试验水平下不会对柑橘、香蕉的安全质量造成负面影响,但芒果在储藏期的残留量高于欧盟对芒果的规定(0.10 mg/kg),所以芒果采摘后使用应谨慎。
我国《食品中农药最大残留限量》(GB27632005)国家标准规定多菌灵在柑橘、香蕉和芒果中残留最大限量均为015 mg/kg,欧盟对柑橘和香蕉的规定分别为5.00和1.00 mg/kg,CAC对芒果和香蕉的规定分别为2.00和1.00 mg/kg[11]。
2.2.3 在大豆中植株中残留动态。
张浩等进行了大豆植株及土壤中多菌灵残留分析方法的研究,并在此基础上又在黑龙江和吉林进行了40%多菌灵在大豆植株及土壤中残留动态的研究。
结果表明,40%多菌灵SC在大豆播种前拌种,在土壤中2年测定的半衰期为55.2~57.1 d;在植株中半衰期为18.3~21.6 d;大豆植株中的消解速度要快于土壤。从吉林和黑龙江2个试验点的残留测定结果看,多菌灵在土壤和大豆鲜植株中的消解较慢,具有相似的消解规律[12]。试验测定多菌灵在大豆籽粒中的最终残留量小于0.005 mg/kg,参考FAO对多菌灵在大豆(干)中规定的残留标准,建议我国制定的多菌灵在大豆籽粒中的MRL值为0.200 mg/kg。
2.2.4 在其他农产品内的残留状况。
随着研究范围的不断扩大,许多学者对多种农产品进行了多菌灵残留的测定,例如芝麻[13]、食用菌[14]、浓缩果汁[15]、草莓[16]、人参[17]、蒜苔[18]、苹果[19]以及其他中药材[20]等,研究结果表明使用过多菌灵后会有少量残留。
2.3 对动物的影响
2.3.1 对蚯蚓体内几种抗氧化酶的影响。
白桂芬等[21]以多菌灵为试验污染物,检测了蚯蚓急性染毒后体内抗氧化酶活性的变化,以研究多菌灵质量浓度与蚯蚓体内抗氧化酶活性之间的剂量效应关系,为探讨多菌灵的安全使用及其对相关动物的毒害程度积累基础资料。利用紫外分光光度计测量酶的活性,比较不同浓度的多菌灵对同一种酶的活性的影响,试验结果如下:
(1)多菌灵对蚯蚓谷胱甘肽过氧化物酶(GSHPX)活性的影响。与对照组相比,低质量浓度(0.75 g/L)的多菌灵对GSHPX活性起抑制作用;随着质量浓度的增加,多菌灵对其起诱导促进作用,在质量浓度为1.00~1.25 g/L时,多菌灵的诱导作用较强,酶活性迅速上升,并于125 g/L时达到峰值;多菌灵质量浓度继续增加,其诱导作用降低,酶活性开始下降,但仍高于对照组。
(2)多菌灵对蚯蚓过氧化物酶(POD)活性的影响。与对照组相比,0.75~1.00 g/L的多菌灵处理蚯蚓48 h,POD活性被抑制;但随着质量浓度的增加,酶活性明显上升,并于125 g/L时出现峰值,说明该质量浓度的多菌灵诱导促进了蚯蚓体内POD活性的升高;当多菌灵质量浓度达到1.50 g/L时,POD活性被抑制,且随着多菌灵质量浓度的升高,酶活性继续降低。
(3)多菌灵对蚯蚓超氧化物歧化酶(SOD)活性的影响。用质量浓度为0.72~1.25 g/L的多菌灵处理蚯蚓48 h,SOD活性均高于对照组,说明多菌灵对SOD活性起诱导促进作用,但高质量浓度多菌灵对SOD活性的促进诱导程度低于低质量浓度的多菌灵。
通过比较不同濃度的多菌灵对上述3种不同酶活性的影响,可以得出:多菌灵对蚯蚓体内的3种抗氧化酶存在不同程度的影响。从酶活性的变化趋势来看,对多菌灵的反应敏感顺序为:SOD>GSHPX>POD。
2.3.2 对大鼠睾丸发育和生精功能的影响。
为了探讨多菌灵对雄性大鼠睾丸发育和生精功能的影响及其作用机制,科研人员使用 40只清洁级未成年Wistar雄性大鼠进行试验,结果表明,中、高剂量组大鼠睾丸和附睾均明显萎缩、右侧睾丸和附睾重量减轻,左侧附睾尾精子活率和精子数量均低于对照组(P<0.01):中、高剂量组睾丸组织病理学检查可见明显异常;随着多菌灵染毒浓度的增加,各剂量组生精细胞凋亡率逐渐升高,cl2表达下降,Bax表达升高,与对照组比较差异有统计学意义(P<0.05,P<0.01)。由此得出[22],多菌灵可影响雄性大鼠的睾丸发育和生精功能[22],可能与下调Bcl2和上调Bax致细胞凋亡增加有关[23]。
2.4 致癌性
经国内外学者的研究表明多菌灵无致癌作用。通过对老鼠的研究显示,有三分之二的研究表明多菌灵有增加肿瘤的副作用,但是植物科学委员会的研究表明多菌灵没有改变DNA的效果,得出的结论是:这些老鼠肝脏肿瘤不能解释为预测致癌危害人类[24-25]。
3 多菌灵的降解
3.1 光解
虽然多菌灵的化学性质稳定,但是在自然界中由于光的存在进行着光解。经研究表明在太阳光照射下,多菌灵在正己烷、甲醇、重蒸水、池塘水和河塘水中的光稳定性特别强,表明其在自然条件下难以直接光解。但在光敏剂丙酮中却可以光解,光解的半衰期为33.8 d。其在高压汞灯下,在3种有机溶剂中的光解速率为:在正己烷溶液中最快,甲醇溶液中次之,丙酮溶液中最低;在不同水质中的光解速率为:重蒸水最快,河水次之,池塘水最慢;在不同pH的缓冲液光解速率为:pH4>pH9>pH7[5]。由此说明,光源的发射光谱和反应物质以及反应体系吸收光谱的重叠与吻合以及反应介质对光的吸收干扰是制约光解反应发生的重要因子[5]。
3.2 多菌灵降解细菌进行降解
经研究发现了能够对多菌灵进行降解的细菌。在我国湖南省红土壤中已分离出多菌灵的降解菌,以多菌灵作为唯一碳源和能源生长的菌株1_1鉴定为Bproteobacteria中的Ralstonia sp(罗尔斯通氏菌),但目前该菌株尚不能定种,还需要与模式种进行DNA杂交,根据同源性作进一步分析,为多菌灵的生物降解提供了新的微生物资源。
西北农林大学对复合菌(多菌灵降解菌 Alcaligenes sp.和Rhodococcus sp.按1∶4配比)降解多菌灵的速率进行了研究,结果表明该复合菌群的最优降解条件为温度30 ℃、pH 6.0、接种量7%,该条件下多菌灵的降解率可达75.76%,添加少量氮源(如尿素和酵母浸粉)可促进复合菌对多菌灵的生物降解[26]。
3.3 影响多菌灵降解的因素
多菌灵的降解受到多种因素的影响,主要包括土壤中微生物的种类、土壤中的含水量以及Cd的浓度。研究表明,土壤微生物、土壤湿度和土壤中Cd浓度、重复使用等对多菌灵的降解均有不同程度的影响,在所有处理中,灭菌土壤和未灭菌土壤比较,多菌灵的降解半衰期变化是最大的,所以土壤微生物是影响多菌灵降解的最主要因素,在多菌灵的降解中占有首要地位。试验选用的多菌灵降解菌-复合功能菌群也能有效降解土壤中多菌灵,对多菌灵的降解也有显著的促进作用。对土壤微生物生长、繁殖以及代谢活性有影响的环境因子也是影响多菌灵降解的重要因素之一, 如较高的土壤湿度和低浓度的Cd对土壤微生物生长有促进作用并能增强其活性,从而促进了土壤中多菌灵的降解,反之则抑制。重复施药会增加土壤微生物的抗性的降解[27]。
4 多菌灵的研究现状以及展望
世界各国或各组织对多菌灵含量的最低要求不同,例如:欧盟的标准是200 μg/L,澳大利亚的标准则是不超过10 μg/L,美国的标准是不超过80 μg/L,我国标准低于欧美检测但未出台具体的规定,卫生部和农业部于2011年1月2日联合发布了《食品中多菌灵最大残留限量标准》,并已于当年4月1日实施。柑橘最大残留量不超过5.00 mg/kg,西瓜的最大残留量不超过050 mg/kg,韭菜的最大残留量不超过200 mg/kg。把柑橘的残留量标准换算成国际单位后是5 000 μg/L,远低于欧美的限量标准。笔者认为,我国应提升多菌灵的检测标准,因为在我国鉴定的合格农产品出口到国外时就会被鉴定为不合格的或是违反他们法律法规的违规产品,阻碍我国的农产品贸易。
已有的研究只是停留在残留量测定的层面,应该更深层次地研究多菌灵在动植物体内的代谢过程和最终代谢产物、最终代谢产物是否会产生二次污染、如何减少和分解其在农产品中的残留、长期使用是否会是病菌或其他微生物产生抗性、在动植物体内残留对它们的细胞或整体的影响机制等。
43卷3期 魏中华等 国内多菌灵的研究进展
参考文献
[1] 王穿才.农药概论[M].北京:中国农业大学出版社,2009:134.
[2] 徐瑞福,将学杰,张玉泉,等.多菌灵对土壤微生物呼吸作用的影响[J].河南农业科学,2005(8):66-68.
[3] 徐晓锋,李娜,刘开楼,等,多菌灵对Cu污染土壤酶活性和微生物氮含量的影响[J].西北农业学报,2010,19(1):60-63.
[4] 肖丽,冯燕燕,周川,等.多菌灵对土壤细菌遗传多样性的影响[J].新疆农业科学,2011,48(9):1640-1648.
[5] 徐宝才,岳永德,胡颖慧,等.多菌灵的光化学降解研究[J].环境学报报,2000(5):617-620.
[6] 李霖,王君,李俊,等.杀菌剂多菌灵对草履虫的毒性研究[J].江苏农业科学,2010(5):493-494.
[7] 匡静,王建新,周明国,江苏省油菜菌核病对多灵菌和菌核净的抗药性监测[J].中国农学通报,2011,27(15):285-291.
[8] 游子涵,陈智东,刘训才,等.油菜植株及其土壤中多菌灵残留检测及动态[J].农药,2006,45(8):552-553.
[9] 张玉婷,郭永泽,刘磊,等.50%多菌灵WP在小麦和土壤中残留动态研究[J].天津农业科学,2007,13(4):52-54.
[10] 刘双双,杨仁斌,陈海平,等.多菌灵在水稻及土壤中的消解动态和残留规律研究[J].农业环境科学报,2011,31(2):357-361.
[11] 李海飞,聂继云,徐国锋,等.多菌灵在柑橘、香蕉和芒果储藏期的降解残留[J].江苏农业学报,2010(2):416-418.
[12] 张浩,王岩,逯忠斌,等.40%多菌灵SC在大豆和土壤中的残留动态[J].农药,2006(10):695-696.
[13] 陈伟,刘红彦,范芳婷,等.芝麻中甲基硫菌灵及代谢物多菌灵残留测定及安全性评价[J].农药,2011,50(12):911.
[14] 董爱军,楊鑫,马莺,等.食用菌中多菌灵残留的分散固相萃取 高效液相色谱法测定[J].分析测试学报,2010,29(6):573-577.
[15] 刘晓松,郑玲,黄文雯,等.浓缩果汁中甲基硫菌灵、2氨基苯并咪唑、多菌灵、噻菌灵及5羟基噻菌灵残留量的液相色谱-串联质谱法测定[J].分析测试学报,2013,32(1):86-88.
[16] 郑志琴,魏朝俊,张志勇,等.多菌灵在草莓与土壤中的残留动态研究[J].农业环境科学学报,2010,29(10):1948-1952.
[17] 张念洁,吴信子,姜旭.高效液相色谱法同时测定人参中多菌灵和甲基硫菌灵农药残留的含量[J].现代食品科技,2013,29(4):907-910.
[18] 胡梅,王骏,张卉,等.超高效液相色谱-串联质谱测定蒜苔中多菌灵和噻菌灵的残留量[J].山东农业科学,2010(4):89-91.
[19] 杨媛,石磊,李文生,等.高效液相色谱法测定苹果中多菌灵残留量的测量不确定度分析[J].农药学报,2010,12(3):349-354.
[20] 吴加伦,王天玉,王怀昌,等,高效液相色谱法测定元参、黄芩和杭白菊中的多菌灵残留[J].农药学学报,2010,12(4):489-493.
[21] 白桂芬,王强.多菌灵对蚯蚓体内几种抗氧化酶活性的影响[J].河南农业科学,2013,42(9):83-86.
[22] 于功昌,谢琳,刘衍忠.多菌灵对大鼠睾丸发育和生精功能影响的研究[J].中国男科学杂志,2009,15(6):505-510.
[23] 郑航,郑新民,李世文,等.Bcl2/Bax基因表达对隐睾生殖细胞凋亡的影响[J]中国男科杂志,2001,14(20):81-82.
[24] Scientific Committee on Plants,Preliminary opinion of the scientific committee on plants regarding the evaluation of benomyl,carbendazim and thiophanatemethyl in the context of council directive 91/414/EEC concerning the placing of the plant protection products on the market[R].2000.
[25] FLEER J R,LACY H M.Photolysis of methyl2benzimidazolecarbamate[J].J Agric Food Clem,1997,25:51.
[26] 朱凤晓,孔洁,由焦化,等.高效复合菌对多菌灵的生物降解[J].环境科学学报,2011,31(5):1045-1050.
[27] 王秀国,王一奇,严虎,等.多菌灵重复施药对持久性即土壤微生物群落功能多样性的影响[J].土壤学报,2010,47(1):131-135.
