粤北鹰嘴桃流胶病的病原全型特征分析
2015-10-21李夏李文英孙丽丽徐培智卢钰升
李夏 李文英 孙丽丽 徐培智 卢钰升


摘 要 鹰嘴桃是粤北地区重要的优稀水果,具有重要的经济价值和社会效益,但流胶病的发生危害严重影响地方产业的可持续发展。对粤北主要种植区鹰嘴桃流胶病病害进行调查研究,根据全型形态特征、培养特性、ITS及EF1-α序列分析,将鹰嘴桃流胶病的病原鉴定为葡萄座腔菌[Botryosphaeria dothidea(Moug. in Fr.)Ces. & De Not],证实该病菌有性态与无性态的关联,并对鹰嘴桃流胶病的致病因子进行分析与探讨,为该病害的防治提供重要的科学依据。
关键词 九仙桃;流胶病;葡萄座腔菌属;全型特征;序列分析
中图分类号 S662.1 文献标识码 A
Abstract Olecranon peach is one of the rare and excellent fruits with economic significance and social benefits in northern Guangdong. The occurrence of gummosis severely affects the sustainable development of local fruit industry. The aim is to reveal the pathogen causing olecranon peach gummosis in the main planting areas of northern Guangdong. Based on holo morphological characteristics on nature host, artificial culture, ITS as well as EF1-α sequence data, the pathogen was identified as Botryosphaeria dothidea(Moug. in Fr.)Ces. & De Not, the anamorph-teleomorph connection of the fungus was confirmed and the pathogenic factors of olecranon peach gummosis were analyzed and discussed. The results would provide some scientific insights for the prevention and control of gummosis. The related specimens and strains material were stored in the Center of Microbial Resources, Guangdong Academy of Agricultural Sciences(CMR-GAAS).
Key words Nine fairy peach;Gummosis;Botryoshpaeria;Holomorphological characteristics;Sequence analysis
doi 10.3969/j.issn.1000-2561.2015.11.026
鷹嘴桃(Olecranon peach),因果型尾部似鹰嘴而得名,又因产于“中国九仙桃之乡”翁源县江尾镇九仙村而得名九仙桃,属中国南方硬肉桃品系,因其果大核小、肉质爽脆、风味独特广受人们的喜爱,是广东北部地区传统的特色水果。1985年被评为广东省优稀水果品种[1],2007年通过无公害食品认证,享有“仙桃”、“岭南佳果”之美誉。目前,鹰嘴桃已成为粤北地区连平、翁源等地的农业主导产业之一。
近年来,鹰嘴桃种植区病害频发,其中以流胶病危害最为严重,主要为害果树主干、主枝、枝条等,引起果实流胶,甚至直接导致鹰嘴桃落果、绝收,流胶严重时导致树体死亡,该病害的普遍发生已成为制约粤北地区鹰嘴桃产业可持续发展的主要因素。但迄今为止,对引起粤北地区鹰嘴桃产区流胶病的主要病原菌种类的研究尚未见报道,本研究采用经典形态学特征鉴定方法及分子生物学方法对引起鹰嘴桃流胶病的病原菌进行鉴定,分析其致病因子,为防控流胶病的发生和危害提供科学信息。
1 材料与方法
1.1 材料
标本及菌株材料:鹰嘴桃流胶病发病枝条标本,采自翁源县鹰嘴桃种植区。
供试菌株:均分离自新鲜标本材料。
供试培养基:马铃薯葡萄糖琼脂培养基(PDA)。
主要试剂:柱式真菌基因组DNA抽提试剂盒购自上海生工生物公司;引物ITS5和ITS4、引物EF1-728F和EF1-986R由上海立菲公司合成;PCR扩增所用试剂购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 病害标本采集及症状观察 2014年4月下旬,对广东省翁源县鹰嘴桃主要种植区发生的真菌病害进行调查,并采集具有典型流胶病症状的新鲜病害标本带回实验室镜检及病原分离;新鲜病害标本在体视显微镜下观察外形特征并记录拍照(SteREO Lumar.V12, ZEISS, Germany)。
1.2.2 病原菌分离及培养性状观察 在无菌条件下,从枝干上的病原菌子实体生长部位按单孢分离法[2],对病原菌进行分离和多次纯化后,获得纯培养菌株,分别接种于马铃薯葡萄糖琼脂培养基(PDA)上,26 ℃恒温培养,观察记录菌落特征及其生长特性。相关标本和菌株材料保存于广东省农业科学院农业资源与环境研究所微生物资源中心(CMR-GAAS,Center of Microbial Resources,Guangdong Academy of Agricultural Sciences)。
1.2.3 病原菌形态特征观察 选取发病枝条上的子实体生长部位,采用冷冻切片机(HM560,MICROM;Germany)切片,切片厚度为6~8 μm。选取理想切片在光学显微镜(Zeiss AxioScope A1microscope; Germany)下进行形态观察及显微拍照,记录子囊座及分生孢子器的形态特征;挑取成熟的子囊座及分生孢子器浸入水中并将其在载玻片上压碎,释放出内容物,光学显微镜下观察并记录子囊、子囊孢子、分生孢子产孢结构和分生孢子等的形态特征。所观察记录的形态结构依照Phillips等[2]的描述,中文学名和术语参照菌物学概论[3]和Ridgway[4]的比色表进行描述。
1.2.4 病原菌的致病性测定 通过实验室鹰嘴桃树枝条接种试验,对病害枝条标本分离得到的菌株进行致病性测定。
致病性测定采用伤口接种法[5]:将分离纯化后的菌株培养物接种于PDA平板上,在26 ℃黑暗培养4 d后,用4 mm灭菌打孔器在PDA平板菌落边缘切取菌饼。用无菌手术刀片将鹰嘴桃主枝条刮伤,木质部伤口为4 mm左右,然后将菌饼菌丝面朝伤口处贴紧,重新将切口处树皮贴回菌饼。每个菌株接种2处,同时接种空白的PDA培养基块各2处作为对照。每天观察并记录枝条的发病情况。待接种后的枝条发病后,按照柯赫氏法则,重新分离纯化,观察所得分离物与接种菌是否相同,并测序鉴定。
1.2.5 病原菌DNA的提取 采用真菌基因组DNA抽提试剂盒(Sangon Biotech)提取菌株培养物基因组DNA,通过1%琼脂糖凝胶电泳检测DNA,并于4 ℃保存。
1.2.6 ITS及EF1-α片段扩增、测序及序列分析 采用ITS通用引物ITS5(5′-GGAAGTAAA AGTCGTAACAAGG-3′)和ITS4(5′-TCCTCCGCT TATTGATATGC-3′)扩增ITS1-5.8S-ITS2片段,反应体系为25 μL;反应条件为:95 ℃预变性5 min,94 ℃ 变性30 s、55 ℃退火30 s、72 ℃延伸60 s、35个循环,72 ℃延伸5 min,4 ℃保存[6];采用引物EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)和EF1-986R(5′-TACTTGAAGGAACCCTTACC-3′)扩增EF1-α片段,反应体系为25 μL;反应条件为:94 ℃预变性2 min,94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸60 s、40个循环,72 ℃延伸7 min,4 ℃保存[7];经1%琼脂糖凝胶电泳检测PCR产物。PCR扩增产物送华大基因(北京)进行DNA序列测定。
1.2.7 序列比对分析 将获得的ITS及EF1-α序列与GenBank中的已有相关序列进行同源性比较,分析分离菌株的分类地位。
2 结果与分析
2.1 病原菌的形态特征
共采集新鲜真菌标本21份,其中9份是鹰嘴桃病害枝条标本,CMR0158及CMR0173为主要研究材料,从这2个病害枝条标本的子实体部位分离得到2株菌株,菌株编号分别为Bd0158及Bd0173,具体信息如下。
标本编号:CMR0158及CMR0173。
菌株编号:无性阶段菌株Bd0158及有性阶段菌株Bd0173。
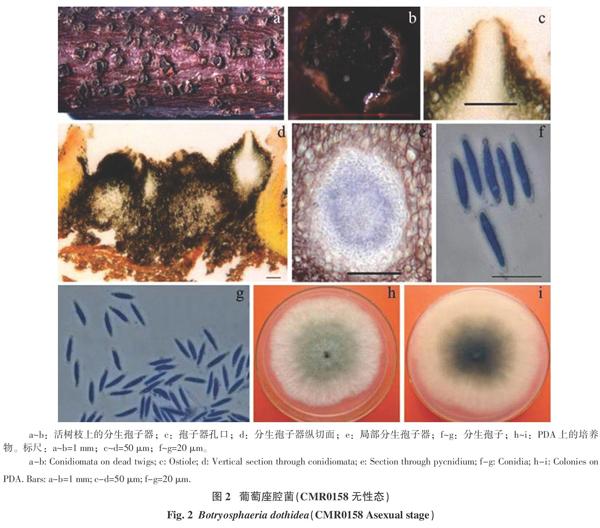
寄主及危害特征:鹰嘴桃树干或枝条上生,鹰嘴桃枝上初期皮孔溢出黄色凝胶状体(图1-l),后期通常为黑色突起的斑点或者是半埋生在树皮内的黑点为子实体形成阶段(图1-a, b;图2-a, b)。
采集地点:广东翁源青云山,经纬度N24°14′30",E114°07′50",海拔1 246 m。
采集人:李文英、孙丽丽。
采集时间:2014年4月30日。
有性态特征:子囊座最初埋生,后期突破表皮暴露于外,多聚生于共同的子座上,棕色至黑色,大多为多腔;包被一般为2层,外层通常由深棕色至棕色的角状厚壁细胞组成,内层由浅棕色或无色角状细胞组成;子囊腔球形至近球形,顶部中央具发育完全的乳突状孔口,具缘丝,单腔直径266.8~294.6 μm;子囊腔内产生子实层,拟侧丝无色,具隔,少分枝;子囊双壁,棍棒状,具短柄和明显顶室,囊内8个子囊孢子呈叠瓦状排列,65.2~120.4 μm×16.3~22.2 μm;子囊孢子拟纺锤形至卵形,孢子长宽比约为3.22,单胞无色,壁薄光滑,具颗粒状内容物,20.2~26.4 μm×7.3~9.5 μm(图1)。有性特征与葡萄座腔菌[Botryosphaeria dothidea (Moug. in Fr.) Ces. & De Not]一致[7]。
无性态特征:分生孢子果为分生孢子器,通常与子囊座形态相似,常生于同一子座内,单生或多生,棕色至黑色,单腔或多腔;包被一般为2层,外层通常由深棕色至棕色的角状厚壁细胞组成,内层由浅色或无色角状细胞组成;分生孢子器球形至近球形,分生孢子梗自分生孢子器的内壁产生,近圆柱形,无色,壁平滑;分生孢子长纺锤形,无色无隔,薄壁,具颗粒状内容物,两端略窄钝圆,22.3~28.1 μm×4.1~5.3 μm(图2)。无性特征与Slippers等[8]描述的“七叶树壳梭孢(Fusicoccum aesculi Corda)”特征一致。
2.2 病原菌的培养性状
在26 ℃恒温条件下,培养3 d时菌落直径达60 mm,菌落早期正面白色、棉絮状、边缘不规则,背面白色;培养5 d时菌落直径即达80 mm,菌落边缘灰白色且不规则锯齿状,正面中心深灰色、棉絮狀,背面边缘灰色、中心浅绿色至深绿色(图1-m, n;图2-h, i)。培养15 d 后,培养物上出现散生黑色颗粒状物,为子囊座或分生孢子器的雏形分化物。菌落特征和培养特性与B. dothidea相符[2]。
2.3 病原菌致病性
选用无性阶段菌株Bd0158及有性阶段菌株Bd0173,以伤口接种法对鹰嘴桃健康枝条进行致病性测定。结果表明,鹰嘴桃枝条接种处5 d左右开始出现轮纹状凹陷,并向周围扩展;8 d后伤口接种处开始出现黄色胶体,凹陷更明显;有性阶段菌株Bd0173接种处比无性阶段菌株Bd0158接种处流胶更为严重,且凹陷更明显。在同样情况下,仅接种无菌PDA块的对照枝条,10 d后伤口处未出现发病症状,更无流胶现象。取接种后的枝条病健交界处组织分离、纯化,所分离获得的菌株均与原接种菌株的菌落形态完全一致,经过测序及同源性比较,重分离得到的菌株为葡萄座腔菌(Botryosphaeria dothidea),因此,可推断B. dothidea是鹰嘴桃流胶病的病原菌。
2.4 病原菌的特征序列分析
用引物ITS5/ITS4从菌株Bd0158、Bd0173的基因组DNA中均扩增出一条约为500 bp的片段,用引物EF1-728F/EF1-986R均扩增得到一条约为300 bp的片段,通过GenBank(NCBI)Megablast搜索同源序列比对分析。结果表明,用引物ITS5/ITS4扩增得到的序列与B. dothidea模式菌株CMW 8000的AY236949的ITS序列同源性均为100%;用引物EF1-728F/EF1-986R扩增得到的序列与B. dothidea菌株WH-51的HQ660483的EF1-α序列同源性均为100%,与前述有性态形态特征的鉴定结果一致[8]。
2.5 病原菌的分类鉴定分析
根据病原菌的显微形态特征,病原初步鉴定有性阶段菌株Bd0173为Botryosphaeria dothidea,无性阶段菌株Bd0158为Fusicoccum aesculi,2个菌株的培养特性及ITS 和EF1-α序列同源性比对结果表明,菌株Bd0158及Bd0173均属于Botryosphaeria dothidea,进一步证实Fusicoccum aesculi 为Botryosphaeria dothidea 的无性态。根据最新的《国际藻类,真菌及植物命名法则》[9]和阿姆斯特丹宣言[10]的要求及提议,采用“一种真菌,一个名称”的最新分类命名方法,参照Phillips等[2]的观点和描述,无性阶段的Fusicoccum aesculi为Botryosphaeria dothidea的异名,进一步证实其有性阶段和无性阶段的关联。
根据病原菌的形态特征、培养特性、ITS及EF1-α序列同源性比对结果, 将引起鹰嘴桃流胶病的病原鉴定为葡萄座腔菌[Botryosphaeria dothidea(Moug. in Fr.)Ces. & De Not]。按照最新分类系统[11],隶属于子囊菌门(Ascomycota)、 座囊菌纲(Dothideomycetes)、葡萄座腔菌目(Botryosphaeriales)、葡萄座腔菌科(Botryosphaericeae )。
3 讨论与结论
流胶病是桃树乃至核果类果树的一种重要病害,在全国乃至全球各地广泛发生,中国南方主要发生在桃树、李树、樱桃、柠檬、柑桔产区,严重影响各地种植区的产业发展[12-13]。流胶病因其典型症状均为流胶而得名,但其致病因子复杂多样,国内外一些研究者认为流胶病是由真菌引起的传染性病害,或为病理性,或为生理性,或二者兼之,同时受地理环境、气候因素及年降雨量的影响较大,不同果树品种其流胶病的致病因子也有所不同[14-16]。因此,查明引起流胶的起始因子及致病病菌对防治流胶病十分关键。
鹰嘴桃是粤北地区重要的优稀水果,具有重要的经济价值和社会效益,近年来主要种植区病害频发,主要病害有流胶病、根癌病、炭疽病、霜霉病等,其中流胶病的严重危害成为影响地方产业可持续发展的主要因素。本研究对粤北主要种植区鹰嘴桃流胶病病害进行初步调查研究,结合全型形态学特征、rDNA-ITS 及EF1序列分析,将鹰嘴桃流胶病的病原鉴定为B. dothidea。
鹰嘴桃流胶病的病原鉴定结果与前人研究报道的桃树流胶病的主要病原基本一致。近年来,常有结合形态学特征及分子系统学方法对桃树流胶病的研究报道,张勇等[17]认为山东桃树流胶病由B. dothidea引起;Wang等[18]报道引起桃流胶病病原主要是葡萄座腔菌类真菌(Botryosphaeriaceous fungi),主要包括3个种,分别为Botryosphaeria dothidea、Diplodia seriata和Lasiodiplodia theobromae,其中以B. dothidea分布最廣,且致病力最强;万保雄[19]认为广西地区油桃、毛桃流胶病由B. dothidea引起,其发生与树体营养、夏季高温、年降雨量等因素相关。总之,B. dothidea为引起桃树流胶病的主要真菌病原种类之一。
B. dothidea是一种常见的植物病原真菌,引起的果树流胶病是世界性的真菌病害,严重危害水果品质及产业发展。本研究首次系统报道了B. dothidea在粤北鹰嘴桃上的病菌全型形态特征和详细培养特性,又一次证实其有性世代与无性世代的关联,为流胶病的病原侵染和病害循环机制研究及防治策略制定提供一定的科学信息。针对鹰嘴桃流胶病在高温高湿的华南地区致病因子复杂多样且难以控制等现状,应对该病原菌的生物学特性、生态环境影响因子、抑菌措施筛选等方面开展进一步工作,从而为更好地防控流胶病提供理论依据和技术支撑。
致谢:在此文完成过程中,农业生物基因研究中心陈中健博士、吴秀菊女士、张卫娜女士提供显微切片摄影技术帮助,本单位唐明灯博士、李林峰博士及李义纯博士提供致病性试验材料,特此致谢。
参考文献
[1]张利添, 严添安, 叶永群, 等. 鹰嘴桃生物学特性与栽培技术研究[J]. 中国南方果树, 2007, 36(4): 53-54.
[2] Phillips A J L, Alves A, Abdollahzadeh J, et al. The Botryosp
haeriaceae: genera and species known from culture[J]. Mycology, 2013, 76(1): 51-167.
[3] 姚一建, 李 玉. 菌物學概论(第四版)[M]. 北京: 中国农业出版社, 2002.
[4] Ridgway R. Color Standards and Color Nomenclature[M]. Washington D. C.:Publish by Theauthor, 1912: 89-140.
[5] 方中达. 植病研究方法(第三版)[M]. 北京:中国农业出版社,2007.
[6] Yan J Y, Xie Y, Zhang W, et al. Species of Botryosphaeriaceae involved in grapevine dieback[J]. Fungal Diversity, 2013, 61(2): 221-236.
[7] Pavlic D, Slippers B, Coutinho T A, et al. Multiple gene genealogies and phenotypic data reveal cryptic species of the Botryosphaeriaceae: A case study on the Neofusicoccum parvum/N. ribis complex[J]. Molecular Phylogenetics and Evolution, 2009, 51(2): 259-268.
[8] Slippers B, Crous P W, Denman S, et al. Combined multiple gene genealogies and phenotypic characters differentiate several species previously identified as Botryosphaeria dothidea[J]. Mycologia, 2004, 96(1): 83-101.
[9] McNeill J, Barrie F R, Buck W R, et al. International Code of Nomenclature for algae,fungi,and plants(Melbourne Code)[M]//Adopted by the Eighteenth International Botanical Congress Melbourne. Bratislava: International Association for Plant Taxonomy, 2012.
[10] Hawksworth D L, Crous P W, Redhead S A, et al. The Amsterdam declaration on fungal nomenclature[J]. IMA Fungus:The Global Mycological Journal, 2011, 2(1): 105.
[11] Slippers B, Boissin E, Phillips A J L, et al. Phylogenetic lineages in the Botryosphaeriales: a systematic and evolutionary framework[J]. Study in Mycology, 2013, 76(1): 31-49.
[12] 马瑞娟, 俞明亮, 杜 平, 等. 桃流胶病研究进展[J]. 果树学报, 2002, 19(4): 262-264.
[13] 谢思慧, 李宪利, 高东升, 等. 核果类果树流胶病研究进展[J]. 安徽农业科学, 2008, 36(5): 1 932-1 935.
[14] Weaver D J. A gummosis disease of peach trees caused by Botryosphaeria dothidea[J]. Phytopathology, 1974, 64(8): 1 429-1 432.
[15] 陈祥照. 桃树流胶病的研究[J]. 植物病理学报, 1985, 15(1):53-57.
[16] 罗江会. 桃流胶病的发生及其病原菌研究[D]. 重庆: 西南大学, 2006.
[17] 张 勇, 李晓军, 曲健禄, 等. 山东桃树流胶病病原菌研究[J]. 果树学报, 2010, 27(6): 965-968.
[18] Wang F, Zhao L N, Li G H. Identification and characterization of Botryosphaeria spp. causing Gummosis of peach trees in Hubei Province, Central China[J]. Plant Disease, 2011, 95(11): 1 378-1 384.
[19] 万保雄. 广西桃流胶病发生规律及主要影响因子研究[D]. 南宁: 广西大学, 2014.
