后肾腺瘤的临床、病理和MRI表现(附2例报道并文献复习)
2015-10-17贺新华丁玉芹黄健峰缪熙音罗荣奎曹颖丽周建军曾蒙苏
贺新华,丁玉芹,黄健峰,缪熙音,罗荣奎,曹颖丽,周建军,曾蒙苏
(1.江苏省如皋市人民医院影像科,江苏 如皋 226500;2.复旦大学附属中山医院,上海 200032)
后肾腺瘤的临床、病理和MRI表现(附2例报道并文献复习)
贺新华1,丁玉芹2,黄健峰2,缪熙音2,罗荣奎2,曹颖丽2,周建军2,曾蒙苏2
(1.江苏省如皋市人民医院影像科,江苏 如皋226500;2.复旦大学附属中山医院,上海200032)
目的:探讨后肾腺瘤(MA)的临床、病理和MRI表现,提高对MA的诊断水平。方法:回顾性分析2例经病理证实的MA患者的临床、病理及MRI资料,结合相关文献进行分析和总结。结果:本组2例MA患者均为女性,均表现为单侧肾脏实质性肿块,T1WI肿瘤实质部分信号与肾皮质相仿,T2WI为等信号和略低信号,DWI均为明显高信号,1例瘤内可见出血、坏死、囊变、钙化和假包膜,信号不均匀,另1例瘤内可见中心瘢痕,除瘢痕外肿瘤信号较均匀,增强后1例表现为中度不均匀延迟强化,另1例表现为“快进快出”的强化方式。病理学特点:肿瘤细胞非常丰富,排列紧密,常可形成肾小球样或花蕾状结构,常见砂粒体形成。免疫组化常见WT-1、CD57阳性,EMA和AMACR阴性。结论:MA典型的MRI表现为T1WI和T2WI低或等信号,DWI明显高信号,瘤内常见出血、坏死,部分伴有囊变和钙化,信号不均匀,边界清晰,有或无假包膜,增强后病灶呈轻中度持续性或渐进性强化。因其MRI表现形式多样,最终诊断依赖于病理学检查。
肾肿瘤;腺瘤;磁共振成像
后肾腺瘤(MA)是一种罕见的肾脏原发性良性肿瘤,来源于肾胚胎发育过程中的残留组织,约占成人肾脏上皮源性肿瘤的0.2%。国内外文献至今报道仅200余例,有关其MRI表现的报道更少,术前临床及影像学检查多误诊为肾癌。笔者搜集上海中山医院经手术病理证实的2例MA,并复习相关文献,旨在探讨MA的MRI表现及其病理学基础,提高对该病的诊断水平。
1 病例
例1,女,41岁,因“体检发现左肾肿块10余天”入院,外院体检腹部超声发现左肾肿块,于2010年9月13日来中山医院拟行手术治疗。体格检查及实验室检查未见明显异常。彩色多普勒超声检查左肾上极可见一个大小约52 mm× 49mm中等回声肿块,CDFI见线状彩色血流,RI=0.73。MRI检查左肾上极见一类圆形软组织团块影,大小约55mm× 64mm,T2WI肿瘤实质部分呈等信号,周围可见线状环形低信号假包膜 (图1a),DWI以高信号为主 (图1b),ADC值约1.4×10-3mm2/s(b值=500)。脂肪抑制T1WI肿瘤实质部分的信号与肾皮质相仿,肿瘤内可见出血、坏死、囊变和钙化,信号不均匀 (图1c)。增强后皮髓质交界期病灶呈轻度强化 (图1d),肾实质期进一步延迟强化,呈混杂高信号,强化方式为渐进性强化(图1e)。超声和MRI均诊断为肾癌,患者于2010 年9月15日行根治性左肾切除术。术后大体标本于左肾上极可见一个直径为6 cm的灰白色肿块,肿块中见散在出血,质地稍脆,肿瘤四周界限清楚。显微镜下(图1f)可见肿瘤细胞弥漫分布,排列为小管状结构,并可见散在灶性乳头状结构,细胞异型不明显,核仁不明显,核分裂相不易找到,肿瘤细胞胞浆量少,肿瘤间质为玻璃样变间质,无明显间质细胞,肿瘤周围为增厚纤维包膜,病理诊断为后肾腺瘤。免疫组化:VIM(+),CK广(+),CK8(+),WT-1(+),KI67(约2%+),EMA(少数+),P504S(少数+),CD10(-),CD57(-),CK7(-),CAM5.2(-),E-cad(-),RCC(-),BerEP-4(-),TG(-)。
例2,女,50岁,患者6月前出现腰酸、腰痛,伴血尿,当时未予重视。5天前因头痛、右下腹痛至当地医院检查,腹部CT发现左肾占位,于2013年1月18日收入上海中山医院。彩色多普勒超声检查:左肾上极可见一个大小约24mm× 21mm类圆形低回声团块,CDFI周边见少量彩色血流,RI= 0.63,肾盂分离(-)。超声造影:注射造影剂声诺维后,左肾病灶20 s开始增强,晚于肾实质,缓慢向内增强,26 s达峰值,强度低于肾实质,33 s开始减退,快于肾实质,超声诊断:左肾乳头状或嫌色细胞型肾癌可能。MRI检查:左肾上极见一类圆形软组织肿块影,大小约23.8mm×21.9mm,T2WI上肿瘤信号略低于肾实质,中央可见星芒状稍高信号瘢痕影(图2a),DWI呈明显高信号 (图2b),ADC值约1.0×10-3mm2/s(b 值=500),脂肪抑制T1WI上肿瘤信号与肾皮质相仿(图2c),增强后皮髓质交界期病灶中度强化(图2d),肾实质期病灶呈相对低信号,中央可见强化的星芒状瘢痕影,强化方式为“快进快出”(图2e),病灶信号较均匀,边界清晰,未见假包膜形成,肾盂未见明显侵犯征象,MRI诊断左肾上极透明细胞癌。患者于2013年1月21日行左肾根治性切除术,大体标本左肾上极可见一个大小约30mm×25mm灰白色肿块,质嫩;显微镜下可见肿瘤呈小管状排列,细胞丰富,轻度异型,核分裂相约2个/10HPF;免疫组化VIM(+),CK广(80%+~++),WT-1(100%+~++),CD34(血管+),Leu-7(100%+~++),KI67(5%阳性),CK8(90%++),CK18(++),CD10(-),EMA(-),CK7 (-),病理诊断为后肾腺瘤。


图145岁,左肾上极后肾腺瘤。图1a:T2WI肿瘤实质部分呈等信号,可见假包膜(黑箭头)和囊变(白箭头);图1b:DWI以高信号为主,ADC值约1.4×10-3mm2/s(b值=500);图1c:脂肪抑制T1WI肿瘤实质部分呈等信号,瘤内可见出血、坏死、囊变和钙化,信号不均匀;图1d:增强后皮髓质期轻度强化;图1e:肾实质期进一步强化,呈混杂高信号;图1f:肿瘤细胞呈腺泡状排列,部分区肿瘤细胞呈乳头样突向腺泡内,似肾小球结构(HE)。
Figure 1.Case one,45-year-old female with metanephric adenoma in the upper pole of left kidney.Figure 1a:The solid component of the tumor showed iso-intensity on T2weighted imaging.Pseudocapsule(black arrow)and cystic degeneration(white arrow)were visible;Figure 1b:The major part of the lesion showed high signal intensity on diffusion weighted imaging and the apparent diffusion coefficient value was about 1.4×10-3mm2/s(b value=500);Figure 1c:The solid component of the tumor showed iso-intensity on fat-suppressed T1weighted imaging,and the signal intensity was heterogeneous owing to hemorrhage,necrosis,cystic degeneration and calcification within the tumor;The lesion demonstrated mild enhancement on the corticomedullary phase (Figure 1d)and prolonged enhancement with heterogeneous signal intensity on the parenchymal phase(Figure 1e);Figure 1f:Tumor cells were arranged in an acinar-like structure.Some cells formed a papillary component with an invagination of the tumor into its lumen to produce a glomeruloid appearance(HE staining).
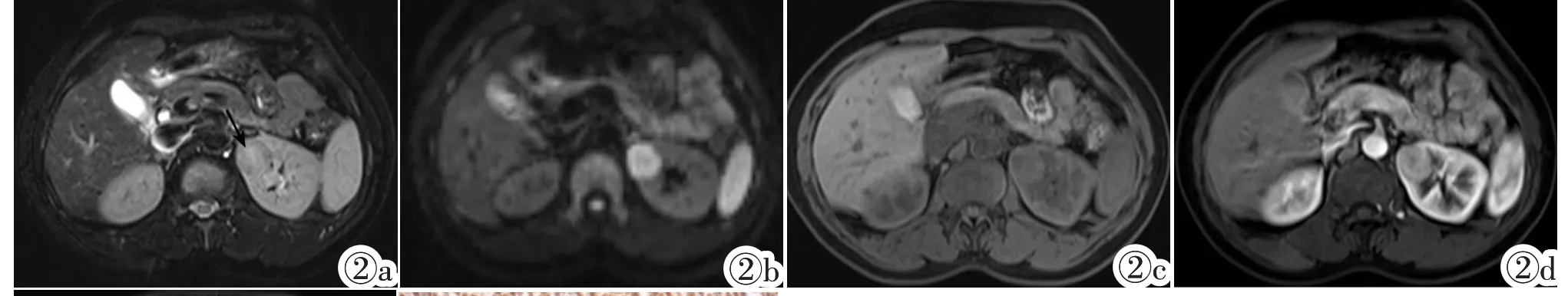
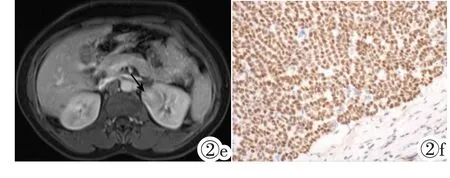
图2例2,女,50岁,左肾后肾腺瘤。图2a:T2WI为略低信号,中央可%见星芒状稍高信号(箭头);图2b:DWI为明显高信号,ADC值约1.0× 10-3mm2/s(b值=500);图2c:T1WI肿瘤信号与肾皮质相仿;图2d:增强后皮髓质交界期中度强化;图2e:肾实质期病灶呈相对低信号,病灶中央见星芒状高信号(箭头),强化方式为“快进快出”;图2f:肿瘤细胞非常丰富,排列紧密,免疫组化WT-1弥漫阳性(EnVision)。
Figure 2.Case two,50-year-old female with metanephric adenoma in the left kidney.Figure 2a:The lesion demonstrated slightly lower signal intensity with central stellate high signal intensity on T2weighted imaging(arrow).Figure 2b:Diffusion weighted imaging showed significantly high signal intensity with an approximately apparent diffusion coefficient value of 1.0×10-3mm2/s(b value=500).Figure 2c:The signal intensity was similar to the renal cortex on T1weighted imaging.Figure 2d:The lesion showed moderate enhancement on the corticomedullary phase and relatively low signal intensity with central stellate high signal intensity(arrow)on the parenchyma phase,demonstrating a wash-in and wash-out enhancement pattern(Figure 2e).Figure 2f:Tumor cells were numerous,tightly packed and diffusely positive of WT-1 on immunohistochemistry examination(EnVision).
2 讨论
2.1概述
MA是来源于后肾残余组织的一种罕见的肾脏原发性良性肿瘤,由Bove等[1]于1979年首次描述,1992年Brisigotti等[2]提议用MA命名,并认为其可能为Wilm's瘤的良性对应体。2004年WHO泌尿系统肿瘤分类中将MA扩展为后肾源性肿瘤,代表了在组织发生和肿瘤性质上相似的一组肾脏良性肿瘤,包括MA、后肾腺纤维瘤 (MAF)和后肾间质瘤(MST)[3-4]。MA完全由上皮细胞构成,MST完全由间质细胞构成,MAF由混合性上皮-间质细胞构成的双相性肿瘤。
目前,MA的病因仍然不明,可发生于任何年龄,多为成年女性患者,平均年龄41岁(5~83岁),女∶男>2。40%的患者为偶然发现,少数患者可出现腹痛或者腰痛(22%),肉眼或镜下血尿(10%),扪及肿块及尿路感染等症状。MA是所有肾脏肿瘤中出现红细胞增多症最高的肿瘤,约占12%[5],这可能与MA细胞可产生促红细胞生成素和其它类型的细胞因子(GM-CSF,G-CSF,IL-6,IL-8)有关[6]。本组2例患者均为中年女性,但血常规正常,与文献报道不符,这可能与病例数太少有关。
绝大多数文献认为MA是一种良性肿瘤,临床上治疗多采用根治性肾切除术或保留肾单位的部分性肾切除术。然而,文献报道过1例7岁女孩左肾典型的MA伴有肾门、腹主动脉旁及分叉处淋巴结转移[7],11岁女孩MA中可见局灶性乳头状癌成分,同时伴有邻近淋巴结转移[8]。由于MA的生物学行为的不确定性和存在转移的潜能,术后应进行长期密切随访。本组2例MA患者术后随访至今,均未见局部复发和转移征象。
2.2病理学和免疫组化特征
MA好发于肾皮质区,直径从0.3~20 cm不等,平均5.5 cm。肿瘤边界清楚,可有或无包膜。切面呈灰黄、灰白、灰褐、灰红或粉红色,质硬或软,常见肿瘤中心区出血、坏死,约20%的肿瘤内有钙化,10%的肿瘤内有小囊腔[5]。
光镜下MA的肿瘤细胞非常丰富,排列紧密,瘤细胞较小而一致,无核仁或核仁不明显,细胞核比淋巴细胞略大,胞质少。瘤细胞无明显异型性,无或偶见核分裂象。常见砂粒体形成,可见透明变性瘢痕及骨化生。肿瘤细胞排列成腺泡或小管样,可形成乳头状结构、肾小球样或花蕾样结构[5],后两者因为在一些稍大的腔隙内细胞堆积排列呈球形团块,似新生儿肾小球,这两种结构是本病特有的组织结构,具有重要的诊断和鉴别诊断价值。
文献报道多数MA病例WT-1、CD57、AE1/AE3、CAM5.2 和Vimentin弥漫阳性,CD56、CK7局灶阳性,而NSE、CEA、CgA、Syn、EMA、actin、desmin和AMACR阴性[9]。
2.3MRI表现及其病理学基础
笔者将“后肾腺瘤”作为关键词,检索pubmed数据库和万方中文期刊数据库,共搜索到11篇报道中包含了18例MA的磁共振表现的描述[10-13],统计结果如下:MA在T1WI上呈等信号5例,低信号13例,T2WI上呈低信号9例,等信号2例,稍高或高信号4例,混杂信号3例,8例患者做了MRI增强检查,增强后均表现为轻度持续性或渐进性强化。本组2 例MA的肿瘤实质部分在T1WI上的信号与肾皮质相仿,T2WI上1例MA呈等信号,另1例呈略低信号,增强后均表现为中等程度强化,强化方式1例为渐进性强化,1例为“快进快出”,与文献报道不完全一致,说明其MRI表现的多样性,需要积累更多病例来总结其MRI表现的特征。
由于后肾腺瘤的病灶中心区容易出现出血、坏死、囊变,因此各序列上的信号多不均匀,肿瘤内出血随着时间的不同,MRI表现不一,亚急性期出血多表现为T1WI和T2WI均为斑片状高信号,慢性期出血由于含铁血黄素的沉积,可表现为T1WI和T2WI均为低信号,囊变区表现为长T1长T2信号。部分MA瘤体周围可见假包膜,在T2WI上表现为肿瘤边缘的环形线状低信号。假包膜多由于肿瘤组织生长缓慢,压迫周围正常的肾实质,导致肾小管坏死和纤维组织增生而成。MA内常见砂粒体形成和骨化生,在T1WI和T2WI上均表现为极低信号。本组例1的MRI表现符合MA典型的病理学和影像学特征,例2肿瘤中心区在T2WI和肾实质期上呈现星芒状略高信号,可能与MA发生透明变性、疤痕形成有关。
本组2例MA在DWI上均表现为明显高信号,ADC值分别为1.4×10-3mm2/s和1.0×10-3mm2/s(b=500),这可能与MA肿瘤细胞非常丰富,细胞排列紧密,其内水分子的布朗运动明显受限有关,笔者认为当发现肾脏占位在DWI上表现为明显高信号时,需要考虑MA的可能性。
2.4鉴别诊断
MA主要与肾癌、嗜酸细胞腺瘤和Wilm's瘤鉴别[14],本组2例术前均误诊为肾癌。少部分肾透明细胞癌由于病灶内出血T2WI表现为低信号,但增强后多表现为明显不均匀强化,而MA多为轻中度强化,容易鉴别;乳头状肾癌增强后表现为轻度延迟强化,瘤内出血、坏死、囊变多见,与MA鉴别困难,但乳头状肾癌比MA的T2WI的信号更低,其DWI信号多为稍高信号,而MA在DWI上表现为明显高信号;嫌色细胞肾癌和嗜酸细胞腺瘤的MRI表现相仿,除瘢痕外肿瘤实质部分的信号较MA均匀,强化程度较MA明显,鉴别相对容易;小儿MA需与肾母细胞瘤(又称Wilms瘤)鉴别,Wilms瘤是儿童期肾脏最常见的恶性肿瘤,发病年龄一般较小,而MA多见于成人,肾母细胞瘤典型MRI表现多为T2WI高信号,内有片状坏死区和出血,增强扫描肿瘤呈不均匀强化,可见肿瘤侵蚀、压迫肾脏,使残存肾实质呈新月形改变,肿块边缘不光整,肿瘤可向外侵犯,部分可伴有远处转移,而MA大多没有侵袭性。
综上所述,MA好发于中年女性患者,可伴有红细胞增多症。典型的MRI表现为T1WI和T2WI多为低信号,DWI为明显高信号,瘤内常见出血、坏死,部分伴有囊变和钙化,信号不均匀,病灶边界清晰,有或无假包膜,增强后肿瘤呈轻中度持续性或渐进性强化,因其MRI表现形式多样,最终诊断依赖于病理学检查。
[1]Bove KE,Bhathena D,Wyatt RJ,et al.Diffuse metanephric adenoma after in utero aspirin intoxication.A unique case of progressive renal failure[J].1979,103(4):187-190.
[2]Brisigotti M,Cozzutto C,Fabbretti G,et al.Metanephric adenoma [J].Histol Histopathol,1992,7(4):689-692.
[3]Arroyo MR,Green DM,Perlman EJ,et al.The spectrumof metanephric adenofibroma andrelatedlesions:clinicopathologic study of 25 cases from the National Wilms Tumor Study Group Pathology Center[J].Am J Surg Pathol,2001,25(4):433-444.
[4]Argani P,Beckwith JB.Metanephric stromal tumor:report of 31 cases of a distinctive pediatric renal neoplasm [J].Am J Surg Pathol,2000,24(7):917-926.
[5]Davis CJ,Barton JH,Sesterhenn IA,et al.Metanephric adenoma. Clinicopathological study of fifty patients[J].Am J Surg Pathol,1995,19(10):1101-1114.
[6]Yoshioka K,Miyakawa A,Ohno Y,et al.Production of erythropoietin and multiple cytokines by metanephric adenoma results in erythrocytosis[J].Pathol Int,2007,57(8):529-536.
[7]Renshaw AA,Freyer DR,Hammers YA.Metastatic metanephric adenoma in a child[J].Am J Surg Pathol,2000,24(4):570-574.
[8]Drut R,Drut RM,Ortolani C.Metastatic metanephric adenoma with foci of papillary carcinoma in a child:a combined histologic,immunohistochemical,and FISH study[J].Int J Surg Pathol,2001,9(3):241-247.
[9]Mantoan PM,Billis A,Allende D,et al.Metanephric adenoma and solid variant of papillary renal cell carcinoma:common and distinctive features[J].Histopathology,2013,62(6):941-953.
[10]Bastide C,Rambeaud JJ,Bach AM,et al.Metanephric adenoma of the kidney:clinical and radiological study of nine cases[J]. BJU Int,2009,103(11):1544-1548.
[11]Amodio JB,Shapiro E,Pinkney L,et al.Metanephric adenoma in an 8-year-old child:case report and review of the literature [J].J Pediatr Surg,2005,40(5):e25-e28.
[12]李清海,严福华,侯君.后肾腺瘤一例 [J].中华放射学杂志,2007,41(6):670-671.
[13]李亮,韩悦,夏庆来,等.后肾始基腺瘤的临床及影像学表现[J].中国临床医学影像杂志,2013,24(7):514-517.
[14]刘东锋,朱友志,胡勇,等.后肾腺瘤的临床、病理及影像学诊断[J].实用放射学杂志,2010,26(3):384-387.
Clinical,pathological and MRI findings of metanephric adenoma(report of two cases and literature review)
HE Xin-hua1,DING Yu-qin2,HUANG Jian-feng2,MIAO Xi-yin2,LUO Rong-kui2,CAO Ying-li2,ZHOU Jian-jun2,ZENG Meng-su2
(1.Department of Radiology,People's Hospital of Rugao City,Rugao Jiangsu 226500,China;2.Zhongshan Hospital,Fudan University,Shanghai 200032,China)
R737.11;R445.2
B
1008-1062(2015)01-0056-03
2014-05-27;
2014-07-22
贺新华(1972-),男,江苏如皋人,主治医师。
周建军,复旦大学附属中山医院放射科,200032。
