胃神经鞘瘤和间质瘤的多排CT表现及对照研究
2015-10-17徐慧新
徐慧新,徐 青
(南京医科大学第一附属医院放射科,江苏 南京 210029)
胃神经鞘瘤和间质瘤的多排CT表现及对照研究
徐慧新,徐青
(南京医科大学第一附属医院放射科,江苏 南京210029)
目的:探讨胃神经鞘瘤(GS)的CT表现,并与胃间质瘤(GST)进行对照分析,以提高诊断正确率。材料与方法:选取经手术病理证实的GS 19例及GST 76例,回顾性分析其临床特征及CT表现,并对两者的CT表现进行比较。CT影像资料由两名具有丰富经验的高年资放射科医师评估,评估内容包括肿瘤大小、形态、生长方式、增强模式、强化程度、肿瘤内部出血、钙化及坏死囊变。统计学分析采用单因素方差分析、LSD检验和卡方检验。结果:极低风险度GST的最大直径小于GS(P=0.04),低、中风险度间质瘤最大直径与胃肠道神经鞘瘤的最大直径没有统计学意义(P=0.98,P=0.23),高风险度间质瘤的最大直径大于GS(P=0.01)。GS(18/19)和极低(16/16)、低风险(28/34)及中风险(11/13)GST多呈圆形或卵圆形,而高风险GST(8/13)多呈分叶状或不规则形。极低风险GST腔内生长较多见(12/16)。GS(18/19)和极低危险度(15/16)GST肿瘤内部均匀强化。低(26/34)、中等(11/13)及高危险度GST(13/13)中等或明显强化较GS(9/19)多见。GS(1/18)内部的坏死囊变较低(11/34)、中等(6/13)及高危险度(11/13)间质瘤少见(P=0.01)。结论:胃肠道神经鞘瘤CT上多表现为圆形、卵圆形的肿块,增强后呈轻度均匀强化,肿瘤内部坏死囊变、钙化、出血现象较少见,与高危险度GST影像学表现差异较大,但与极低、低、中危险度GST较难区别。
胃肿瘤;神经鞘瘤;胃肠道间质肿瘤;体层摄影术,螺旋计算机
神经鞘瘤是神经鞘膜细胞发生的良性肿瘤,为最常见的外周神经良性肿瘤之一,但发生于消化道少见[1]。间质瘤是原发于胃肠道、大网膜和肠系膜的间质肿瘤,是消化道最常见的间叶源性肿瘤[2-3]。胃神经鞘瘤(GS)的临床表现及影像学表现与胃间质瘤(GST)极其相似,因而术前常被误诊为GST。笔者搜集了本院2010年9月—2014年5月19例经手术病理证实为GS的病例,分析其临床及CT表现并与本院2012年10月—2014年5月76例GST进行对比,旨在提高我们对GS的认识,提高诊断正确率。
1 材料及方法
1.1临床资料
GS 19例,其中男9例,女10例;年龄27~69岁,平均(54.2±10.6)岁。所有均为单发。临床症状:腹痛伴腹胀4例,单纯上腹不适3例,单纯上腹腹胀3例,上腹不适伴嗳气3例,纳差伴贫血1例,3例无任何症状体检偶然发现,2例因其他疾病常规CT检查发现。所有病例均经手术病理及免疫组化证实为良性神经鞘瘤。术前CT误诊为GIST有14例,胃平滑肌瘤3例,胃癌1例。
GST 76例,单发74例,多发2例,每例发生的个数均为2个,病灶其中极低危险度16例,低危险度34例,中危险度13例,高危险度13例。极低危险度病例,男6例,女10例,年龄33~69岁,平均(56± 9.9)岁,临床表现:6例上腹部疼痛不适,3例伴反酸、嗳气,1例伴腹泻,5例腹胀,1例因为胃良性溃疡行胃大部切除术中偶然发现。低危险度病例,男17例,女18例,年龄30~76岁,平均(59.2±13.8)岁,22例腹部疼痛不适,8例黑便,其中2例伴贫血,3例因为体检,B超查出腹部肿块,2例食欲减退、消瘦。中危险度病例,男4例,女9例,年龄35~77岁,平均(58.2±11.9)岁,6例腹部疼痛不适,4例黑便,2例常规体检,1例由于肺脓肿体检发现。高危险度病,男 9例,女 4例,年龄 16~75岁,平均(47.9± 17.2)岁。7例腹部疼痛不适,其中2例黑便,5例消瘦、贫血,1例由于饮酒后呕血发现。所有病例均经手术病理及免疫组织化学证实,GST术后病理分级参照2008年4月美国国立卫生研究院(NIH)修订的GIST切除后的风险分级。
1.2影像学检查
95例患者,19例GS及76例GST,均采用Siemens Emotion 64排螺旋CT机扫描。扫描参数:120 kV,160mAs,层厚5mm,层距1.5mm。检查前患者禁食4小时,空腹扫描。15例GS患者和76例GST患者口服500~1000mL水作为胃肠对比剂,剩余4例GS患者口服2%泛影葡胺。均行CT平扫及增强扫描,采用非离子型对比剂碘海醇(300mgI/mL),使用剂量为1.5mL/kg,注射流率为2.5~3mL/s,动脉期、门静脉期分别于注射对比剂后25~30 s、70~80s扫描。
1.3影像资料分析
19例胃肠道神经鞘瘤和76例GIST患者的CT图像,由两名工作超过6年的高年资放射科医师运用双盲法在PACS对图像进行观察分析:①测定肿瘤大小(以肿瘤最大径为标准);②观察肿瘤影像学表现,包括肿块的形状、内部结构(均匀、出血、坏死、钙化)、生长方式(腔内生长、腔外生长、腔内外生长)、增强模式(强化均匀、强化欠均匀)及强化程度(欠佳、中等、明显);增强后测定肿块内部的CT值,然后减平扫CT值,轻度强化定义为相同测量部位的CT值增加小于10HU,中度为HU<20~40HU,明显强化HU>40HU,在测定CT值时选取肿块均质部分,避开肿块内部坏死囊变、出血及钙化区域。
1.4统计学处理
采用统计学软件SPSS(Version 20.0)对胃肠道神经鞘瘤和GIST影像学观察指标进行单因素分析,计量资料使用单因素方差分析(one-way ANOVA)和LSD法检验,计数资料采用卡方检验。P<0.05为有统计学意义,P<0.01为有高度统计学意义。
2 结果
2.1CT表现
GS 19例中,均为单发病灶。肿瘤最大直径1.2~6.0 cm,平均(3.1±1.5)cm。平扫显示肿瘤均呈均质实性肿块,其密度略低于肌肉,肿块内无明显出血、坏死、囊变及钙化征象(图1,2)。7例位于胃腔内,3例跨胃壁呈腔内外生长,9例位于腔外。18例肿瘤形态呈圆形、卵圆形或扁圆形,边界清晰,其中12例肿瘤表现为圆形;仅1例略呈分叶状,边缘与邻近脏器粘连模糊不清。全部肿瘤表现为均匀强化,16例GS病变呈动脉期轻度强化,门脉期中等度强化,3例动脉期中等度强化,门脉期明显强化。所有病例均未见有腹部实质脏器、淋巴结转移及腹水征象。
GIST:①极低危险度GIST患者16例,肿瘤均为单发。肿瘤最大直径0.5~2.4 cm,平均(1.3±0.6)cm。12例肿瘤向腔内生长,1例向腔外生长,3例向腔内外生长。16例肿瘤均呈圆形、卵圆形。15例肿块强化均匀,1例强化不均匀。7例呈轻度强化,9例中等或明显强化。1例肿块内有钙化,所有肿块均无坏死囊变及出血。②低危险度GIST者34例,1例为多发,为两枚肿块,33例为单发,肿瘤最大直径1.2~9.0 cm,平均(3.6±1.6)cm。20例肿瘤向腔内生长,6例向腔外生长,8例向腔内外生长。28例肿瘤均呈圆形、卵圆形,6例肿瘤分叶。18例肿块强化均匀,16例强化不均匀。8例呈轻度强化,26例中等或明显强化。11例肿块内有坏死囊变,23例无坏死囊变。5例肿块内有钙化灶,29例无钙化。3例肿块有出血,31例肿块无出血。1例肿瘤被覆粘膜面有溃疡。③中等危险度GIST者13例,均为单发,肿瘤最大直径1.8~19.0 cm,平均(5.2±4.4)cm。5例肿瘤向腔内生长,3例向腔内生长,5例向腔内外生长。11例肿瘤均呈圆形、卵圆形,2例肿瘤分叶,形状不规则。4例肿块强化均匀,9例强化不均匀。2例呈轻度强化,11例中等或明显强化。6例肿块内有坏死囊变,7例无坏死囊变。1例肿块内有钙化灶,12例无钙化。2例肿块有出血,11例肿块无出血。3例肿瘤被覆粘膜面有溃疡。④高危险度GIST者13例,1例为多发,为两枚肿块,12例为单发,肿瘤最大直径4.0~15.0 cm,平均(9.9±3.9)cm。1例肿瘤向腔内生长,3例向腔内生长,9例向腔内外生长。5例肿瘤均呈圆形、卵圆形,8例肿瘤分叶,形状不规则。2例肿块强化均匀,11例强化不均匀。13例均呈明显强化。11例肿块内有坏死囊变,2例无坏死囊变。2例肿块内有钙化灶,11例无钙化。1例肿块有出血,11例肿块无出血。4例肿瘤被覆粘膜面有溃疡。3例出现肝脏转移,其中1例腹腔内种植转移,并有腹水。
2.2统计学分析结果
GS和GST的最大直径统计结果见表1。GS的最大径与低危险度及中等危险度GST的最大径之间的差异没有统计学意义,但是与极低危险度及高危险度GST的最大径之间的差异有统计学意义。

表1 GS和GST最大径
GS和GST CT表现统计结果分析如表2。①从肿瘤的形态上来看,GS圆形/椭圆形占94.7%,分叶/不规则占5.3%,与高危险度GST(分别为38.5%及61.5%)的差异有意义,与极低危险度(100%及0%)、低危险度(84.6%及17.6%)及中等危险度(84.6%及15.4%)GST无统计学意义。②GS、低、中等及高危险度间质瘤可以发生腔内生长、腔外生长及腔内外生长,其三者无统计学意义,而极低危险度的间质瘤75%发生于腔内,6.2%发生于腔外,18.8%发生于腔内外,与GS有统计学意义(P=0.02)。③GS中等或明显强化占47.4%,与极低(56.2%)危险度间质瘤的强化程度没有统计学意义,但是与低(76.5%)、中等(84.6%)及高危险度间质瘤(100%)的强化程度有统计学意义。④GS在强化模式上均匀强化占94.7%,与极低危险度(93.8%)间质瘤没有统计学意义,而与低(52.9%)、中等(30.8%)及高危险度(15.4%)间质瘤有统计学意义。⑤GS内部的坏死囊变(5.3%)与极低危险度(0%)没有统计学意义,但与低(32.4%)、中等(46.2%)及高危险度(84.6%)间质瘤有统计学意义。⑥GS与所有类型的间质瘤在肿瘤内部钙化及出血征象上没有统计学意义。
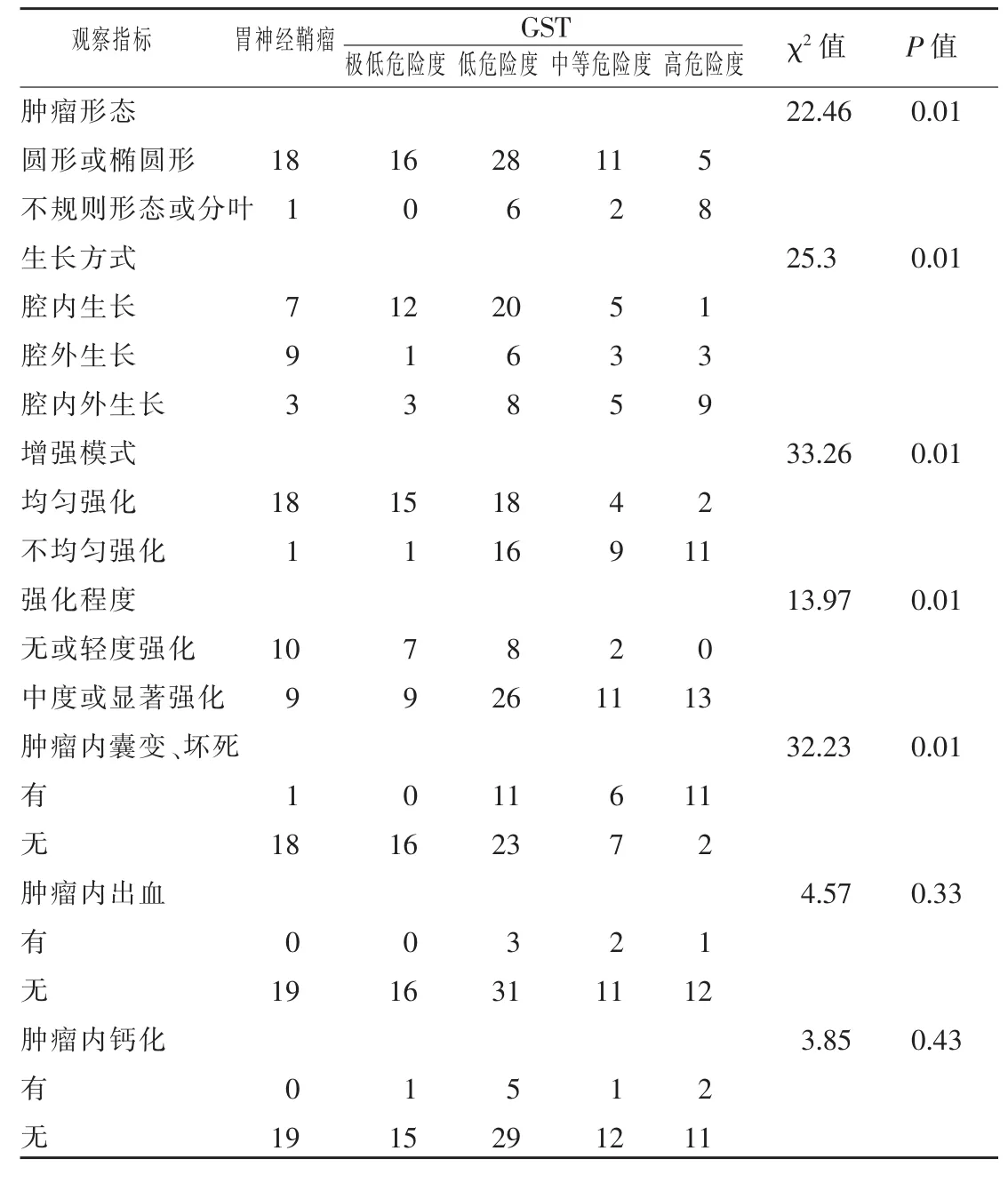
表2 GS和GST的CT表现
3 讨论
GS起源于胃壁肌间Auerbach's神经丛神经鞘Schwann细胞[4]。它是非常罕见的胃部肿瘤,该病的发病率约占胃肠道间叶源性肿瘤的2.9%[5],其占整个胃部肿瘤的0.2%[6],而胃肠道间质瘤是消化道最常见的间叶源性肿瘤,60%~70%发生于胃,占胃部肿瘤的1%~3%[1-2],GS及GST临床表现、胃镜及CT表现极其相似,术前常把GS误诊为GST。GS和GST影像学表现及对比,国内外均有报道[7-8],但是多是把GST按照良恶性区分后与神经鞘瘤对比,本研究的病理分级参照现在比较流行的分级方法,即2008年4月美国国立卫生研究院(NIH)修订的GIST切除后的风险分级。
在1999年以前,曾将GIST分为良性、潜在恶性和恶性;但是随着认识的不断深入,发现似乎没有GIST是真正良性的[9],而且极易发生血行及种植广泛转移,所以“良性”和“恶性”分类应该被描述为“低度恶性”和“高度恶性”更加确切,NIH协商方案仅依据肿瘤大小和核分裂象数进行分级,而胃肠道神经鞘瘤绝大多数为良性,发生恶变的概率很小,手术切除具有良好的预后。本组19例GS,全部为良性。而GST在高危险度这组13例患者中,发现时已有3例发生肝转移。所以术前明确区分胃肠道神经鞘瘤和GIST对手术方案的制订、术后的治疗与随访均具有十分重要的临床意义。本组病例的误诊主要是因为GST相较于神经鞘瘤的高发率,及缺乏对胃神经鞘瘤的深刻认识,以至于本组19例GS术前CT误诊为GST有14例,胃平滑肌瘤3例,胃癌1例,只有1例考虑到了神经源性肿瘤。
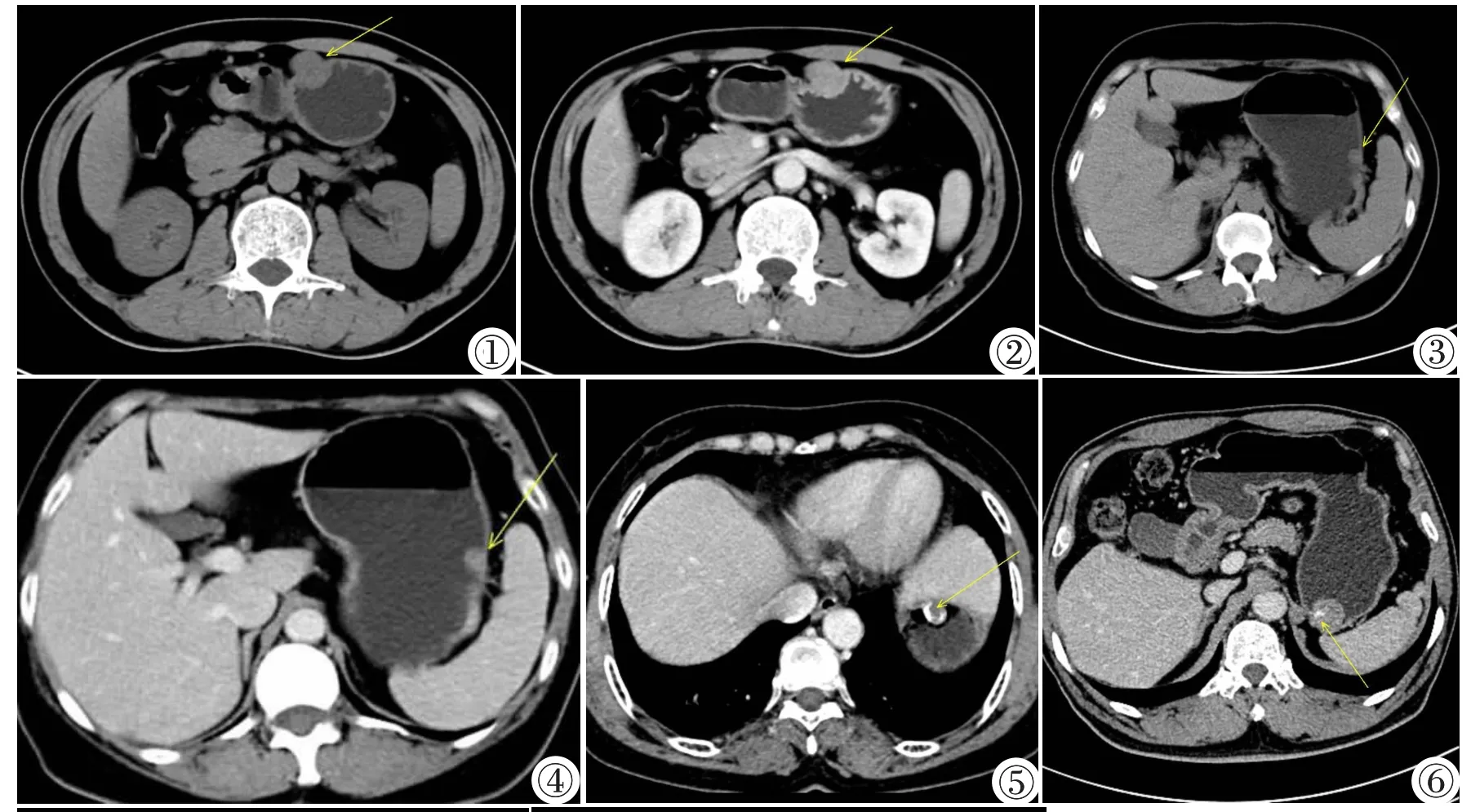
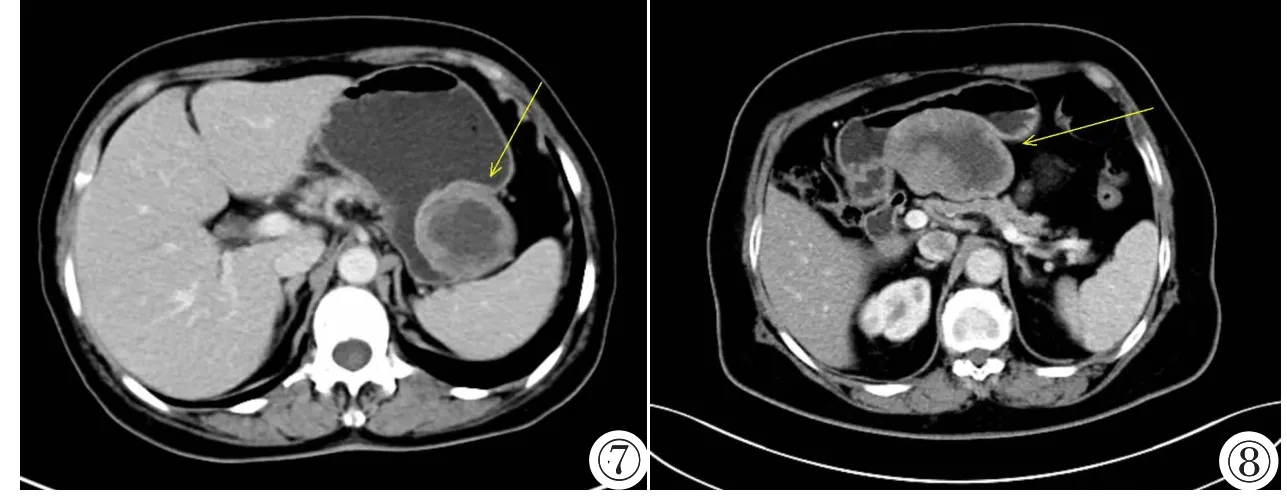
CT平扫加动静脉双期增强扫描。图1,2胃神经鞘瘤,图1:CT平扫示椭圆形肿块腔内外生长,肿块最大径约4 cm,边缘光滑。图2:增强后静脉期肿块中等均匀强化,内部无坏死囊变、无钙化及出血。图3~5胃间质瘤(极低危险度),图3:CT平扫示凸向腔内生长的圆形肿块,肿块最大径约1.5 cm,边缘光滑。图4:增强后静脉期肿块强化中等,均匀强化,内部无坏死及囊变,无钙化及出血。图5:肿块内部有钙化。图6胃间质瘤(低危险度),增强后静脉期示凸向腔内生长的圆形肿块,肿块最大径约4 cm,边缘光滑,肿块中等强化。图7胃间质瘤(中等危险度)增强后静脉期示圆形肿块于腔内外生长,肿块最大径约7 cm,边缘欠光整,肿块明显强化,内部坏死灶,无出血及钙化。图8胃间质瘤(高危险度)增强后静脉期示形状不规则肿块于腔外生长,肿块最大径约11.5 cm,边缘欠光整,有明显强化,肿块内部坏死灶,无出血及钙化。
Plain and dual-phase contrast enhanced CT scanning.Figure 1,2.GS.Non contrast CT(Figure 1)showed an oval mass with a mixed(endoluminal and exophytic)growth pattern,a maximum diameter of 4 cm and a smooth border.Venous phase of enhanced CT(Figure 2)showed a homogeneous moderate enhancement.There were no intralesional low attenuation areas,hemorrhage or calcification.Figure 3~5.GSTs at very low risk.Figure 3:Non contrast CT scanning showed a round mass with an endoluminal growth pattern,a maximum diameter of 1.5 cm and a smooth border.Figure 4:Venous phase of enhanced CT scanning showed a homogeneous moderate enhancement.There were no intralesional low attenuation areas,hemorrhage or calcification.Intratumoral calcification was revealed(Figure 5).Figure 6.GSTs at low risk.Venous phase of enhanced CT scanning showed a round mass with an endoluminal growth pattern,heterogeneous moderate enhancement,a smooth border and a maximum diameter of 4 cm.Figure 7.GSTs at intermediate risk.Venous phase of enhanced CT scanning showed a round mass with a mixed(endoluminal and exophytic)growth pattern,good enhancement,a central intralesional low attenuation area,an irregular border without hemorrhage or calcification,and a maximum diameter of 7 cm. Figure 8.GSTs at high risk.Venous phase of enhanced CT scanning showed a mass with an irregular border and shape,good enhancement and an exophytic growth pattern.There was an intralesional low attenuation area,but no hemorrhage or calcification.The tumor's maximum diameter was 11.5 cm.
本研究分别从肿瘤的最大径、形态、生长方式、增强模式、强化程度、肿瘤内部出血、钙化及坏死囊变发生情况等多种因素探讨GS和GST具有鉴别诊断价值的影像学表现。本研究发现:①GS和高危险度GST在肿瘤最大径、肿瘤形态、强化程度、增强模式和肿瘤内部的坏死囊变不同,所以可以在这几种差异对两者进行鉴别诊断。本组肿瘤最大径平均(3.1±1.5)cm,与国内多数的研究结果(肿块多大于5 cm)有一定差距,但是与Choi[8]的研究结果相一致。GS多表现为圆形或卵圆形,无坏死和囊变的匀质性肿块,强化程度可轻度强化,也可中等或明显强化,但是高危险度间质瘤形态多为分叶、不规则,肿块内部多有坏死和囊变灶,欠均匀,强化程度多为明显强化。在肿瘤内部出血及钙化这些特征上与间质瘤没有统计学意义,但是本组GS肿瘤内部均未发现钙化及出血。有学者认为,GS不会出现退行性改变,不会出现坏死、囊变、出血、钙化的现象,认为这是GS的一个特点[10-11]。本研究结果与此报道结论相符合。但是也有GS出血、钙化及囊变坏死的报道[12-13]。②GS与低危险度及中等危险度间质瘤在肿瘤形态及最大径差异上没有统计学意义,可以在肿瘤内部坏死囊变、强化程度特征及强化均匀性上相鉴别。低、中危险度间质瘤相较GS多会出现坏死囊变、中等或明显强化。低危险度GST肿瘤强化均匀和欠均匀分别占52.9%和47.1%,中危险度肿瘤内部均匀较少(30.8%)。文献报道[7-8]胃恶性间质瘤多表现为分叶状或不规则形,非匀质肿块,中等或明显强化,肿瘤中心常出现坏死、囊变和出血而呈不均性强化或边缘强化,本研究结果大致与其相符。③极低危险度GST的最大直径多小于GS,但是从肿瘤的形态、强化程度和强化方式上,肿块内部没有坏死囊变、出血及钙化,两者比较相似,很难将两者鉴别。研究表明良性间质瘤、恶性间质瘤和神经鞘瘤的生长方式三者之间差异没有统计学意义[7],而本研究表明极低危险度间质瘤多发生于腔内。综上所述,GS和高危险度间质瘤比较好鉴别,但是和极低、低及中等危险度间质瘤单单从临床及CT表现还是很难区别,最终的诊断还是要依赖免疫组织化学和电子显微镜检查。
本文仍有一定的局限性,因为GS比较少见,即使病例的收集经过了4年时间,病例数仍较少;从肿瘤的大小方面来说,本组肿瘤总体较小,所以本研究可能存在选择偏倚及样本量较少的问题。而且本研究中极低、中及高危险度的间质瘤例数较少。今后可以扩大样本量做更详细的对比。
[1]Lin CS,Hsu HS,Tsai CH,et al.Gastric schwannoma[J].J Chin Med Assoc,2004,67(11):583-586.
[2]Miettinen M,Lasota J.Gastrointestinal stromal tumors-definition,clinical,histological,immunohistochemical and molecular genetic features anddifferential diagnosis(Review)[J].Virchows Arch,2001,438(1):1-12.
[3]Nishida T,Hirota S.Biological and clinical review of stromal tumors in the gastrointestinal tract(Review)[J].Histol Histopathol,2000,15(4):1293-1301.
[4]Dmmam Y,Kido H,Hashimoto H,et al.Benign schwannoma of the gastrointestinal tract:a clinicopathologic and study[J].Hum Pathol,1988,19(3):257-264.
[5]HouYY,TanYS,XuJF,et al.Schwannoma of the gas trointestinal tract:a clinicopathological immunohistochemical and ultrastructural study of 33 cases[J].Histopathology,2006,48(5):536-545.
[6]GohBKP,ChowPKH,KesavanS,et al.Intraabdominal schwannomas:a single institution experience[J].J Gastrointest Surg,2008,12(4):756-760.
[7]邢伟,谭华桥,俞胜男,等.胃肠道神经鞘瘤和间质瘤的螺旋CT表现及对照研究[J].临床放射学杂志,2006,25(6):538.
[8]Choi JW,Choi D,Kim KM,et al.Small Submucosal Tumors of theStomach: DifferentiationofGastricSchwannomafrom Gastrointestinal Stromal Tumor withCT[J].KoreanJ Radiol,2012,13(4):425-433.
[9]VonMehrenM.Newtherapeuticstrategiesforsofttissue sarcomas[J].Curr Treat Options Oncol,2003,4(6):441-451.
[10]Agaimy A,Markl B,Kitz J,et al.Peripheral nerve sheath tumors of the gastrointestinal tract:a multicenter study of 58 patientsincludingNF1-associatedgastricschwannomaand unusual morphologic variants[J].Virchows Arch,2010,456(4):411-422.
[11]NascimentoAF,Fletcher CD.Thecontroversial nosologyof benignnervesheathtumors:neurofilamentproteinstaining demonstrates intratumoral axons in many sporadic schwannomas [J].Am J Surg Pathol,2007,31(9):1363-1370.
[12]KwonMS, LeeSS, AhnGH.Schwannomasofthe gastrointestinal tract:clinicopathological features of 12cases including a case of esophageal tumor compared with those of gastrointestinalstromaltumorsandleiomyomasofthe gastrointestinal tract[J].Pathol Res Pract,2002,198(9):605-613.
[13]Daimaru Y,Kido H,Hashimoto H,et al.Benign schwannoma of thegastrointestinaltract:aclinicopathologicand immunohistochemical study[J].Hum Pathol,1988,19(3):257-264.
Imaging findings and a comparative study of gastric schwannomas and gastric stromal tumors on multi-slice CT
XU Hui-xin,XU Qing
(Department of Radiology,the First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China)
Objective:To investigate CT findings of gastrointestinal schwannomas(GS)and gastric stromal tumors(GST),and further to compare their CT features in order to differentiate GS from GST.M aterials and Methods:19 GSs and 76 GSTs proven surgically and pathologically were enrolled in this study.Two experienced radiologists retrospectively evaluated and compared the CT features including size,contour,growth pattern,pattern and degree of contrast enhancement,and the presence of intralesional low attenuation area,hemorrhage and calcification.The statistical significance was evaluated by using 95%confidence interval,one-way ANOVA,LSD test and Chi-Square test.Results:As the diameter was concerned,GSs were significantly bigger than GSTs at very low risk(P=0.04),and smaller than GSTs at high risk(P=0.01).The contour was round or oval in most GSs(18/19),GSTs at very low risk(16/16),GSTs at low risk(28/34)and GSTs at intermediate risk(11/13),but lobulated in GSTs at high risk(8/13).GSTs at very low risk frequently demonstrated an endoluminal growth pattern(12/16),while a homogeneous enhancement pattern was frequently found in GSs(18/19)and GSTs at very low risk(15/16).Good enhancement degree was more common in GSTs at low risk(26/34),GSTs at intermediate risk(11/13)and GSTs at high risk(13/13)than in GSs(9/19).The intralesional low attenuation area was more common in GSTs at low risk(11/34),GSTs at intermediate risk(6/ 13)and GSTs at high risk(11/13)than in GSs(1/18).Conclusion:GSs frequently show a round or oval appearance with slight homogeneous enhancement pattern and rare intralesional necrosis,hemorrhage or calcification.These CT findings are common in GSTs at very low risk,low risk and intermediate risk,but distinguishable from GSTs at high risk.
Stomach neoplasms;Neurilemmoma;Gastrointestinal stromal tumors;Tomography,spiral computed
R735.2;R730.264;R730.262;R814.42
A
1008-1062(2015)01-0018-05
2014-07-21;
2014-08-18
徐慧新(1984-),女,江苏南京人,在读硕士研究生。
徐青,南京医科大学第一附属医院放射科,210029。
