比较不同抗原修复液对免疫组化结果的影响
2015-09-26王一鸣丛宪玲任光旭
王 琦,王一鸣,刘 铁,郝 苗,丛宪玲,任光旭
(1.延边大学医学院,吉林 延吉133000;2.吉林大学中日联谊医院,吉林 长春130033;3.延边大学附属医院,吉林 延吉133000)
免疫组织化学(Immunohistochemistry,IHC)是一种通过抗原抗体特异性反应来检测并定位蛋白的方法,目前广泛应用于组织病理学诊断[1]。抗原修复是免疫组化实验中的关键步骤,已有文献针对现有的修复方式做了一个初步的比较,结果显示微波高压修复、微波热修复以及高压热修复在相同的条件下具有相似的结果[2]。然而,抗原修复过程中选择不同的缓冲液,可能对免疫组化结果产生不同的影响。在本文中,我们选择高压热修复方式,研究两种不同抗原修复液,即柠檬酸缓冲液及Tris-EDTA(TE)缓冲液,对免疫组化结果的影响。
1 材料和方法
1.1 组织
福尔马林固定石蜡包埋的肺癌组织切片及结肠癌组织切片均来自吉林大学中日联谊医院,切片厚度为3μm,每个蜡块连续切取多张并贴附在商用硅包被的载玻片(世通公司)上,切片吸附后在65℃烤箱中烘烤2h以增强吸附力。
1.2 试剂
MUC1抗体分别购自BD公司(550486)和Abcam公司(ab10120),使用前按适当比例稀释。免疫组化检测试剂盒及DAB染液均购自福州迈新生物技术公司。
1.3 修复液
柠檬酸缓冲液(pH 6.0)、TE缓冲液(pH 7.6)。
1.4 免疫组化染色方法
将组织切片脱蜡入水,滴加3%H2O2孵育10 min,水洗,每例切片均经上述两种不同抗原修复液高压处理2.5min(排气后开始计时),之后冲凉水去压,开盖后自然冷却至室温。修复后按照试剂盒说明书进行操作,最终脱水后进行封片镜检。
2 结果
我们分别对肺癌和结肠癌两类组织切片进行免疫组化染色实验,每类组织均设有阴性对照、Abcam公司抗体组和BD公司抗体组,每组切片分别进行TE缓冲体系修复和柠檬酸缓冲体系修复。所有切片均由Olympus成像系统拍摄。
2.1 柠檬酸缓冲液vs TE缓冲液,肺癌
在肺癌组织切片中,结果如Fig 1所示,无论采用哪种缓冲体系,阴性对照均背景清晰;比较不同公司两种抗体的染色结果,我们很容易看出BD公司的抗体染色更强一些。比较两种不同的缓冲体系,我们发现TE缓冲液进行抗原修复的效果更强,染色更明显。值得注意的是,Abcam公司的抗体配合柠檬酸缓冲体系的切片染色较浅,很容易被判定为阴性结果。以上结果表明TE缓冲液修复能力比柠檬酸缓冲液修复能力更强。

Fig.1 Immunohistochemistry for lung cancer.(Original magnification×100)
2.2 柠檬酸缓冲液vs TE缓冲液,结肠癌
如Fig 2所示,结肠癌的免疫组化结果与肺癌相似,但是两种抗原修复液的对比并不十分明显。所有的抗体染色均较清晰,但是在阴性组可见微弱染色,在可接受范围之内且与实验组差别明显。与TE缓冲液相比,柠檬酸缓冲液抗原修复效果较好,染色较深,背景清晰,特异性显著,更适合作为结肠癌组织切片的抗原修复液。
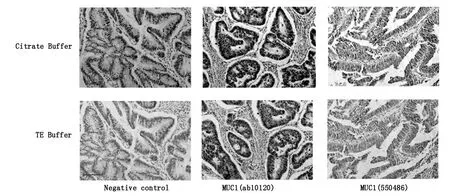
Fig.2 Immunohistochemistry for colon cancer.(Original magnification×100)
3 讨论
免疫组化是临床诊断和组织病理学中常用的检测手段,抗原修复是免疫组化过程中不可忽略的关键步骤。主要原因在于免疫组化中常采用的固定液福尔马林会影响抗原与抗体的识别。福尔马林的主要成分是甲醛,可用于保存细胞形态,稳定细胞基质,防止细胞发生自噬或蛋白移位[3]。当细胞内被固定液浸润后,主要的肽段和基本结构都会保存下来。除此之外,一些核苷酸也可能会与福尔马林发生反应,而碳水化合物则不会有类似现象[4]。福尔马林中的甲醛可以特定地结合到某些氨基酸残基上,比如赖氨酸、酪氨酸、组氨酸、精氨酸、谷氨酰胺、天冬酰胺[5]等。其中具体的原理还不清楚,可能是不带电的氨基基团(-NH或NH2)与甲醛(CH2O)之间形成了亚甲基桥,方程式如下:
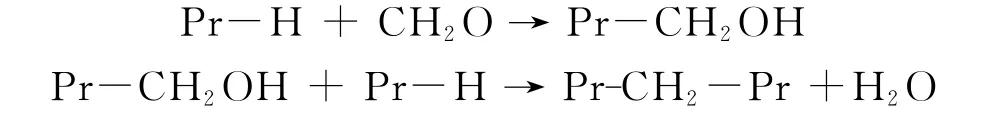
在这个反应中,组织上的活性氢首先与甲醛发生反应得到羟甲基,羟甲基再与其他的活性氢发生反应最终得到交联的蛋白[6]。因为这一过程消耗了氨基中的氢,所以扰乱了氨基酸之间原有的氢键和相互作用[7],使蛋白质的三级或四级结构被破坏从而导致抗原不能很好的被抗体识别[8]。
因此,经过固定的切片由于抗原与甲醛发生交联,导致蛋白信号被掩盖。这种交联在高温加热或是蛋白酶水解的作用下会发生可逆反应,恢复蛋白的原有构象,这一过程就是抗原修复[9]。自抗原修复技术发现以来,该过程已经成为免疫组化中必经的一步[10]。据文献报道,在福尔马林固定的组织中,大约有85%的抗原经过优化的抗原修复都会得到较好的免疫组化结果[11]。
目前研究者对于抗原修复的具体机理尚不清楚,且抗原修复方式不同,结果也各不相同。在本文中,我们比较了两种不同的抗原修复液,发现TE缓冲液修复抗原的能力更强,但是同时也提升了暴露内源性过氧化物酶以及脱片的风险。
两种抗原修复液最大的区别在于pH值不同和是否存在EDTA。pH对抗原修复影响很大,有些抗原可以在较大的pH范围内进行修复,而有些抗原只能在某一特定的pH值被修复[12]。此外,高pH缓冲液更容易使组织中内源性生物素暴露。因此,在使用SP法进行实验时,对酶系丰富的组织,如肝、肾等,应优先使用低pH缓冲液进行实验,如柠檬酸缓冲液。EDTA是一种钙或其他二价离子的螯合剂,钙离子可以诱导蛋白构象发生改变最终引起免疫活性的改变[3,13]。由以上可以得出,柠檬酸修复液更适合表位容易暴露的抗原,TE缓冲液更适合信号较弱的抗原。因此,我们建议在抗原修复时,应优先使用柠檬酸盐缓冲液,若是修复效果不理想,再用TE缓冲液进行尝试。
此外,本文中我们使用了两个不同公司针对同一抗原的抗体,但是实验的结果并不一致,主要原因可能是它们针对的抗原表位不同。而且,在不同的组织中,结果也不十分相同,可能的原因是不同的组织中抗原发生交联的程度不同。因此,在进行免疫组化实验时,哪怕是同一种抗原,进行抗原修复的最优方式也可能不同,在实验前进行预实验确定最佳实验条件是必要的步骤。
[1]Goudie RB.Immunomicroscopy:A Diagnostic Tool for the Surgical Pathologist[J].J ClinPathol,1988,41(2):237.
[2]Taylor CR,Shi S R,Chen C,et al.Comparative study of antigen retrieval heating methods:microwave,microwave and pressure cooker,autoclave,and steamer[J].Biotech Histochem,1996,71(5):263.
[3]Hayat MA.Microscopy,immunohistochemistry,and antigen retrieval methods[M].New York:Kluwer Academic/Plenum Publishers,2002.
[4]Eltoum,Isam,et al.Introduction to the theory and practice of fixation of tissues[J].J Histotechnol,2001,24(3):173.
[5]Shi SR,Gu Jiang,Taylor CR,et al.Development of the antigen retrieval technique:philosophical and theoretical bases[M].Antigen retrieval techniques:immunohistochemistry and molecular morphology,2000:17.
[6]Dapson,Richard W.Fixation for the 1990's:a review of needs and accomplishments[J].Biotech Histochem,1993,68(2):75.
[7]Fredenburgh JL,Myers RB:Basic IHC workshop[C].Long Beach,California:28thAnnual Meeting National Society for Histotechnology,2002.
[8]Montero,Claudio.The antigen-antibody reaction in immunohistochemistry[J].J HistochemCytochem,2003,51(1):1.
[9]Fraenkel– Conrat H,Brandon BA,Olcott HS.The reaction of formaldehyde with proteins IV[J].J BiolChem,1947,168(1):99.
[10]Shi SR,Key ME,Kalra KL.Antigen retrieval in formalin-fixed,paraffin-embedded tissues:an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections[J].J HistochemCytochem,1991,39(6):741.
[11]Ramos-Vara JA,BeissenherzME.Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed,paraffin-embedded tissues:experience with 63 markers[J].Journal of Veterinary Diagnostic Investigation,2000,12(4):307.
[12]Shi,SR,Iman SA,Young L,et al.Antigen retrieval immunohistochemistry under the influence of pH using monoclonal antibodies[J].J HistochemCytochem,1995,43(2):193.
[13]Imam,SA,Young L,Chaiwun B,et al.Comparison of two microwave based antigen-retrieval solutions in unmasking epitopes in formalin-fixed tissue for immunostaining[J].Anticancer Res,1994,15(4):1153.
