改良组织块贴壁法培养小鼠主动脉血管平滑肌细胞及生物学鉴定*
2015-08-14王浩宇任丽蓉
何 蔺,刘 涛△,王浩宇,任丽蓉
(1.川北医学院第二临床学院/南充市中心医院心内科,四川南充 637000;2.泸州医学院附属医院心内科,四川泸州 646000)
血管平滑肌细胞(vascular smooth muscle cells,VSMC)是一种多功能间叶细胞,主要参与构成肌性动脉血管壁的中膜,其收缩和舒张可以维持血管张力和保持血管完整性。目前有研究认为,VSMC从中膜迁移到内膜下间隙,增殖并沉淀细胞外基质促使脂质条纹转变为成熟的纤维脂质斑块,与动脉粥样硬化、高血压和经皮冠状动脉成形术后再狭窄等血管性疾病的发生密切相关[1-3]。因此,在体外条件下分离获得大量VSMC成为了无数血管性疾病分子机制研究的基础。为提高VSMC原代培养的成功率和可行性,本研究在传统组织块贴壁法培养原代细胞的基础上进行摸索和改进,建立了一种简单、经济、可靠的小鼠主动脉VSMC原代培养方法,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 无特定病原体(SPF)C57BL/6小鼠3~4只,雌雄不限,8周龄以上,购自成都达硕实验动物有限公司(动物合格证编号:0003281)。
1.1.2 主要试剂 高糖/杜尔伯科改良伊格尔培养基(HG/DMEM)、0.25%胰蛋白酶溶液、青/链霉素混合液购自Hyclone公司,胎牛血清(FBS)购自Gibco公司,鼠抗α-平滑肌肌动蛋白(α-SMA)单克隆抗体购自 Abcam公司,0.01mol/L PBS、封闭用山羊血清、异硫氰酸荧光素(FITC)标记山羊抗小鼠IgG 二抗购自北京中杉金桥公司,4,6-联脒-2-苯基吲哚(DAPI)、Triton X-100购自Sigma公司。
1.1.3 主要器材 超净工作台购自Thermo公司,CO2细胞培养箱购自Sanyo公司,倒置相差显微镜、BX41型荧光倒置显微镜购自Olmypus公司,L420普通离心机购自Xiang Yi公司,T25细胞培养瓶、培养皿、离心管购自Corning公司。
1.2 细胞培养
1.2.1 原代培养 颈椎脱臼法处死小鼠,置于75.00%乙醇浸泡消毒3min,仰卧固定于超净工作台。用组织剪剪开胸腹部皮肤及肌肉层,换用眼科剪靠近胸部左侧剪开胸骨和膈肌,充分暴露胸腹腔,紧靠脊柱前方用眼科镊及眼科剪小心钝性分离取出胸、腹主动脉,并立即放入盛有PBS液(含双抗)的培养皿内。用PBS液反复浸洗血管2~3遍,浸洗时用弯头镊子顺血管轻轻滑动挤压血管,以完全洗去血管内外的血污和破损细胞。取两把眼科镊小心夹住血管两侧,尽量剥除血管外膜的脂肪和纤维组织。用眼科剪纵向剪开血管腔,眼科弯镊小心擦拭血管内膜层,以去除血管内皮细胞,PBS液浸洗。将血管段放入另一培养皿中,加入2~3mL 0.25%胰蛋白酶溶液,预消化10min后转入完全培养液(含双抗)中,用眼科剪将血管段剪成1mm2大小的组织块,边缘光滑、整齐,将组织块均匀贴放于25cm2培养瓶底面,组织块间隔约3~5mm。小心竖起培养瓶,向瓶内加入5mL含20.00%FBS的HG/DMEM(含双抗)培养液,直立静置于37℃、5.00%CO2饱和湿度培养箱中,半开放式绝对静置培养1.5~2.0h,待组织块自然贴附于瓶壁后轻轻将培养瓶放平使组织块逐渐浸没于培养液中,继续半开放式绝对静置培养3d,避免振动和移动,4~5d时首次换液,后每隔5~7天更换培养液。
1.2.2 传代培养 吸弃培养瓶中的旧培养液,加入2mL PBS液清洗2遍后吸弃,加入1~2mL 0.25%胰蛋白酶溶液,2min后镜下观察,当细胞回缩变圆、间隙增大、细胞团开始有脱落时,立即加入含完全培养液3~4mL终止消化,用吸管反复轻轻地吹打使细胞脱离瓶壁而悬浮,形成细胞悬液。静置15min后,利用差速贴壁法[4-5],使杂质细胞贴壁,随后用吸管将细胞悬液转入离心管,1200r/min离心3min,弃上清液;加入完全培养液到离心管,用吸管吹散后视细胞数量按1∶1~1∶3的比例接种到新的培养瓶中继续培养。以后的传代方法相同,传代周期为5~7d。
1.3 细胞鉴定
1.3.1 形态学鉴定
1.3.1.1 倒置相差显微镜 原代及传代培养时,使用倒置相差显微镜常规观察VSMC的大体形态、生长特点及排列方式等。
1.3.1.2 苏木素-伊红(HE)染色 将P3代VSMC细胞用0.25%胰蛋白酶溶液消化后以每孔5×104个细胞接种于内置小盖玻片的24孔板中制作细胞爬片,放入37℃、5.00%CO2培养箱培养,24.0h后取出细胞爬片,PBS液洗涤3次、3min/次,95.00%乙醇固定15min,PBS液洗涤2次、3min/次,行HE染色,最后中性树胶封片,正置显微镜下观察。
1.3.2 免疫荧光鉴定 取P3代VSMC细胞用0.25%胰蛋白酶溶液消化后调整细胞浓度,以每孔5×104个细胞接种于内置小盖玻片的24孔板中,放入37℃、5.00%CO2培养箱培养24.0h,待细胞自然贴壁、生长良好时,吸弃培养液,PBS液洗涤3次、3min/次;4.00%多聚甲醛室温固定15min,PBS液洗涤3次、3min/次;0.10%Triton X-100通透10min,PBS液洗涤3次、3min/次;山羊血清封闭30min,吸弃,不洗;加入鼠抗α-SMA单克隆抗体200μL(稀释度为1∶500)4℃过夜,PBS液洗涤3次、3min/次;加入FITC标记山羊抗小鼠IgG二抗200μL(稀释度为1∶100)室温避光孵育1.0h,PBS液洗涤3次、3min/次;DAPI(1μg/mL)避光复染核10min,抗荧光淬灭剂封片后荧光显微镜下观察。
2 结 果
2.1 细胞生长情况 原代培养第5天左右在倒置相差显微镜下可观察到从组织块边缘游离出的VSMC(图1A);第7~9天大部分组织块长出细胞晕,细胞围绕组织块边缘呈放射状向外延伸,细胞大小不等,形态不规则(图1B);第10~12天,相邻细胞晕逐渐相接触,多数细胞伸展呈长梭形,有分枝状突起细胞,平行排列成单层或多层重叠,呈典型“峰-谷”样生长(图1C)。2周左右时组织块周围长出的细胞相互融合,生长至铺满70.00%~80.00%瓶壁时即可进行传代。传代后细胞生长较快,5d左右细胞再次长成致密单层铺满瓶底。经过多次传代培养和反复人工纯化,VSMC的生长越来越占优势,传至3~4代时即可用于后续实验。

图1 VSMC原代培养(×100)
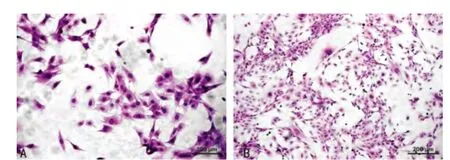
图2 VSMC HE染色
2.2 VSMC HE染色观察 HE染色后正置显微镜下观察可见细胞界限清楚,VSMC呈梭形、细胞质丰富、细胞质着粉红色,细胞质近中央处有大而圆形或椭圆形的胞核,着蓝紫色(图2A),细胞融合区域可见细胞相互平行排列,呈旋涡状或“峰-谷”样生长(图2B)。
2.3 VSMC免疫荧光鉴定 培养的P3细胞经特异性α-SMA免疫荧光检测显示细胞具有正常的α-SMA阳性表达,细胞质着绿色荧光,细胞核蓝染,高倍镜下可见肌动蛋白呈绿色条束状,细胞形态完整、胞核轮廓清晰(图3),培养的VSMC细胞阳性率达98.0%以上,细胞纯度较好。

图3 VSMC免疫荧光α-SM actin染色(×400)
3 讨 论
VSMC的异常增殖和迁移是损伤性血管疾病的主要病理学特征,近年来,随着细胞生物学和分子生物学的研究进展,以VSMC为主要实验对象,研究血管性疾病的发病环节,探索与其密切相关的VSMC增殖和迁移的信号转导机制是目前研究的热点[1-3,6],而具有良好生长状态的离体 VSMC也成为该类实验研究的重要条件。
传统VSMC的原代培养方法主要包括酶消化法和组织块贴壁法[7-8],前者培养周期短、细胞获得量较多,但因其操作繁琐、酶作用时间及酶作用浓度不易掌握、实验成本相对较高等[9-11],未能得到多数实验研究的采用;后者操作简单,且较为经济和有效,被广泛用于VSMC的原代培养。但传统组织块贴壁法也因其培养周期长、组织块贴壁不佳、含有太多杂质细胞等而成为阻碍研究实验进行的因素之一。本研究主要参照传统组织块贴壁法,经过反复试验摸索后对其进行改良,一方面在取材获得完整血管中膜层组织后,加入0.25%胰蛋白酶溶液对其进行预消化处理,目的在于破坏组织的细胞间质蛋白[12],使紧密的组织结构变得疏松伸展,减少细胞“突破生长”[13]的阻力,有利于组织块贴壁后细胞尽快从组织块边缘游离出。另一方面,与传统组织块贴壁法不同的是,本研究将组织块均匀种植于培养瓶底面后,没有将培养瓶翻转平放于培养箱等待组织块干涸贴壁,而是小心竖起培养瓶,使组织块与瓶壁间多余的液体顺势流出,可大大缩短组织块自然贴附于瓶壁所需时间,并能起到很好的粘贴效果;竖起培养瓶后向瓶内加入的培养液可保持组织块所需的湿性环境,在一定程度上可防止组织块过度干涸而影响其生物学活性;每次传代时反复采用15min差速贴壁法,尽可能去除贴壁较快的成纤维细胞,从而提高VSMC的纯度。
为保证实验的成功率,在操作中还应该注意:严格的无菌观念,无菌操作是保证细胞体外生存的首要条件[14];熟练掌握小鼠主动脉血管的解剖方法,尽量缩短取材的时间,从而保证细胞的生物学活性;开始培养前3天绝对静置培养,切勿反复察看或移动培养瓶,首次换液时发现漂浮组织块应及时吸弃,以免其对细胞产生毒性作用;传代培养时应注意把握胰蛋白酶的消化时间及吹打方式,避免消化过度及吹打过猛而损伤细胞活性。用本研究改良组织块贴壁法培养的细胞经形态学鉴定细胞形态及状态良好,经平滑肌细胞特异性α-SMA免疫荧光检测显示细胞质呈强阳性,表明本研究所培养的细胞为VSMC,实验结果较为理想,可为后续VSMC相关的实验研究提供可靠的基础保障。
[1]Tuttolomondo A,Di Raimondo D,Pecoraro R,et al.Ath-erosclerosis as an inflammatory disease[J].Curr Pharm Des,2012,18(28):4266-4288.
[2]Schoen FJ.Blood vessels,Pathologic basis of disease[M].7th ed.Philadelphia:Elsevier Saunders,2005:511-514.
[3]Ducasse E,Cosset JM,Eschwège F,et al.Hyperplasia of the arterial intima due to smooth muscle cell proliferation.Current data,experimental treatments and perspectives[J].J Mal Vasc,2003,28(3):130-144.
[4]宋鲁杰,徐月敏,傅强,等.体外分离培养兔阴茎海绵体平滑肌细胞的纯度分析[J].中国男科学杂志,2007,21(11):1-5.
[5]刘康,白亦光,陈竹,等.兔骨髓间充质干细胞的分离培养及鉴定[J].川北医学院学报,2013,28(2):103-106.
[6]Iyemere VP,Proudfoot D,Weissberg PL,et al.Vascular smooth muscle cell phenotypic plasticity and the regulation of vascular calcification[J].J Intern Med,2006,260(3):192-210.
[7]Hao H,Ropraz P,Verin V,et al.Heterogeneity of smooth muscle cell populations cultured from pig coronary artery[J].Arterioscler Thromb Vasc Biol,2002,22(7):1093-1099.
[8]司徒镇强,吴军正.细胞培养[M].2版.北京:世界图书出版西安公司,2006:1~110.
[9]王关嵩,钱桂生,李淑平,等.大鼠细小动脉平滑肌细胞分离培养的新方法[J].中国临床解剖学杂志,2000,18(3):282-283.
[10]赵明,陈竹,张旭乾,等.关节软骨细胞体外培养及生物学特性的实验研究[J].川北医学院学报,2013,28(2):95-98.
[11]周晓莉,雷寒,柳青.小鼠主动脉平滑肌细胞的培养[J].基础医学与临床,2005,25(6):564-567.
[12]辛毅,许秀芳,黄益民,等.乳小鼠心肌成纤维细胞和心肌细胞的分离培养及荧光鉴定[J].新乡医学院学报,2011,28(5):541-547.
[13]方正旭,王伶,刘东.关于动脉平滑肌细胞培养的几个问题[J].江西医学院学报,2002,42(5):157-158.
[14]杜利君,蒋兴亮.人脐静脉内皮细胞的分离及原代培养体会[J].川北医学院学报,2013,28(1):48-51.
