α-硫辛酸对糖尿病大鼠视网膜VEGF表达的影响及机制*
2015-08-14胡辅华许玉俊刘丽林于荣国李筱荣
胡辅华,许玉俊,刘丽林,季 建,于荣国,李筱荣
(1.天津港口医院眼科 300456;2.天津港口医院急诊科 300456;3.天津市第五中心医院眼科 300456;4.天津医科大学眼科医院眼科 300074)
随着我国经济水平和国民消费水平的提高,人民的饮食方式发生了改变,糖尿病的发病率也逐年增加[1]。糖尿病视网膜病变是糖尿病的并发症之一,是糖尿病微血管病变的重要表现,是一种特异性的眼底改变,可严重影响患者的视力及生活质量,眼底镜下表现为新生血管的广泛形成[2]。糖尿病视网膜病变的形成机制较为复杂,主要为血管内皮生长因子(VEGF)刺激内皮细胞增生和新生血管形成,这一过程与机体的氧化应激反应相关[3-4]。α-硫辛酸(α-lipoic acid,α-LA)是一种作用较强的抗氧化剂,可以有效清除自由基,从而发挥其作用[5]。本次研究应用72只Wistar大鼠作为研究对象,观察α-LA对糖尿病视网膜病变大鼠VEGF表达的影响及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 选用72只健康的雄性Wistar大鼠作为实验材料,体质量为200~220g,平均(210.4±6.2)g,由天津医科大学实验动物中心提供,合格证号14-0212。将72只大鼠分为4组:空白对照组(A组)12只,糖尿病模型组(B组)24只,α-LA治疗组(C组)24只,葡萄糖干预组(D组)12只。
1.1.2 药物 α-LA注射液(南京新百药业有限公司,批号20131107),链脲佐菌素(STZ,Sigma公司,纯度大于98.0%),0.5%硫酸阿托品滴眼液(Alcon Labratories Inc,批号:20140103)。
1.2 方法
1.2.1 模型构建及药物处理 所有大鼠均进行适应性喂养1周,B和C组大鼠按照60mg/kg的剂量腹腔注射STZ(溶于0.1mol/L的柠檬酸缓冲液,pH=4.5),72h后采大鼠尾静脉血测空腹血糖,血糖大于或等于16.7mmol/L为糖尿病模型构建成功;A组大鼠腹腔注射等量的柠檬酸缓冲液。4组大鼠均进行常规饲养,C组大鼠每天下午3:00用100mg/kg的α-LA灌胃;A组和B组大鼠于同一时刻用等量的生理盐水灌胃,D组同一时间用等量的5.0%葡萄糖溶液灌胃。于4、8、12周分别测量各组生存大鼠的体质量和胰岛素抵抗。胰岛素抵抗:采用7170A全自动生化检测仪检测大鼠的空腹血糖(FPG)、空腹胰岛素(FINS),计算稳态胰岛素抵抗指数(HOMA-IR)。HOMA-IR=FINS×FPG/22.5。比较各组大鼠的FPG、FINS和 HOMA-IR。
1.2.2 大鼠视网膜VEGF的表达 于4、8、12周分别从A组和D组随机挑选4只大鼠,B和C组各随机挑选8只大鼠,观察视网膜的VEGF的表达,标本的制备方法如下:用10.0%的水合氯醛麻醉大鼠并在无菌条件下处死,摘取大鼠眼球,切除眼球前节,于显微镜下撕取大鼠的视网膜组织。组织切片用二甲苯脱蜡后用乙醇进行梯度水化,将切片放于柠檬酸缓冲液(10mL,pH=6.0)微波修复抗原5min。用3.0%的过氧化氢处理切片,清除过氧化物酶活性。将一抗滴注在处理好的切片上,室温下静置60min;用PBS冲洗切片,滴加二抗后在37℃水浴1h。兔抗鼠VEGF单克隆抗体(一抗,即用型)羊抗兔抗体(二抗,即用型)均由上海我武生物科技有限公司提供。用PBS冲洗切片后用二氨基联苯胺(DAB)溶液染色,之后用苏木精进行复染、切片脱水后封存。所有样本均分别进行2次染色和制片,显微镜下观察染色结果。免疫组织化学染色的评分结果[6]如下:0分,阴性(-),组织染色结果为阴性或仅有不到5.0%的细胞着色;1分,弱阳性(+),5.0%~<25.0%的细胞出现中等及以下的染色;2分,阳性(++),25.0%~50.0%的细胞出现中等程度的染色或10.0%~50.0%的细胞出现较强的染色;3分,强阳性(+++),超过50.0%的细胞出现较强程度的染色。
1.2.3 大鼠血清超氧化钠歧化酶(SOD)、谷胱甘肽(GSH)和IL-6的检测 大鼠在处死前经颈静脉取血2mL,置于抗凝试管中,分离血清。SOD检测采用氮蓝四唑(NBT)法,试剂盒由碧云天生物科技有限公司提供;GSH和IL-6检测均采用ELISA检测,试剂盒由上海信裕生物科技有限公司提供。
1.2.4 眼底检查 第12周末,B~D组大鼠在处死前进行眼底检查:大鼠滴注0.5%硫酸阿托品滴眼液进行散瞳后,在眼底镜下观察大鼠的视网膜新生血管的形成,评价标准如下[7]:Ⅰ期表现为视网膜有微动脉瘤或存在小出血点;Ⅱ期表现为视网膜存在黄白色“硬性渗出”有或无出血斑;Ⅲ期表现为视网膜出现白色“软性渗出”,伴或不伴有出血斑,上述Ⅳ~Ⅵ为单纯型糖疾病视网膜病变。Ⅳ期表现为视网膜出现新生血管,伴或不伴有玻璃体出血;Ⅴ期为眼底检查出现新生血管和纤维增生;Ⅵ期为在Ⅴ期的基础上出现视网膜脱落,上述Ⅳ~Ⅵ为增殖型糖疾病视网膜病变。
1.3 统计学处理 使用SPSS15.0软件进行数据处理,计量资料以表示,组间比较运用单因素方差分析,等级资料采用秩和检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 糖尿病大鼠的模型构建情况 72h后,B~D组大鼠模型构建成功,B组大鼠FPG为(21.72±4.28)mmol/L,C组为(21.54±4.96)mmol/L,D组为(21.83±4.77)mmol/L,差异无统计学意义(P>0.05);A组大鼠FPG为(4.57±0.15)mmol/L,与B、C、D组比较差异有统计学意义(P<0.05)。A组大鼠体质量(210.5±5.2)g,B组(211.2±5.7)g,C 组(209.8±5.8)g,D组(208.7±3.4)g,差异无统计学意义(P>0.05)。
2.2 各组大鼠体质量和胰岛素抵抗的变化 不同时刻各组大鼠的体质量、FPG、FINS和 HOMA-IR差异有统计学意义(P<0.05)。C组大鼠不同时刻的体质量、FPG、FINS和 HOMA-IR差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠体质量和FPG的变化()
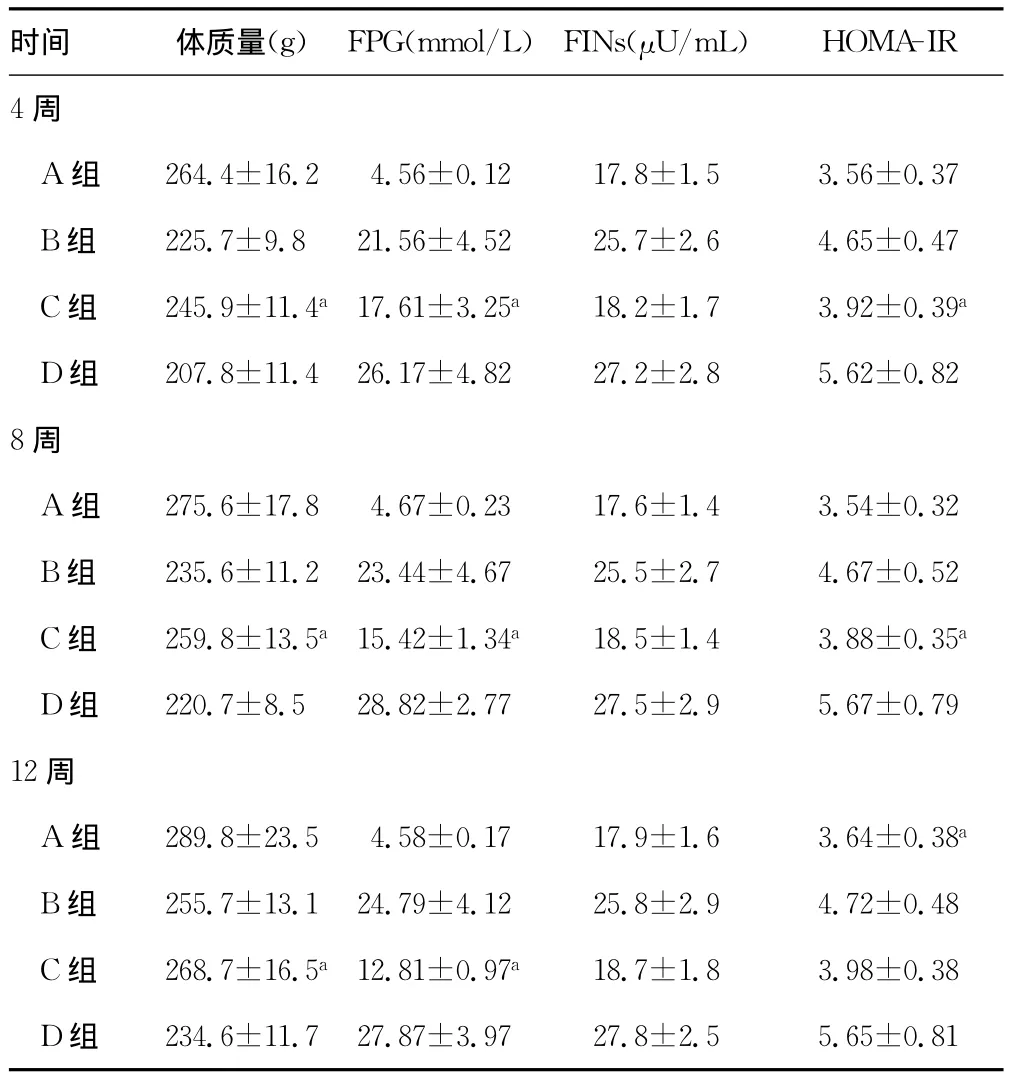
表1 各组大鼠体质量和FPG的变化()
a:P<0.05,大鼠不同时刻观察指标相互比较。
HOMA-IR 4时间 体质量(g) FPG(mmol/L) FINs(μU/mL)周A组 264.4±16.24.56±0.12 17.8±1.5 3.56±0.37 B组 225.7±9.821.56±4.52 25.7±2.6 4.65±0.47 C组 245.9±11.4a17.61±3.25a 18.2±1.7 3.92±0.39a D组 207.8±11.426.17±4.82 27.2±2.8 5.62±0.828周A组 275.6±17.84.67±0.23 17.6±1.4 3.54±0.32 B组 235.6±11.223.44±4.67 25.5±2.7 4.67±0.52 C组 259.8±13.5a15.42±1.34a 18.5±1.4 3.88±0.35a D组 220.7±8.528.82±2.77 27.5±2.9 5.67±0.7912周A组 289.8±23.54.58±0.17 17.9±1.6 3.64±0.38a B组 255.7±13.124.79±4.12 25.8±2.9 4.72±0.48 C组 268.7±16.5a12.81±0.97a 18.7±1.8 3.98±0.38 D组234.6±11.727.87±3.97 27.8±2.5 5.65±0.81
2.3 各组大鼠的SOD、GSH和IL-6水平变化 不同时刻的各组大鼠的SOD、GSH和IL-6水平具有统计学差异(P<0.05)。见表2。
表2 各组大鼠的SOD、GSH和IL-6水平变化()
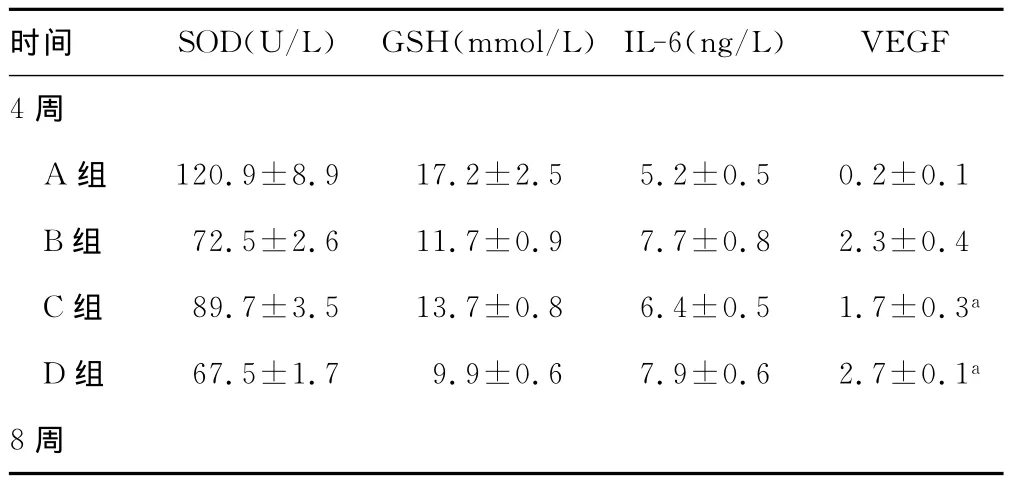
表2 各组大鼠的SOD、GSH和IL-6水平变化()
VEGF 4时间 SOD(U/L) GSH(mmol/L)IL-6(ng/L)周A组 120.9±8.917.2±2.55.2±0.50.2±0.1 B组 72.5±2.611.7±0.97.7±0.82.3±0.4 C组 89.7±3.513.7±0.86.4±0.51.7±0.3a D组 67.5±1.7 9.9±0.67.9±0.62.7±0.1a 8周
续表2 各组大鼠的SOD、GSH和IL-6水平变化()

续表2 各组大鼠的SOD、GSH和IL-6水平变化()
a:P<0.05,大鼠不同时刻的观察指标相互比较。-:此项无数据。
时间 SOD(U/L) GSH(mmol/L)IL-6(ng/L)120.4±11.217.1±1.95.1±0.60.1±0.1 B组 74.6±3.1 11.4±1.08.4±1.02.7±0.3 C组 98.7±2.9 14.5±1.16.2±0.31.5±0.2a D组 65.9±1.2 10.0±0.59.1±0.92.9±0.2a 12周A组 121.5±7.9 17.8±1.75.4±0.60.3±0.1 B组 73.6±2.8 11.5±0.98.5±0.92.8±0.5 C组 109.5±3.7 15.9±1.25.9±0.7 -D组VEGF A组55.9±1.6 10.1±0.410.2±1.5 -
2.4 各组大鼠的VEGF免疫组织化学染色评分 不同时刻的各组大鼠免疫组织化学染色评分差异有统计学意义(P<0.05),C组和D组大鼠不同时刻的免疫组织化学染色评分差异有统计学意义(Z=7.342,P<0.05)。见表2。
2.5 糖尿病大鼠的眼底检查结果 12周末,B、C、D组大鼠的眼底镜检查GR分期结果差异有统计学意义(P<0.05)。见表3。
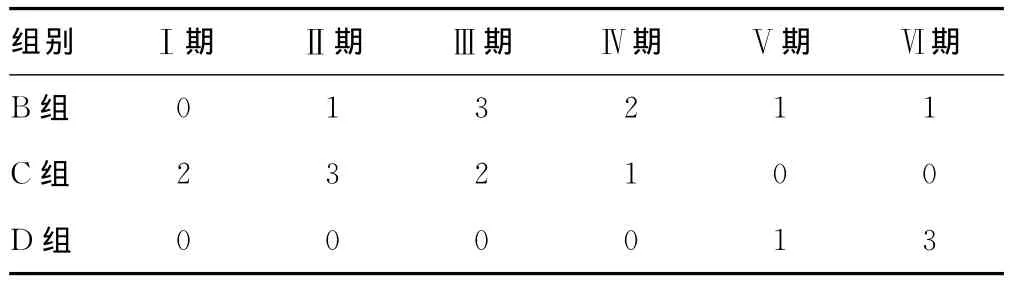
表3 不同GR分期糖尿病大鼠的眼底检查结果(n)
3 讨 论
随着生活水平的提高和饮食结构的改变,我国糖尿病的发生率逐渐提高,给我国的医疗卫生事业带了极大的负担。糖尿病患者可出现多种并发症,其中糖尿病视网膜病变是糖尿病微血管病变的最典型表现之一,可分为单纯型和增殖型,后者引起失明的可能性更大,增殖型突出表现为视网膜新生血管和纤维组织的形成,部分患者甚至出现视网膜的脱落,患者可出现视力的严重下降甚至失明[8]。
研究发现,糖尿病患者视网膜新生血管形成与视网膜组织中VEGF的表达和对血管内皮细胞的诱导作用密切相关,上述过程与糖尿病患者的氧化应激反应密切相关。因此作为一种多功能的强效抗氧化剂,α-LA在糖尿病视网膜病变的防治中具有一定的应用价值[9]。本次研究中,应用72只 Wistar大鼠作为研究对象,观察α-LA对糖尿病大鼠的视网膜病变和VEGF表达的影响。
实验应用STZ腹腔注射的方法构建糖尿病视网膜病变的大鼠模型,STZ是一种DNA烷基化试剂,对胰腺的胰岛β-细胞具较强的细胞毒性。STZ可以诱发多种动物的糖尿病模型,多用于大鼠和小鼠的糖尿病模型构建[10]。经过72h后,B~D组大鼠出现明显的高血糖,说明大鼠的糖尿病模型构建成功。
糖尿病视网膜病变发生的机制较为复杂,涉及多种因素的共同作用,糖尿病患者高血糖、血脂代谢异常和炎性反应共同作用,可以导致机体出现一系列的病理生理变化,包括内皮型一氧化氮合成酶(eNOS)活性的下降和一氧化氮的合成减少,血管内皮损伤和氧化应激的[11]。α-LA可以有效清除机体代谢差的活性氧物质及自由基、抑制脂质过氧化反应并改善eNOS活性,减轻血管内皮的损伤。同时,α-LA的应用可以改善机体的胰岛素抵抗,发挥降血糖的作用[12]。本次研究中,C组患者的HOMA-IR明显低于B组和D组。
与A组大鼠相比,B~D组的大鼠的SOD、GSH水平明显降低,说明糖尿病的体内存在较强的氧化应激反应;C组大鼠不同时刻的SOD活性和GSH水平均明显高于B组,高于D组,且随着时间的推移呈上升趋势,说明α-LA可以有效清除大鼠体内的氧化活性物质。C组视网膜组织VEGF表达水平较D组降低,说明α-LA可以抑制VEGF蛋白在视网膜上的表达,干预早期糖尿病视网膜病变的发生、发展。比较各组大鼠的IL-6水平,不同时刻C组的炎性反应程度低于B、D组。
大量研究发现,糖尿病视网膜病变患者视网膜的VEGF表达水平升高[13],高血糖可以激活蛋白激酶C介导的信号传导通路从而活化NADPH氧化酶,激活的NADPH氧化酶可以直接诱导活性氧的产生并上调VEGF的表达水平[14];同时,高血糖的刺激可以导致视网膜微小血管的损伤,导致供血供氧的不足,缺氧状态可促进VEGF的表达和新生血管的形成[15]。
综上所述,α-AL的应用可以有效抑制大鼠视网膜VEGF的表达,这一作用可能与改善胰岛素抵抗、抑制慢性炎症和氧化应激多个环节相关。同时,研究中,C组α-AL治疗大鼠的VEGF水平仍轻微高于A组健康大鼠,提示糖尿病视网膜病变可能与多个环节调控相关。
[1]翁建平.对糖尿病流行病学、循证医学及基础研究的探索[J].中山大学学报:医学科学版,2010,31(2):166-171,178.
[2]Zhang X,Saaddine JB,Chou CF,et al.Prevalence of diabetic retinopathy in the United States,2005-2008[J].JAMA,2010,304(6):649-656.
[3]郝燕燕,付蓉花,卢振威,等.α-硫辛酸对早期糖尿病性视网膜病变大鼠视网膜组织血管内皮生长因子和蛋白激酶-C表达的影响[J].郑州大学学报:医学版,2009,44(6):1201-1204.
[4]Nicholson BP,Schachat AP.A review of clinical trials of anti-VEGF agents for diabetic retinopathy[J].Graefes Arch Clin Exp Ophthalmol,2010,248(7):915-930.
[5]Inman DM,Lambert WS,Calkins DJ,et al.α-Lipoic acid antioxidant treatment limits glaucoma-related retinal ganglion cell death and dysfunction[J].PLoS One,2013,8(6):e65389.
[6]董宇,崔治华,宋鄂,等.糖尿病性视网膜病变血管内皮生长因子与糖基化终末产物的关系[J].中国老年学杂志,2011,31(14):2693-2695.
[7]胡利,李东豪,陈慧.糖尿病患者血糖控制相关因素与糖尿病视网膜病变发生的关系[J].中华眼底病杂志,2011,27(3):210-213.
[8]Moradian S,Ahmadieh H,Malihi M,et al.Intravitreal bevacizumab in active progressive proliferative diabetic retinopathy[J].Graefes Arch Clin Exp Ophthalmol,2008,246(12):1699-1705.
[9]Barber AJ,Gardner TW,Abcouwer SF.The significance of vascular and neural apoptosis to the pathology of diabetic retinopathy[J].Invest Ophthalmol Vis Sci,2011,52(2):1156-1163.
[10]Tang J,Kern TS.Inflammation in diabetic retinopathy[J].Prog Retin Eye Res,2011,30(5):343-358.
[11]易茜璐,于明香.糖尿病视网膜病变的发病机制[J].复旦学报:医学版,2010,37(5):604-607.
[12]Rochette L,Ghibu S,Richard C,et al.Direct and indirect antioxidant properties ofα-lipoic acid and therapeutic po-tential[J].Mol Nutr Food Res,2013,57(1):114-125.
[13]陈庆中,张静楷,黄利明,等.血管内皮生长抑制因子在糖尿病视网膜病变患者血清及玻璃体中的变化[J].中华实验眼科杂志,2013,31(12):1163-1168.
[14]SimóR,Sundstrom JM,Antonetti DA.Ocular Anti-VEGF therapy for diabetic retinopathy:the role of VEGF in the pathogenesis of diabetic retinopathy[J].Diabetes Care,2014,37(4):893-899.
[15]Hammes HP,Feng Y,Pfister F,et al.Diabetic retinopathy:targeting vasoregression[J].Diabetes,2011,60(1):9-16.
