单细胞聚团拟胚体形成诱导人多能干细胞造血分化的技术优化
2015-08-14徐鉴城段永娟孙仪
徐鉴城++++++段永娟++++++孙仪++++++杨洋++++++胡晓
[摘要] 目的 优化利用单细胞聚团拟胚体(Spin-EB)培养诱导人多能干细胞造血分化的方式。 方法 采用AggreWellTM 800及V-96孔板两种培养板形成Spin-EB,在骨形成蛋白-4(BMP-4)、血管内皮生长因子(VEGF)及碱性成纤维生长因子(bFGF)组合培养基中诱导造血分化,通过流式细胞术检测不同分化条件下CD34+细胞的比例;选取CD34+细胞比例高的拟胚体(EB)形成方式,并通过造血集落形成实验及红细胞分化培养实验,验证EB来源的CD34+细胞的造血集落形成和红系分化能力。 结果 流式分析结果显示,在AggreWellTM800培养板中培养所得的EB,其CD34+造血干祖细胞比例为22.6%,V-96孔板按照形成EB的细胞数目,CD34+造血干祖细胞比例分别为:3000个细胞/孔为10.8%、6000个细胞/孔为1.28%、9000个细胞/孔为1.23%。胚胎干细胞(ESC)来源的CD34+细胞形成的集落与脐带血CD34+造血干祖细胞形成的集落形态相似,并且在红系分化培养体系中分化为CD71+ CD235a+的红细胞。 结论 V-96孔板组EB形成和CD34+分化效率与用于EB形成的细胞数有相关性,3000个细胞/孔条件相对最优。采用AggreWellTM800培养板形成EB及EB的造血分化效率均高于各组V-96孔板分化效率。
[关键词] 胚胎干细胞;拟胚体;造血分化
[中图分类号] R329 [文献标识码] A [文章编号] 1673-7210(2015)06(a)-0009-05
Techniques optimizations of Spin-embroid body approach for hematopoietic differentiation of human pluripotent stem cell
XU Jiancheng DUAN Yongjuan SUN Yi YANG Yang HU Xiao
State Key Laboratory of Experimental Hematology, Institute of Hematology Blood Diseases Hospital of Chinese Academy of Medical Sciences, Tianjin 300020, China
[Abstract] Objective To optimize hematopoietic differentiation of human pluripotent stem cells via spin-embryoid body (Spin-EB). Methods AggreWellTM800 and V-96 well culture plate were used to form Spin-EB, which was successively induced to hematopoietic differentiation in culture medium contained BMP-4, VEGF and bFGF. Flow cytometry was used to analyze the proportion of CD34+ hematopoietic stem/progenitor cells under the two different culture conditions. The higher test was seleted to verify its colony forming ability and erythroid differentiation ability via colony forming unit assay and erythroid differentiation culture system. Results The flow cytometry results showed that the proportion of CD34+ hematopoieic stem/progenitor cells from AggreWellTM800 test was 22.6%, while the V-96 well test divided into three tests according to the number of ESC, the corresponding proportion were: 3000 cells/well was 10.8%, 6000 cells/well was 1.28%, 9000 cells/well was 1.23%. The morphology of the colony forming unit from CD34+ cells originated from embryonic stem cell (ESC) was as similar as the umbilical cord blood CD34+ cells. Simultaneously, CD34+ cells originated from ESC could differentiate into CD71+CD235a+ erythrocytes in erythroid differentiati-on culture system. Conclusion The forming ability of EB and the hematopoietic differentiation efficiency of CD34+ cells is related to the number of ESC seeded in V-96 well culture plate, among which the 3000 cells/well test is relatively prestigeous. Furthermore, compared with the three tests of V-96 well, EB from AggreWellTM800 test has a better EB forming ability and higher hematopoietic differentiation efficiency of CD34+ cells.
[Key words] Embryonic stem cells; Spin-EB; Hematopoietic differentiation
造血干细胞移植是治疗许多血液系统疾病的最有效的方法,但由于造血干细胞来源有限,在临床治疗应用中受到了极大的限制[1-3]。利用多能干细胞体外诱导造血分化获得造血干细胞是解决这一难题的方法之一[4-5]。胚胎干细胞(ESC)是指从早期未分化的胚胎内细胞团中获得的一类多能干细胞。在体外培养过程中,具有无限增殖、自我更新和多向分化等特性。在体外能够分化为除胎盘以外的几乎全部成体组织细胞类型[6-8],因而成为研究从多能干细胞获得包括造血干细胞在内的组织细胞的重要工具[9-10]。
在诱导多能干细胞分化的多种技术之中,利用拟胚体形成(embryoid body,EB)是一类重要的方法[11-12]。与传统的基质细胞共培养诱导分化相比[13-14],EB形成诱导分化具有多种优势。包括易于扩大培养规模,可明确培养基成分易于培养的标准化,采用单细胞离心聚团形成的EB[单细胞聚团拟胚体(Spin-EB)]还具有可控细胞数目并进行外源基因导入等操作的优势,逐渐成为这一方法的技术主导。在实际应用中,这一技术受多种因素的影响,包括EB形成的培养介质,细胞因子组合及EB形成细胞数量及分化时间等。因此,本研究旨在比较商业化的AggreWellTM800培养板及普通V-96孔培养皿,以及不同的细胞数量对于多能干细胞形成的EB效率及进一步造血分化效率的影响,优化多能干细胞造血分化条件,为实现规模化标准化获得优质的造血干祖细胞提供技术基础。
1 材料与方法
1.1 试剂与仪器
H1ES和IPS细胞系由中科院广州生命健康研究所潘光锦实验室惠赠。mTeSR1培养基、Dispase消化液、Accutase消化液、AggreWellTM800培养板、H4435、H4436(Stem Cell公司),StemlineⅡ培养基(Sigma公司),双抗(Gibco公司),ROCK抑制剂(Y27632)(R&D公司),骨形成蛋白-4(BMP4)、血管内皮生长因子(VEGF)和碱性成纤维生长因子(bFGF)(Peprotech公司),流式抗体鼠抗人CD34-APC、鼠抗人CD71-PE、鼠抗人CD235a-APC(eBiosciences公司),V-96孔板和低吸附24孔板(康宁公司)。倒置显微镜(Nikon TS100)(日本尼康公司),流式细胞分析所用的仪器为CantoⅡ(美国BD公司),台式离心机(centrifuge5810R)(Eppendorf公司)。
1.2 AggreWellTM800中拟胚体的形成
将P60至81代用mTeSR1无基质细胞培养的H1ESC集落用Accutase消化液消化为单细胞,计数,按每个AggreWellTM800培养板孔中加入1×106个细胞,加入EB形成培养基,EB形成培养基为加入50 ng/mL的BMP4、VEGF和Y27632的StemlineⅡ。按产品使用操作手册,将AggreWellTM800培养板低速离心700 r/min,5 min,放入20%CO2,5%O2低氧培养箱中培养。48 h后将形成的EB转移至低吸附24孔板中进行形态观察,EB计数和诱导造血分化。
1.3 V-96孔板中拟胚体的形成
ESC的培养及细胞处理同上。细胞计数后,重悬于EB形成培养基,分三组在V-96孔板中加入细胞。第1组每个孔中加入3000个细胞,第2组每个孔中加入6000个细胞,第3组每个孔加入9000个细胞,低速离心700 r/min,5 min,放入20%CO2,5%O2低氧培养箱中培养。48 h后将形成的EB转移至低吸附24孔板中进行形态观察,EB计数和诱导造血分化。
1.4 Spin-EB的造血分化诱导
将两种培养介质形成的Spin-EB重悬于造血分化培养基,加入低吸附24孔板中。造血分化培养基为加入50 ng/mL的BMP4和VEGF,20 ng/mL的bFGF的StemlineⅡ。放入20%CO2,5%O2低氧培养箱中培养。连续培养5 d,并于第3天补充新鲜造血分化培养基。
1.5 造血分化Spin-EB CD34+检测
将上述条件形成的Spin-EB经造血分化培养后收集,加入胰蛋白酶消化为单细胞。将适量单个细胞悬浮溶于100 μL PBS中,加入鼠抗人单克隆抗体:anti-CD34-APC。室温避光孵育15 min,2 mL PBS洗1次,400 μL PBS重悬细胞,BD CantoⅡ流式细胞仪检测CD34+细胞的比例,用FlowJo 7.6软件分析流式检测结果。
1.6 集落形成实验
将造血分化诱导后的EB消化为单个细胞,计数2×104~5×104个接种于H4435培养基中,培养14 d,观察造血集落形态。
1.7 红系分化实验
将造血分化诱导后的EB消化为单个细胞,取3×105个细胞进行红系诱导分化。具体培养方法参见文献[15-17]。
2 结果
2.1 两种培养方式下形成的Spin-EB数量与形态比较
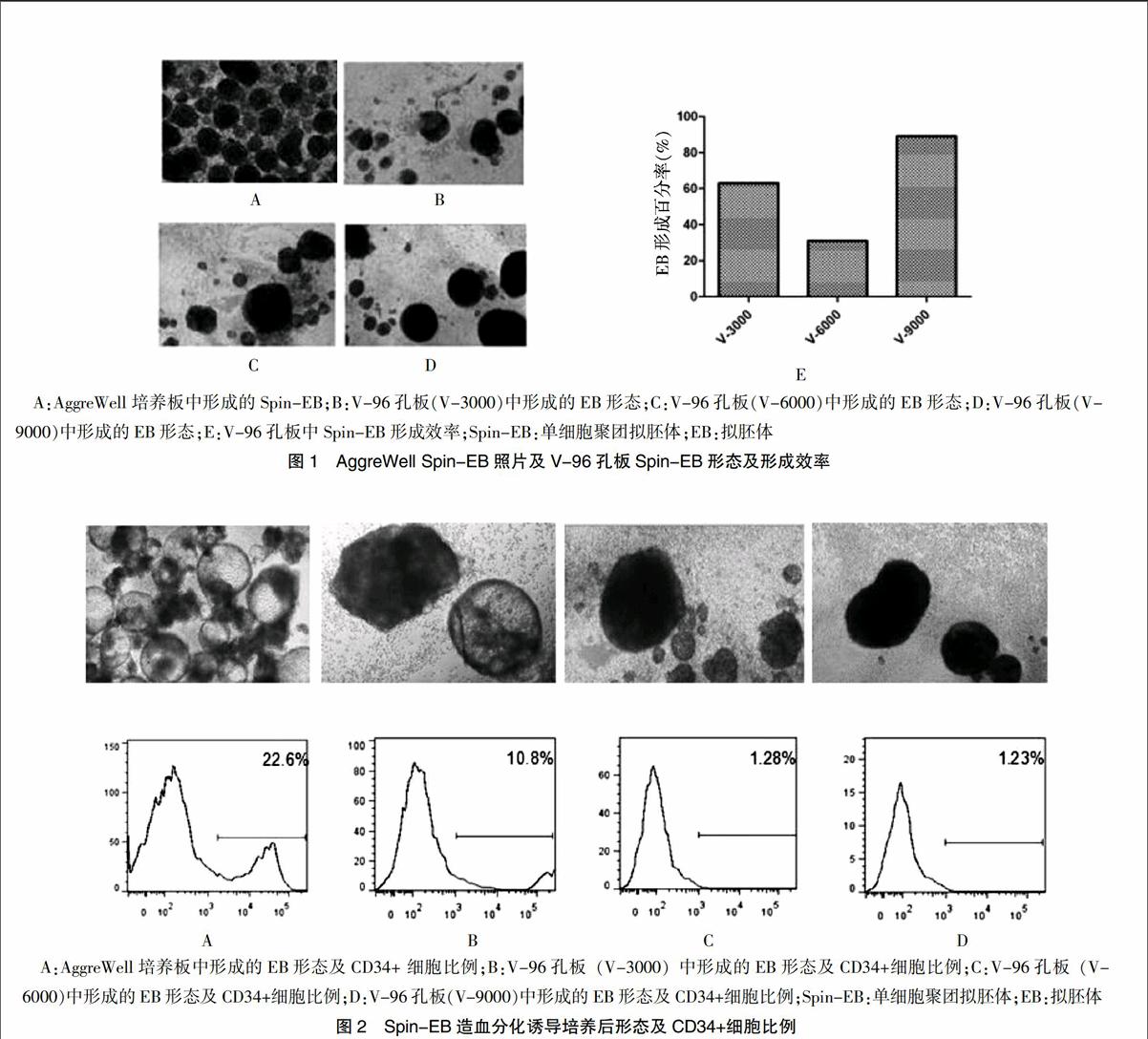
将在AggreWellTM800及V-96孔板上形成的EB分别收集后计数并在光学显微镜下进行形态观察。AggreWellTM800培养板每一培养孔中有300个EB形成小室,形成的EB效率>90%,且形成的EB大小均匀,形态较为均一(图1A)。在V-96孔板中按照每孔加入3000、6000、9000个细胞(V-3000、V-6000、V-9000),EB大小受加入的细胞数影响,且大小和形态上不均匀,EB形成效率分别为63%,31%和89%(图1B~E)。
2.2 Spin-EB诱导造血分化后CD34+细胞的比例
将上述两种培养介质中形成的Spin-EB转入低吸附24孔板,并加入诱导造血分化的细胞因子组合,诱导分化培养5 d后,光学显微镜下观察分化EB的形态特征并收集EB消化为单细胞后流式分析CD34+细胞比例。结果显示,AggreWellTM800培养板中形成的Spin-EB中诱导造血分化后EB呈分化良好的三维囊状空泡,CD34+细胞的比例为22.6%(图2A);V-96孔板形成的Spin-EB中,除3000个细胞/孔的EB中有部分分化良好的三维囊状空泡形态,6000、9000细胞/孔的EB均呈现为分化不良的实心结构。CD34+分析,3000个细胞/孔为10.8%、6000个细胞/孔为1.28%、9000个细胞/孔为1.23%(图2B~D)。
2.3 Spin-EB来源CD34+造血集落形成和红系分化能力
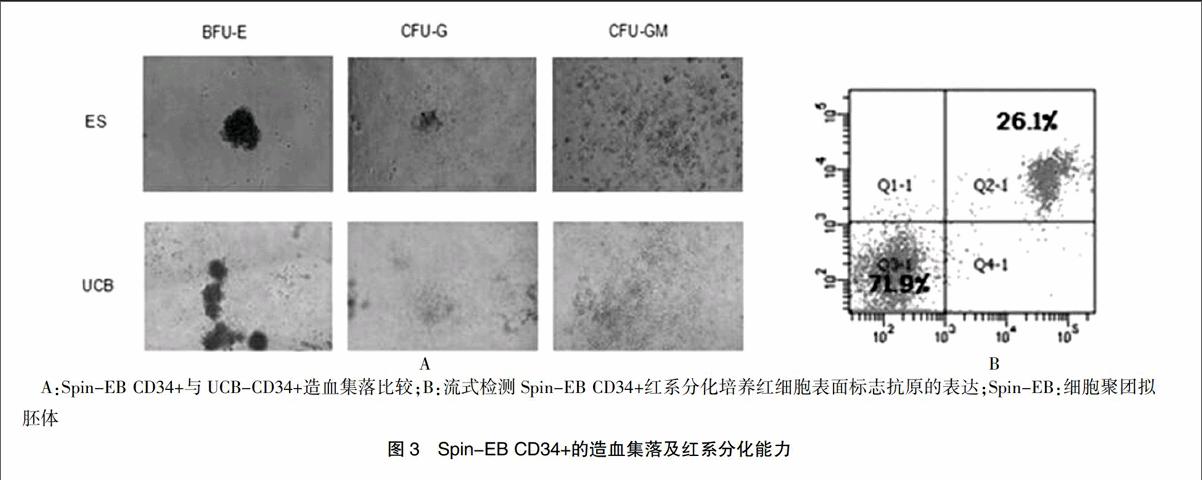
为证明上述Spin-EB来源的CD34+细胞具有造血分化能力,将造血分化诱导第5天的EB消化为单细胞后分别加入造血集落形成半固体培养基,以及红细胞分化诱导培养基。图3A所示,以脐带血UCB-CD34+造血集落作为对照,Spin-EB来源的CD34+细胞所形成的BFU-E,CFU-G和CFU-G三种集落的形态与UCB形成的此三种集落相似;红系诱导分化培养10 d后收集细胞经流式细胞仪分析发现,细胞培养中有26%的细胞表达红细胞标志抗原CD71和CD235a,说明Spin-EB来源的CD34+具有形成造血集落和向红系分化的能力。见图3。
3 讨论
ESC能够无限增殖和多向分化的能力多年来一直都是生物医学研究的重点,其中ESC在体外诱导分化为成熟类型细胞更是重中之重。通过诱导其向造血细胞分化,是有效解决临床治疗中造血干细胞短缺的有效方法之一。通过研究其向特定细胞分化的过程可以帮助建立疾病模型,用于研究疾病的发病机制,可以帮助开发治疗方案,也可以研究生物体在发育过程中基因的表达调控等复杂的生理过程[18-20]。EB的形成是ESC进行体外诱导分化的关键步骤之一,悬滴法和基质细胞共培养法是形成EB的常规方法,但这两种方法都十分不利于进行外源基因转染等分子生物学方面的操作,难以进行分子水平上的研究。本研究采用将ESC消化为单细胞进行EB培养的方法,此培养方法不仅培养基成分明确,而且能准确地掌握细胞数,同时也方便进行分子生物学方面的操作。
AggreWellTM800培养板是StemCell公司生产的可用于单细胞法培养EB的培养板,本研究中采用的是AggreWellTM800型,每个培养孔有300个小孔。在每个孔中加入1×106个ESC时,每个小孔中大约有3000个细胞;V-96孔板是一种普通的可用于酶联免疫研究的培养板,其与AggreWell培养板相比具有相似的空间形态,因此在用V-96孔板进行EB培养时,从每孔3000个细胞为起始,同时设置6000和9000个细胞组。从形态上看AggreWellTM800培养板中形成的EB,经过在低吸附24孔板中再培养5 d后,不仅数量多而且发育更为成熟,经过同样的培养,V-96孔板中3000个细胞形成的EB在大小上与AggreWellTM800培养板中形成的EB最为相似,但是没有形成明显的囊状EB,9000个细胞形成的EB虽然形成率较高,但是分化效率较低。流式细胞仪分析结果显示,AggreWellTM800培养板形成的EB CD34+细胞的比例达到了22.6%,V-96孔板中3000个细胞组形成的EB CD34+细胞的比例是V-96孔板中形成的EB中最高的,比例为10.8%。根据流式结果选择AggreWellTM800培养板中形成的EB进行造血集落形成和红系诱导分化实验,其BFU-E,CFU-G和CFU-GM三种集落的形态与对照组UCB形成的集落形态相似;经红系诱导分化,有26.1%的细胞表达红细胞标志抗原CD71和CD235a。同时,在AggreWellTM800培养板中用IPS细胞进行试验,经过相同的培养时间,IPS形成的EB CD34+细胞阳性率为38.2%。
综上所述,利用商品化的AggreWellTM800培养板可以较高效率地形成EB并诱导造血分化,但是AggreWellTM800培养板的缺点在于价格比较昂贵,不利于进行大规模实验,相比之下V-96孔板虽然在EB形成效率和分化上不及AggreWellTM800培养板组,但是V-96孔板价格十分便宜,尤其适合大规模实验,因此V-96孔板中形成EB的体系也十分值得进一步优化。
[参考文献]
[1] Hequet O. Hematopoietic stem and progenitor cell harvesting:technical advances and clinical utility [J]. J Blood Med,2015,6:55-67.
[2] Mazini L,Matar N,Bouhya S,et al. Umbilical cord blood banking for transplantation in morocco: problems and opportunities [J]. J Stem Cell Regen Med,2015,10(2):28-37.
[3] Tamari R,Castro-Malaspina H.Transplant for MDS: challenges and emer-ging strategies [J]. Best Pract Res Clin Heamatol,2015,28(1):43-54.
[4] Liu S,Xu Y,Zhou Z,et al. Progress and challenges in generating function hematopoietic stem/progenitor cells from human pluripotent stem cells [J]. Cytotherapy,2015,17(4):344-358.
[5] Daley GQ. Deriving blood stem cells from pluripotent stem cells for research and therapy [J]. Best Pract Clin Haematol,2014,27(3-4):293-297.
[6] Thomson JA,Itskovitz-Eldor,Shapiro SS,et al. Embryonic Stem Cell Line Derived from Human Blastocytst [J]. Science,1998,282(5391):1145-1147.
[7] Ware CB,Nelson AM,Mecham B,et al. Derivation of naive human embryonic stem cells [J]. Proc Natl Acad Sci,2012, 111(12):4484-4489.
[8] Van Orman JR,Si-Tayeb K,Duncan SA,et al. Induction of cardiomyogenesis in human embryonic stem cells by human embryonic stem cell-derived Definitive endoderm [J]. Stem Cells Dev,2012,21(6):987-994.
[9] Tesarova L, Stejskal S, Koutna I. Driven hematopoietic differentiation of embryonic stem cells: epigenetic perspectives [J]. Curr Pharm Des,2014,20(11):1674-1686.
[10] Forte L, Berardi AC. Stem cell technologies based on hemangioblast technology focusing on human blood cells [J]. Recent Pat Drug Deliv Formul,2013,7(1):4-8.
[11] Kurosawa H. Methods for inducing embryoid body formation:in vitro differentiation system of embryonic stem cells [J]. J Biosci Bioeng,2007,103(5):389-398.
[12] Weitzer G. Embryonic stem cell-derived embryoid bodies: an in vitro model of eutherian pregastrulation development and early gastrulation [J]. Handb Exp Pharmacol,2006,(174):21-51.
[13] 张绪超,陈惠芹,黄绍良,等.含人AGM区基质细胞培养体系定向诱导胚胎干细胞为造血干细胞的实验研究[J].中国病理生理杂志,2007,23(9):1747-1751.
[14] Lee KY,Fonq BS,Tsang KS,et al. Fetal stromal niches enhance human Embryonic stem cell-derived hematopoietic differentiation and glob-in switch [J]. Stem Cells Dev,2011,20(1):31-38.
[15] Hu J,Liu J,Xue F,et al. Isolation and functional characterization of human erythroblasts at distinct stages:implications for understanding of normal and disorder erythropoiesis in vivo [J]. Blood,2013,121(16):3246-3252.
[16] Grover A,Mancini E,Moore S,et al. Erythropoietin guides multipotent hematopoietic progenitor cells toward an erythroid fate [J]. J Exp Med,2014,211(2):181-188.
[17] Smith BW,Rozelle SS,Leung A,et al. The aryl hydrocarbon receptor directs hematopoietic progenitor cell expansion and differentiation [J]. Blood,2013,122(3):376-385.
[18] 沈干,汪铮,丛笑倩,等.组织工程中的新型种子细胞——胚胎干细胞[J].国外医学:生物医学工程分册,2001,24(3):97-101.
[19] Zavazava N. Progress toward establishing embryonic stem or induced pluripotent stem cell-based clinical translation [J]. Curr Opin Organ Transplant,2014,19(6):598-602.
[20] Vallier L, Pedersen RA. Human embryonic stem cells:an in vitro model to study mechanisms controlling pluripotency in early mammalian development [J]. Stem Cell Rev,2005, 1(2):119-130.
(收稿日期:2015-02-25 本文编辑:苏 畅)
