藜麦愈伤组织诱导体系优化研究
2015-07-31俞涵译蒋玉蓉毛泽阳等
俞涵译 蒋玉蓉 毛泽阳等

摘要:以9个藜麦(Chenopodium quinoa Willd.)品种为材料,对藜麦茎段、子叶不同外植体的愈伤组织诱导效果进行比较,同时对茎段的愈伤组织诱导以及愈伤组织增殖体系进行优化试验。结果表明:诱导愈伤组织最佳外植体为茎段,9个品种在培养基MS+0.5mg/L 2,4-D中用茎段诱导愈伤组织的平均诱导率达90%;在愈伤组织诱导优化试验中,处理Ⅵ(MS+0.5 mg/L 2,4-D+0.5 mg/L KT+0.5mg/L NAA)和处理Ⅱ(MS+0.5 mg/L 2,4-D)对藜麦愈伤组织的诱导率相近,但是愈伤形态差别较大,后者诱导形成疏松、有光泽、黄白色愈伤组织,因此MS+0.5 mg/L 2,4-D培养基为最佳愈伤组织诱导培养基;2,4-D与KT、NAA搭配使用时,愈伤组织增殖速率明显上升。
关键词:藜麦;组织培养;愈伤组织诱导;增殖率
中图分类号: Q943.1 文献标志码: A
文章编号:1002-1302(2015)03-0026-04
藜麦(Chenopodium quinoa Willd.)别称南美藜、藜谷、奎奴亚藜等,是1年生藜科草本作物,在安第斯山脉已有5 000多年的种植历史,被印加人称为“谷物之母” “安第斯山的真金”[1-2]。藜麦中蛋白质含量为13%~23%,含有人体必需的9种氨基酸且比例平衡,富含不饱和脂肪酸、类黄酮、维生素E等多种有益化合物,是联合国粮农组织(FAO)推荐的唯一的单体植物就可以满足人体全部基本物质需求的完美全营养食品,被誉为“未来的超级谷物”“营养黄金”“有机谷类之王”[3-4]。藜麦喜热带、亚热带干湿气候,生长适温14.0~18.0 ℃,营养生长阶段可耐轻度霜冻(-1.0~0 ℃),种子结实之后可耐-6.0 ℃低温,对盐碱、干旱、霜冻、病虫害等抗性能力都很强[5]。 1987年西藏自治区农牧学院、西藏自治区农牧科学院开始藜麦引种试验[6]。目前藜麦在陕西省西安市、山西省、青海省、四川省等地区均有规模化种植。目前,关于藜麦的研究主要集中在生物学特性[6-7]、化学成分[8-9]、抗逆性等生理学特性[10-11]方面。有关藜麦组织培养研究尚未见报道。本研究对9个藜麦品种进行适宜外植体筛选,研究不同激素处理组合对藜麦茎段愈伤组织诱导、增殖的影响,旨在为藜麦再生体系构建,以及通过转基因、体细胞杂交等手段获得藜麦新品种奠定生物学基础。
1 材料与方法
1.1 材料
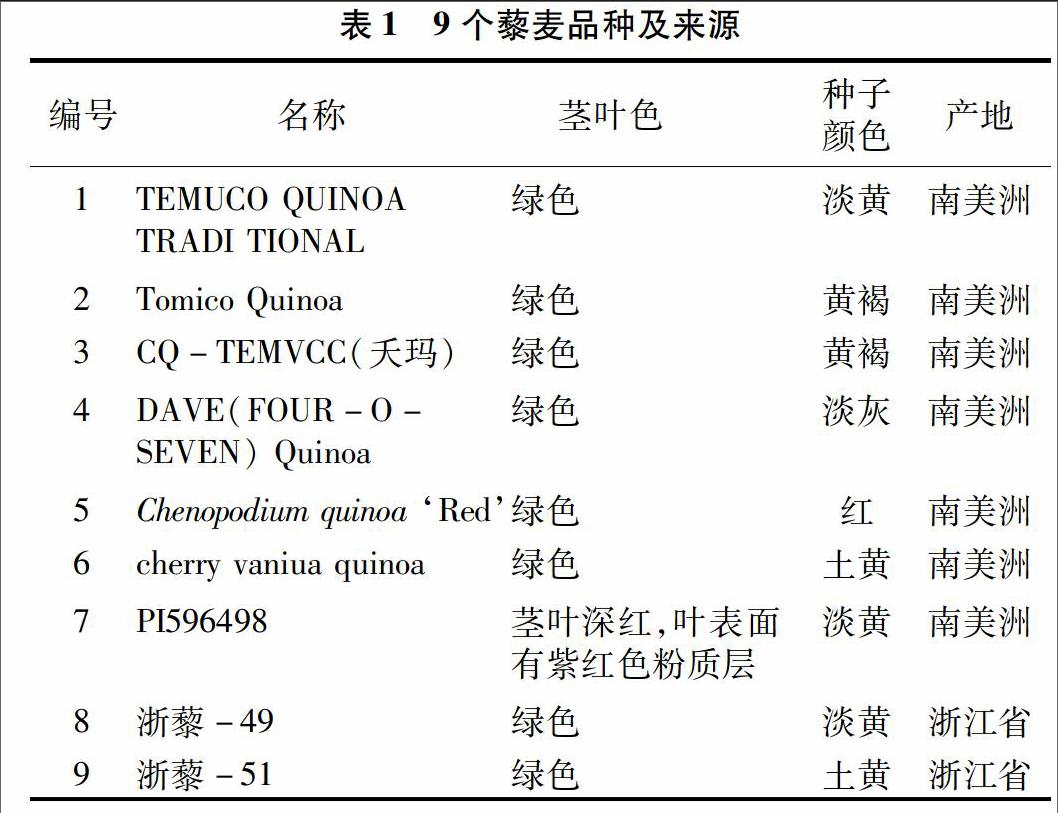
选取大田种植的9个藜麦品种进行试验,包括TEMUCO QUINOA TRADI TIONAL、CQ-TEMVCC(夭玛)、Chenopodium quinoa ‘Red、PI596498、Tomico Quinoa、cherry vaniua quinoa、DAVE(FOUR-O-SEVEN) Quinoa、浙藜-49、浙藜-51(表1)。所有品种种子均由浙江农林大学提供。
1.2 藜麦无菌苗的培育
挑选饱满种子在38 ℃恒温水浴锅中加热3 h,冷却至室温,用75%乙醇消毒1 min,用0.2% HgCl2溶液消毒5 min,再用无菌水冲洗4~5次。无菌条件下,将消毒过的种子接种到不含激素的MS培养基中,24 ℃暗培养3~4 d,16 h/8 h 光照周期下培养3 d,获得无菌苗备用。
1.3 外植体的处理
将无菌苗的茎段剪成长1.0 cm的小段,子叶切成0.5 cm×0.5 cm大小,分别放入培养基MS+0.5 mg/L 2,4-D中进行愈伤组织诱导,重复3次。在24 ℃、16 h/8 h光照周期下培养28 d,统计每个品种不同外植体愈伤组织的诱导率及生长情况。诱导率计算公式如下:诱导率=形成愈伤组织的外植体数/接种外植体数×100%。
1.4 愈伤组织诱导优化试验
选择TEMUCO QUINOA TRADI TIONAL、浙藜-51、浙藜-49 等3个品种无菌苗茎段,在无菌条件下切成长约 1.0 cm 的片段,接种到MS基本培养基+不同激素处理的培养基上(表2),每个品种接种3个培养基作为重复。
1.5 愈伤组织增殖优化试验
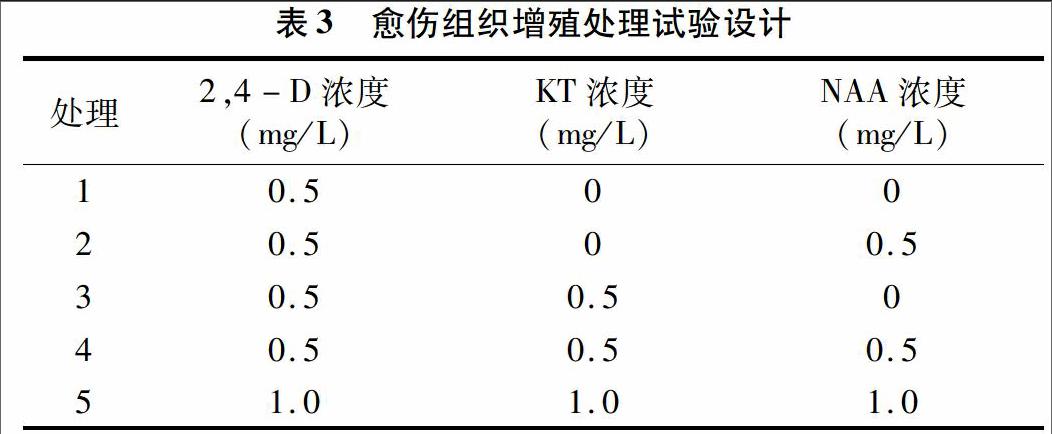
将TEMUCO QUINOA TRADI TIONAL、浙藜-51、浙藜-49这3个品种培养12 d的初代愈伤组织切成0.3 g的小块(m1),接种到表3中的培养基中进行继代培养。每处理接种3瓶,每瓶接种4块愈伤组织,每处理总计12块。20 d后,取出愈伤组织称量鲜质量(m2),以愈伤组织增殖率为指标进行最佳培养基筛选(表3)。
1.6 数据分析
运用Excel、SPSS软件分析数据。
2 结果与分析
2.1 愈伤组织外植体的选择
将消毒的茎段、子叶接种到培养基上,2 d后外植体切口处变褐,4~5 d后外植体开始膨胀,7 d左右开始有肉眼可见的乳白色、黏稠状的愈伤组织出现,外植体开裂伸长,28 d时未诱导出愈伤组织的外植体不再产生愈伤组织。不同品种之间愈伤组织的诱导率存在差异,相同品种不同外植体的愈伤组织诱导率也不同。由图1可以看出,9个藜麦品种的茎段愈伤诱导率均在78%以上,平均诱导率为90%;子叶愈伤组织诱导率仅在58%以上,平均诱导率为80%。cherry vaniua quinoa、Tomico Quinoa、浙藜-51、chenopodium quinoa ‘Red茎段的愈伤组织出愈率明显高于子叶。TEMUCO QUINOA TRADI TIONAL、CQ-TEMVCC(夭玛)、chenopodium quinoa ‘Red茎段愈伤组织诱导率达100%。由此可见,藜麦愈伤组织诱导敏感性存在品种差异。虽然用茎段、子叶均能诱导出愈伤组织,但茎段更适合用作诱导愈伤组织的外植体。
2.2 愈伤组织诱导优化分析
在藜麦愈伤组织诱导过程中,激素种类、浓度对愈伤组织诱导起重要作用。由表4可以看出,不同组合处理下同一品种愈伤组织诱导率有很大不同,如TEMUCO QUINOA TRADI TIONAL在处理Ⅱ、Ⅵ中愈伤组织诱导率达100%,而在处理Ⅳ、Ⅷ中低于20%。TEMUCO QUINOA TRADI TIONAL在各种处理下的愈伤组织诱导率均明显高于浙藜-49、浙藜-51。随着2,4-D浓度的升高,3个试验品种的诱导率在一定范围内均呈下降趋势。2.0 mg/L 2,4-D处理下浙藜-49、浙藜-51诱导率下降至0。在2,4-D激素基础上施加不同浓度的KT、NAA,结果发现,不同处理下不同藜麦品种的愈伤组织诱导率变化趋势同2,4-D单激素处理类似。3个品种在处理Ⅱ、Ⅵ的愈伤组织诱导率均值为89%~90%,但在前者处理下,3个品种得到的愈伤组织状态均为湿润、乳白色、疏松的,后者处理下3个不同品种均产生干燥、墨绿色、紧密的愈伤组织(图2)。因此在愈伤组织诱导优化试验中,综合诱导率与出愈状态,处理Ⅱ为最理想的培养基。
2.3 愈伤组织生长增殖优化结果分析
将愈伤组织接种到不同激素处理的培养基中培养20 d,称量接种前后的愈伤组织质量,可以获得不同激素处理对愈伤组织增殖的影响。从表5可以看出,不同品种愈伤组织增殖率存在很大差异,增殖率为52%~268%,愈伤组织的增殖率不仅与培养基激素组分有关,也与品种特性有关。TEMUCO QUINOA TRADI TIONAL的愈伤组织生长较快,不同处理下增殖率较高,均值达158%。浙藜-51的愈伤组织生长相对较慢,不同处理下增殖率均值仅为76%。浙藜-51愈伤组织诱导能力优于浙藜49,增殖能力劣于后者。3个藜麦品种在单激素处理Ⅰ(MS+0.5 mg/L 2,4-D)下平均增殖率为71%,在双激素处理Ⅱ(MS+0.5 mg/L 2,4-D+0.5 mg/L NAA)以及Ⅲ(MS+0.5 mg/L 2,4-D+0.5 mg/L KT)下平均增殖率均提高;3个藜麦品种在处理Ⅳ、Ⅴ下愈伤组织的增殖效果最明显,均值分别达161%、134%。TEMUCO QUINOA TRADI TIONAL在处理Ⅳ下愈伤组织增殖率达268.3%,但在处理Ⅴ下增殖率下降到180.8%,可以看出激素浓度的增加对其增殖具有一定抑制作用。因此,相比而言,处理Ⅳ(0.5 mg/L 2,4-D+0.5 mg/L KT+0.5 mg/L NAA)较为适宜。
3 结论与讨论
开展组织培养研究对于藜麦优良种质资源保存、新品种选育以及遗传学特征研究等具有十分重要的意义[12]。本试验中9个藜麦品种均能诱导出愈伤组织,但不同品种对组培条件的敏感性存在一定差异。因此在构建藜麦愈伤组织培养体系时,既要考虑共性问题,又要顾及到各自的基因型特点[13]。藜麦的子叶、茎段均能诱导出愈伤组织,相比而言,后者的诱导效果优于前者,这与安桂花等对高山红景天[14]、芦婕等对盾叶薯蓣[15]、莫英等对盾叶薯蓣[16]、张勃等对紫花苜蓿[17]、肖荷霞等对紫花苜蓿[18]的研究结果一致。植物激素是调控植物器官产生愈伤组织及其分化最主要的影响因素[19-20]。2,4-D是组织培养中常用的植物生长调节剂,主要起诱导愈伤组织形成、促进生根等作用,在植物组织培养中广泛使用[21]。本研究表明,3个藜麦品种在0.5 mg/L 2,4-D处理下,愈伤组织诱导率最高,随着2,4-D浓度的增加,愈伤组织诱导率呈下降趋势。邢小明等研究发现,2,4-D浓度在0.10~1.00 mg/L时,波叶红果树叶片愈伤组织诱导率随着激素浓度升高而升高,2,4-D浓度过高对愈伤组织诱导产生明显的抑制作用[22]。代亮等研究发现,3 mg/L 2,4-D处理下,12个草地早熟禾品种愈伤组织诱导率均值达86%[23]。许明子等在NB培养基上添加2 mg/L 2,4-D,发现水稻愈伤组织诱导率达80%以上[24]。由此可以看出,不同浓度2,4-D对愈伤组织诱导率影响很大。朱祝英等研究发现,MS+2,4-D培养基处理下,香蕉叶片诱导率高达100%,加入其他生长素或细胞分裂素如NAA、KT、6-BA等香蕉叶片诱导率均有所降低[25]。本研究结果表明,处理Ⅵ(MS+05 mg/L 2,4-D+0.5 mg/L KT+0.5mg/LNAA)和处理Ⅱ(MS+0.5 mg/L 2,4-D)对藜麦愈伤组织的诱导率相近,但是愈伤形态差别较大,后者诱导形成疏松、有光泽、黄白色愈伤组织,因此MS+0.5 mg/L 2,4-D培养基是最佳的愈伤组织诱导培养基。这与前人研究结果[26-27]不一致,可能是由于不同植物愈伤组织形成所需要的激素种类不同。组培体系中,愈伤组织增殖速度关系到组培体系效率,在转基因研究中尤其如此[23]。孙瑞明等研究发现,在增殖阶段,香竹愈伤组织对 2,4-D的依赖程度没有诱导阶段强,但仍须维持一定浓度,低浓度KT、NAA对香竹愈伤的增殖有良好的效果[28]。高丽丽等研究表明,籼稻愈伤组织的增殖不仅与愈伤组织的生长状态以及培养基组分有关,还与品种特性有关[29]。本研究结果表明,处理Ⅳ(MS+0.5 mg/L 2,4-D+0.5 mg/L KT+0.5 mg/L NAA)下,3个藜麦品种愈伤组织增殖率达90.8%~268.3%,TEMUCO QUINOA TRADI TIONAL的愈伤组织增殖率明显高于浙藜51、浙藜49。
参考文献:
[1]朱剑宏. 南美藜的化学组成和营养价值[J]. 成都大学学报:自然科学版,2002,21(2):24-28.
[2]Vega-Gálvez A,Miranda M,Vergara J,et al. Nutrition facts and functional potential of quinoa (Chenopodium quinoa Willd.),an ancient Andean grain:a review[J]. Journal of the Science of Food and Agriculture,2010,90(15):2541-2547.
[3]Oshodi A A,Ogungbenle H N,Oladimeji M O. Chemical composition,nutritionally valuable minerals and functional properties of benniseed (Sesamun radiatum),pearl millet (Pennisetum typhoides) and quinoa (Chenopodium quinoa) flours[J]. International Journal of Food Sciences & Nutrition,1999,50:325-331.
[4]Comai S,Bertazzo A,Bailoni L,et al. The content of proteic and nonproteic (free and protein-bound) tryptophan in quinoa and cereal flours[J]. Food Chemistry,2007,100(4):1350-1355.
[5]Jacobsen S E,Mujica A,Jensen C R. The resistance of quinoa (Chenopodium quinoa Willd.) to adverse abiotic factors[J]. Food Reviews International,2003,19(1/2):99-109.
[6]贡布扎西,旺 姆,张崇玺,等. 南美藜在西藏的生物学特性表现[J]. 西南农业学报,1994,7(3):54-62.
[7]Meneguetti Q A,Brenzan M A,Batista M R,et al. Biological effects of hydrolyzed quinoa extract from seeds of Chenopodium quinoa Willd.[J]. Journal of Medicinal Food,2011,14(6):653-657.
[8]Abugoch J L. Quinoa (Chenopodium quinoa Willd.):composition,chemistry,nutritional,and functional properties[J]. Advances in Food and Nutrition Research,2009,58:1-31.
[9]Ogungbenle H N. Nutritional evaluation and functional properties of quinoa (Chenopodium quinoa) flour[J]. International Journal of Food Sciences and Nutrition,2003,54:153-158.
[10]Ruiz-Carrasco K,Antognoni F,Coulibaly A K,et al. Variation in salinity tolerance of four lowland genotypes of quinoa(Chenopodium quinoa Willd.)as assessed by growth,physiological traits,and sodium transporter gene expression[J]. Plant Physiology and Biochemistry,2011,49(11):1333-1341.
[11]Hariadi Y,Marandon K,Tian Y,et al. Ionic and osmotic relations in quinoa (Chenopodium quinoa Willd.) plants grown at various salinity levels[J]. Journal of Experimental Botany,2011,62(1):185-193.
[12]Jacobsen S E. The worldwide potential for quinoa (Chenopodium quinoa Willd.) potential[J]. Food Rev Int,2003,19:167-177.
[13]Laurain D,Trémouillaux-Guiller J,Chénieux J C. Embryogenesis from microspores of Ginkgo biloba L.,a medicinal woody species[J]. Plant Cell Reports,1993,12(9):501-505.[HJ1.7mm]
[14]安桂花,许明子,李美善,等. 植物激素对高山红景天试管苗愈伤组织诱导的影响[J]. 延边大学农学学报,2007,29(3):153-156.
[15]芦 婕,张晓丽,刘 雯,等. 外植体和植物生长调节剂对盾叶薯蓣愈伤组织诱导的影响[J]. 湖北农业科学,2013,52(15):3693-3696.
[16]莫 英,兰利琼,卿人韦,等. 盾叶薯蓣种子萌发条件及诱导外植体愈伤的研究[J]. 四川大学学报:自然科学版,2004,41(4):837-841.
[17]张 勃,秦 彧,王黎明,等. 紫花苜蓿品种“德宝”不同外植体愈伤组织诱导研究[J]. 甘肃农业大学学报,2012,47(4):100-104.
[18]肖荷霞,王 瑛,高 峰,等. 外植体及激素对SANDITI紫花苜蓿愈伤组织诱导和分化的影响[J]. 河北农业大学学报,2003,26(4):47-52.
[19]王丽艳,荆瑞勇,郭永霞,等. 大豆愈伤组织继代培养中激素浓度组合的优化[J]. 中国油料作物学报,2013,35(4):446-450.
[20]王玉英,高新一. 植物组织培养技术手册[M]. 北京:金盾出版社,2006.
[21]陈 豫,胡 伟,何 磊. 不同浓度激素对胡萝卜愈伤组织诱导的影响[J]. 江苏农业科学,2013,41(2):54-56.
[22]邢小明,林夏珍,王旭艳,等. 波叶红果树叶片愈伤组织诱导研究[J]. 北方园艺,2013(12):108-110.
[23]代 亮,柳玉霞,刘 洁,等. 12个草地早熟禾品种愈伤组织诱导体系的研究[J]. 云南大学学报:自然科学版,2012,34(6):722-730.
[24]许明子,具红光,刘宪虎,等. 水稻愈伤组织生长量和植株再分化率的品种间差异[J]. 吉林农业科学,2000,25(2):29-32,49.
[25]朱祝英,郑锦玲,杨玉梅,等. 植物生长调节剂对离体香蕉叶片愈伤组织诱导的影响[J]. 广东农业科学,2013,40(11):29-32.
[26]周金梅,宫敬利,陈 磊,等. 合作918番茄愈伤组织诱导技术研究[J]. 吉林农业科学,2013,38(2):78-80.
[27]张朝军,范术丽,武芝霞,等. 棉花大田植株叶柄组织培养体系的建立[J]. 西北植物学报,2011,31(6):1257-1263.
[28]孙瑞明,王 娟,陈 芳,等. 香竹愈伤组织诱导研究[J]. 福建林学院学报,2013,33(1):48-51.
[29]高丽丽,陈远玲,简玉瑜. 提高籼稻愈伤组织诱导率和增殖率的研究[J]. 广东农业科学,2005(4):28-30.
