番石榴叶总黄酮提取物的体外生物学活性研究
2015-07-23李丹如卢颖田冰洁吴晓英华南理工大学生物科学与工程学院广东广州510006
李丹如,卢颖,田冰洁,吴晓英(华南理工大学生物科学与工程学院,广东广州510006)
番石榴叶总黄酮提取物的体外生物学活性研究
李丹如,卢颖,田冰洁,吴晓英*
(华南理工大学生物科学与工程学院,广东广州510006)
摘要:比较经优化条件提取的番石榴叶总黄酮粗提物(样品A)和经AB-8大孔树脂纯化的番石榴叶总黄酮精提物(样品B)的体外生物学活性。通过清除DPPH自由基、羟自由基、还原力检测样品的抗氧化能力及研究对α-葡萄糖苷酶的抑制作用来比较样品A、B的体外生物学活性。样品A和样品B的黄酮含量分别为7.8%、13.28%,对DPPH自由基的清除率分别为87.61%、97.22%,对羟自由基的清除率分别为62.32%、80.45%,样品B的还原力远大于样品A;样品A和样品B对α-葡萄糖苷酶的抑制率分别为99.17%、99.81%,远大于阿卡波糖。样品A和样品B都有一定的抗氧化能力和对α-葡萄糖苷酶有一定的抑制作用,总体上样品B高于样品A,可能与其中的总黄酮含量有关。
关键词:番石榴叶;总黄酮;抗氧化;α-葡萄糖苷酶
番石榴是我国民间久用的一种植物药,属桃金娘科番石榴属常绿多年生的灌木植物,原产于美洲,现在广东省各地都有栽培[1-2]。现代医学研究认为番石榴叶具有降血糖、抗氧化、抗病毒、抗菌和抑制α-葡萄糖苷酶的作用等[3-4]。
在人体内,当有极强氧化力的自由基与脂质发生过氧化作用时,将会使多种大分子物质如核酸,蛋白质等发生变性、DNA交联断裂等,从而导致细胞的结构变化和功能破坏,而从引起衰老、癌症及心血管等退变性疾病[5]。
糖尿病是一种以高血脂为特征的全身性疾病,已成为威胁人类的第3位“健康杀手”。糖尿病分为Ⅰ型糖尿病和Ⅱ型糖尿病,后者占绝大部分[6]。现今市面上的治疗Ⅱ型糖尿病的药物根据治疗机制不同主要分为[7]:1)促胰岛素分泌剂:如磺酰脲类;2)胰岛素增敏剂:如屈吉他宗等噻唑烷衍生物;3)α-葡萄糖苷酶抑制剂:如阿卡波糖等。α-葡萄糖苷酶能使碳水化合物在小肠内的消化过程延长,从而单糖在肠黏膜的吸收减缓,使餐后的血糖升高幅度降低,从而有效的预防和治疗这类疾病。
黄酮类化合物具有很强的抗氧化作用[8-9]和α-葡萄糖苷酶的抑制作用[10],近年来对黄酮抗氧化作用和对α-葡萄糖苷酶抑制作用的研究备受关注[11]。本试验测定番石榴叶总黄酮的体外抗氧化活性和α-葡萄糖苷酶的抑制作用,为番石榴叶总黄酮的药理活性研究及天然食品抗氧化剂开发提供理论参考。
1 材料与方法
1.1试验材料
番石榴干叶:江门市江海区南粤金石榴茶制品厂。
1.1.2试剂
1,1-二苯基-2-三硝基苯肼(DPPH)、无水乙醇、抗坏血酸、硫酸亚铁、水杨酸、过氧化氢、无水磷酸二氢钠、无水磷酸氢二钠、三氯乙酸、三氯化铁、盐酸、α-葡萄糖苷酶、4-硝基酚-α-D-吡喃葡萄糖苷、无水磷酸二氢钾、三水磷酸氢二钾、阿卡波糖,所用试剂均为分析纯。
1.1.3仪器
WFZUV-2802SH型紫外可见分光光度计:广州北锐精密仪器有限公司;PB-10型PH计:Sartorius;DT5-2台式离心机:北京时代北利离心机有限公司;酶标仪:上海闪谱生物科技有限公司;BPG-9240A电热鼓风干燥箱:上海一恒科学仪器有限公司;HH-S型水浴锅:巩义市予华仪器有限责任公司。
1.2方法
1.2.1番石榴叶总黄酮样品的制备[12]
番石榴叶总黄酮粗提物(样品A)的制备:总黄酮提取条件为:40%乙醇;料液比1∶20;提取3次;每次1 h。收集合并提取液,4 000 r/min离心10min后,收集上清液,旋转蒸发至无醇味,用蒸馏水稀释至200mL,用石油醚分3次萃取,每次100mL,收集下层液体烘干,即得番石榴叶总黄酮粗提物,记为样品A。精密取样品A配成1mg/mL的样品溶液,利用差示分光光度法测定样品A中总黄酮含量。
AB-8大孔树脂纯化:把样品A配成6mg/m L的初始液,以1.0mL/min的流速上柱,再以体积分数为30%乙醇洗脱,洗脱体积约6BV。将30%乙醇洗脱液烘干后记为样品B为番石榴叶总黄酮精提物。利用差示分光光度法测定样品B中总黄酮含量。
1.2.2清除DPPH自由基能力测定[13]
取1mL样品溶液及9mL 60μmol/L的DPPH无水乙醇于多个试管中,摇匀,避光反应30min后,在最大吸收波长517 nm处测定吸光值,计算DPPH自由基的清除率,根据公式1计算清除率,以VC作为对照品,各个试验组需要重复3次,求其平均值。
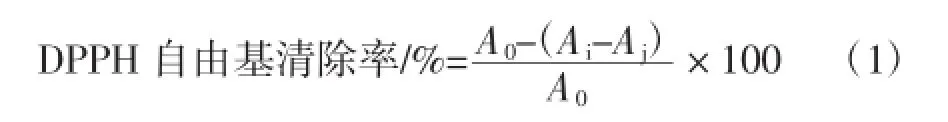
式中:A0为1m L样品溶剂+9m LDPPH溶液的吸光值;Ai为1m L不同浓度的样品溶液+9m LDPPH溶液的吸光值;Aj为1mL不同浓度的样品溶液+9mL无水乙醇的吸光值。
1.2.3清除羟自由基能力测定[14]
9mL反应液中含9mmol/LFeSO40.2mL,9mmol/L水杨酸0.5mL,以及不同浓度的样品溶液1mL,最后加入0.3mL 8.8mmol/LH2O2启动反应。37℃温浴0.5 h后,4 000 r/min离心6min后,取其上清液测定510 nm处的吸光值。吸光值越低,清除·OH的效果越好。根据公式2计算·OH的清除率。
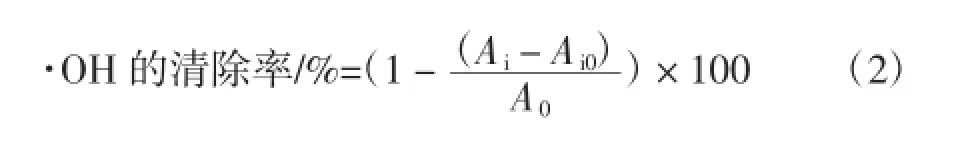
式中:Ai为某浓度样品的吸光值,Ai0为不加H2O2时样品溶液的本底值,A0为对照,不加样品溶液。VC为阳性对照。
1.2.4还原力的测定[15]
将VC,样品A,样品B分别配置成不同浓度的样品溶液,取样品溶液1mL,加入1mL 0.2mol/L pH 6.6的磷酸缓冲溶液和1mL 1%的铁氰化钾 [K3Fe(CN)6] 于10mL的试管中,摇匀,50℃水浴20min后加入1mL10%三氯乙酸溶液,500 r/min离心10min,取上清液2mL,加入1mL 0.1%氯化铁溶液,充分混匀,10min后在700 nm下测吸光值。
1.2.5α-葡萄糖苷酶抑制试验[16]
酶活力标准曲线的制作:用磷酸缓冲液(pH 6.8)配制1 000μmol/L PNP,稀释成0、5、25、50、100、150、200、300、400μmol/L。分别取7种不同浓度的PNP溶液各160μL,加入0.2mol/LNa2CO3溶液80μL,混匀,在405 nm下测定吸光值,测3组取平均值。以吸光值为纵坐标,对硝基苯酚浓度为横坐标,做出标准曲线。
取112μL磷酸钾缓冲液(pH6.8),加入0.2U/mL α-葡萄糖苷酶20μL,8μLDMSO,37℃恒温15min后加入2.5mmol/L的PNPG 20μL,37℃恒温反应15min。再加入80μL浓度为0.2 mol/L的Na2CO3溶液,于405 nm波长下测吸光值。以阿卡波糖为阳性对照。
抑制百分率/%=(抑制剂活力/酶活力)×100(3)
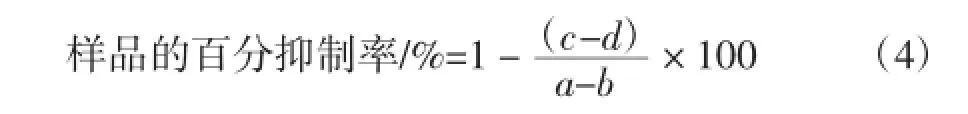
式中:a为对照组(缓冲液+酶液+底物)的抑制百分率;b为空白组对照组(缓冲液)的抑制百分率;c为样品测定组(样品+酶液+底物)的对照百分率;d为样品对照组(样品+缓冲液)的对照百分率。
2 结果与分析
2.1不同番石榴叶总黄酮提取物的总黄酮含量的比较
利用差示分光光度法测得样品A,样品B中的总黄酮含量分别为7.8%,13.28%。纯化前样品A的黄酮含量为7.8%。纯化后黄酮含量比纯化前提高了70.26%。2.2样品清除DPPH自由基能力的比较
不同样品的DPPH清除率见图1。

图1 不同样品的DPPH清除率Fig.1 DPPH scavenging rateof the different sam p le
从图1可知,VC、样品A、样品B在低浓度的条件下对DPPH就有较强的清除力,当达到一定浓度范围时,清除率变化不大。VC的最高清除率为96.76%,样品A为87.61%,样品B为97.22%。总体来说样品B 对DPPH自由基的清除率要略高于样品A。
2.3样品清除羟自由基能力的比较
不同样品的羟自由基清除率见图2。
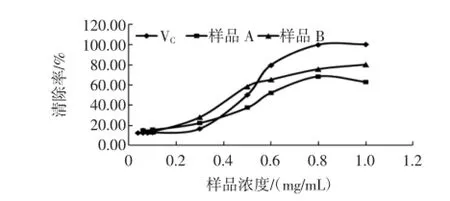
图2 不同样品的羟自由基清除率Fig.2 Hydroxyl radicalscavenging rate thedifferentsam ple
由图2可知,在一定浓度范围内,VC、样品A、样品B对羟自由基的清除率随着浓度的增加而不断升高,其中VC浓度达到1mg/mL时,清除率达到97.35%;样品A在浓度达到0.8mg/mL后,清除率变化不大,达62.32%;而样品B的清除率一直处于逐渐升高的趋势,最高达80.45%。总体上样品B的羟自由基清除率高于样品A。
2.4样品还原力的比较
不同样品的还原力件图3。
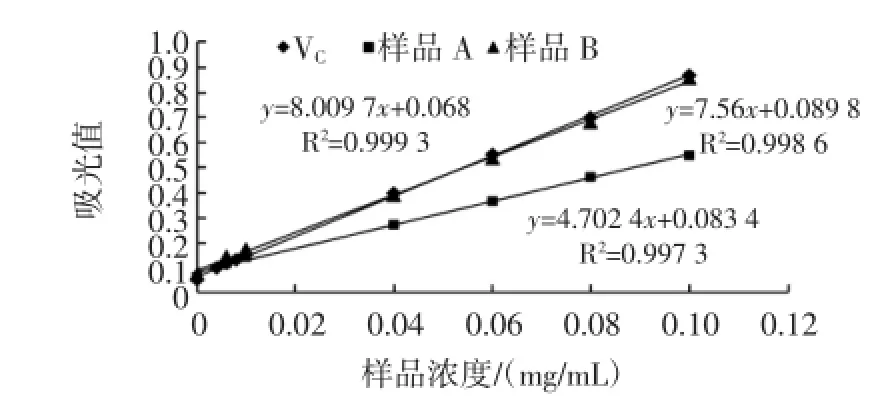
图3 不同样品的还原力Fig.3 Reducing power of thedifferent sam ple
从图3中可知,在相同浓度下,各样品的还原力大小顺序为:VC>样品B>样品A。其中样品B与VC接近,并远大于样品A。
2.5样品对α-葡萄糖苷酶抑制能力的比较
对硝基苯酚标准曲线如图4。
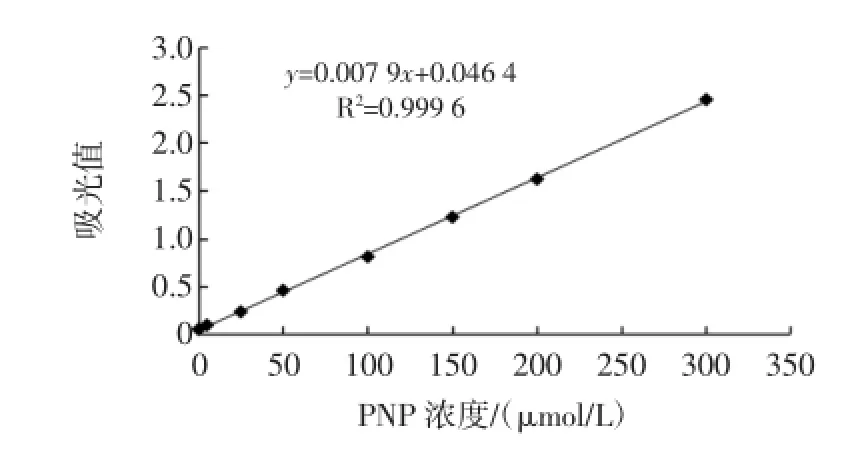
图4 对硝基苯酚光密度标准曲线Fig.4 Opticaldensity curve of PNP
对硝基苯酚浓度和吸光值的标准曲线回归方程是:y=0.007 9x+0.046 4(R2=0.999 6),对硝基苯酚溶液浓度在0~350μmol/L范围内线性关系良好。
阿卡波糖对α-葡萄糖苷酶的影响见图5,样品对α-葡萄糖苷酶的影响见图6。
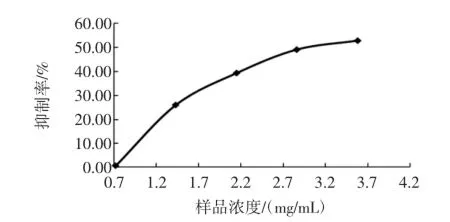
图5 阿卡波糖对α-葡萄糖苷酶的影响Fig.5 Them ass concentration of Acarbose effect on inhib itory activity ofα-glucosidase
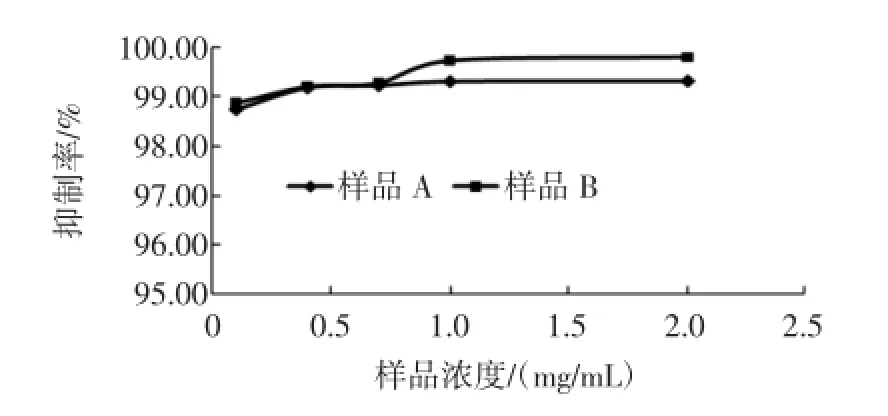
图6 样品对α-葡萄糖苷酶的影响Fig.6 Them ass concentration of samp leeffects on inhibitory activity ofα-glucosidase
由图5可以看出,阿卡波糖对α-葡萄糖苷酶抑制活性呈剂量依赖性,抑制率最高达到52.79%。
由图6可知随着样品A,样品B浓度的增加,对α-葡萄糖苷酶的抑制作用逐渐增强,有明显的浓度-效应关系,当样品浓度小于0.7mg/mL时,样品A、样品B对α-葡萄糖苷酶的抑制作用相近,当样品浓度高于0.7mg/m L时,样品B对α-葡萄糖苷酶的抑制率达到99.81%,样品A为99.17%。两种样品对α-葡萄糖苷酶的抑制作用要远高于阿卡波糖。
3 结论
经优化条件提取的番石榴叶总黄酮粗提物(样品A)和经AB-8大孔树脂纯化的番石榴叶总黄酮精提物(样品B)都有较好的抗氧化能力和抑制α-葡萄糖苷酶的活性。样品A和样品B的黄酮含量分别为7.8%、13.28%,对DPPH自由基的清除率分别为87.61%、97.22%,对羟自由基的清除率分别为62.32%、80.45%,样品B的还原力远大于样品A;样品A和样品B对α-葡萄糖苷酶的抑制率分别为99.17%、99.81%,远大于阿卡波糖。研究数据表明,样品B的活性要高于样品A,且样品B的总黄酮含量要高于样品A,说明番石榴叶提取物的抗氧化活性和抑制α-葡萄糖苷酶的活性与总黄酮含量有关。在两种样品黄酮含量都较低的情况下,仍具有较高的生物学活性,也就是说番石榴叶中的黄酮物质具有较高的生物学活性,本研究为番石榴的进一步开发利用提高供了理论参考。
参考文献:
[1] 吴艳,曲玮,梁敬钰.番石榴叶的研究进展[J].海峡药学,2013,12 (15):14-19
[2]郭刚军,何美莹,邹建云,等.番石榴叶的化学成分与药理作用研究动态[J].热带农业科技,2009,32(4):12-15,18
[3]邵萌,范春林,王英,等.番石榴叶的化学成分及药理活性研究进展[J].天然产物研究与开发,2009,21(3):525-528,534
[4]冯珍鸽,陈丙年,王力.番石榴叶提取物的鉴定及其抑菌活性[J].食品研究与开发,2010,31(3):35-39
[5]曾祥伟,杨丽燕,陈金龙,等.黄酮类成分抗自由基氧化活性进展[J].中华中医药杂志,2013,9(1):2694-2697
[6]王小辉.番糖尿病、高血压及糖尿病伴高血压患者合并脑梗死特点及与预后关系[J].中外医疗,2012,5(21):20-21
[7]KOSKIRR.Practical review oforalantihyperglyccmic agents for tyoe 2 diabetesmellitus[J].DiabetesEduc,2006,32(6):869-876
[8]ChenY T,Zheng R L,Jia Z J,et al.Flavonoids as super oxide scavengersand antioxidans[J].Free Radical BilogyMedicine,1990,9 (1):19-21
[9]Yi ZB,Yu Y,Liang Y Z,etal.In vitro antioxidantand antimicrobial activities of the extract of Pericarpium Citri Reticulatae of a new Citrus cultivar and its main flavonoids[J].Food Science and Technology,2008,41(4):597-603
[10]Nakamura U,Iwase M,Uchizono Y,et al.Rapid intracellular acidification and cell death by H2O2and alloxan in pancreaticβ cells[J].Free Radical Biology and Medicine,200,40(11):2047-2055
[11]沈忠明,李英,姜宏,等.降糖中药对α-葡萄糖苷酶抑制作用的研究[J].中国生化药物杂志,2007,42(10):740-743
[12]田冰洁,吴晓英,吴振强,等.差示分光光度法在番石榴叶总黄酮提取工艺中的应用[J].安徽农业科学,2013,41(27):10974-10976, 11002
[13]高昌勇.正交设计优化紫甘蓝色素提取及抗氧化性研究[J].生物技术,2010,20(3):73-75
[14]张宽朝,李冬磊,陈曼曼,等.甘薯渣多酚粗提取液的抗氧化活性研究[J].食品工业科技,2011,32(3):163-165
[15]崔月花,章克昌.灵芝三萜(GCTL1)的体外抗氧化作用[J].食品科学,2010,31(19):49-53
[16]张丽.滇丁香茜草抑制α-葡萄糖苷酶活性成分研究[D].开封:河南大学,2010
DOI:10.3969/j.issn.1005-6521.2015.22.006
收稿日期:2014-05-29
作者简介:李丹如(1993—),女(汉),本科,研究方向:天然物提取与分析。
*通信作者:吴晓英(1961—),女(汉),副教授,研究方向:生物制药。
Study on Vitro Bioactivity of Guava Leaves Flavonoids
LIDan-ru,LUYing,TIANBing-jie,WUXiao-ying*
(Collegeof Bioscience and Bioengineering,South China UniversityofTechnology,Guangzhou 510006,Guangdong,China)
Abstract:Compared the vitro bioactivity of guava leaves flavonoids crude extract by the optimal extraction conditions(sample A)and guava leaf flavonoids fine extract purified by AB-8macroporous resin(samp le B). Studied on antioxidation of samples by the DPPH radical scavenging,hydroxyl radical scavenging,reducing powerandα-glucosidase inhibitory to comapre thevitrobioactivity between sample A and sample B.Flavonoids content of the sample A and sample B were 7.8%and 13.28%,with DPPH free radical scavenging rates of 87.61%and 97.22%,with hydroxyl radical scavenging rate of 62.32%and 80.45%and withα-glucosidase inhibitory ratesof 99.17%and 99.81%,which aremuch larger than acarbose.And restoring force of sample B ismuch larger than the sample A.Sample A and samp le B has a certain amount of antioxidant activity andαglucosidase inhibitory effect,which may have a certain relationship with flavonoids,as a whole,sample B slightlyhigher than the sample.
Keywords:guava leaf;flavonoids;antioxidation;α-glucosidase
