纤维素酶辅助醇提荔枝核黄酮的工艺研究
2015-07-22姚莉戴远威何敏吴丽韩淑琴广东科贸职业学院生物技术系广东广州50000华南农业大学食品学院广东广州50000中山职业技术学院广东中山58400
姚莉,戴远威,何敏,吴丽,韩淑琴(.广东科贸职业学院生物技术系,广东广州50000;.华南农业大学食品学院,广东广州50000;3.中山职业技术学院,广东中山58400)
纤维素酶辅助醇提荔枝核黄酮的工艺研究
姚莉1,戴远威1,何敏1,吴丽2,韩淑琴3,*
(1.广东科贸职业学院生物技术系,广东广州510000;2.华南农业大学食品学院,广东广州510000;3.中山职业技术学院,广东中山528400)
摘要:以荔枝核为原料,研究纤维素酶辅助醇提荔枝核黄酮的工艺。考察酶添加量、酶解时间、醇提温度、醇提时间4个单因素对荔枝核黄酮提取率的影响,在单因素试验的基础上,选择四因素三水平进行正交试验优化工艺条件。结果表明,纤维素酶辅助醇提荔枝核黄酮的最优工艺条件为酶添加量5 000 U/g、酶解时间90 min、醇提温度70℃、醇提时间2.5 h,在此条件下,荔枝黄酮提取率可达5.64%,比乙醇回流法提取提高了74.07%。
关键词:荔枝核黄酮;纤维素酶;醇提
荔枝为岭南佳果,果肉细嫩爽甜,富含多种有机酸、维生素及大量游离丝氨酸和精氨酸,果实营养价值高[1-2]。荔枝核是荔枝的干燥成熟种子,含有多种活性物质[3],现代医学研究认为,荔枝核具有降血糖、降血脂等多种生理功效[4-5],开发前景看好。鲜荔枝核的含量约为荔枝产量的20%~25%,除少量用于中药外,大部分弃之未用[6],造成了资源的浪费。
生物酶解提取技术是根据植物细胞壁的结构组成,利用酶反应具有的高度专一性等特点,选择相应的酶,对原料进行酶解预处理,破坏细胞壁的结构,使有效成分充分暴露出来,在传统的溶剂提取方法的基础上,使得更多有效成分溶解、混悬于溶剂中,从而提高提取率[7]。目前,已有研究利用乙醇回流提取[8-9]、热浸提取[8]、微波辅助提取[8]、超声辅助提取荔枝核黄酮[10],但是生物酶解预处理技术在荔枝核黄酮提取的应用却鲜有报道。本文研究纤维素酶解辅助醇提荔枝核黄酮的工艺,考察各因素对黄酮提取率的影响,并通过正交优化实验得出最优工艺条件,为荔枝核中黄酮成分的提取提供一种新途径。
1 材料和方法
1.1材料与设备
荔枝:市售;纤维素酶:诺维信(中国)生物技术有限公司;芦丁标准品:广州齐云生物科技有限公司;氢氧化钠、亚硝酸钠、无水醋酸钠、硝酸铝、无水乙醇、冰醋酸:均为分析纯。
HH-6数显恒温水浴锅:常州奥华仪器有限公司;PL203电子精密天平:特勒-托克多仪器(上海)有限公司;SHZ-III型循环水真空泵:上海亚荣生化仪器厂;UV-5100紫外分光光度计:上海元析仪器有限公司。
1.2方法
1.2.1工艺流程
荔枝→取核→50℃干燥粉碎→粉碎(60目筛)→加30 mL缓冲液→酶解预处理→灭酶→乙醇回流提取→测定提取液黄酮含量
1.2.2芦丁标准曲线的绘制
参照文献[11]的方法作修改:精确称取芦丁标准品0.020 g,加30%乙醇30 mL,超声溶解后定容于50 mL容量瓶中,得浓度为400 μg/mL的标准品溶液。精密称取上述芦丁标准品溶液0、0.5、1.0、1.5、2.0、2.5分别至25 mL具塞试管中,分别加入5%亚硝酸钠溶液0.3mL,摇匀,静置6min后,加入10%硝酸溶液0.3mL,摇匀,静置6 min,加入1 mol/L氢氧化钠溶液4.0 mL,用30%乙醇溶液定容,摇匀,静置15 min后,于510 nm波长处测定吸光度。以芦丁标准品浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得出线性回归方程为Y=0.011 6X+0.010 8,R2=0.997 5,式中:Y为吸光度,X为总黄酮浓度(μg/mL),芦丁质量浓度在0~40 μg/mL范围内吸光度的线性关系良好。
1.2.3荔枝核黄酮提取率的测定
称取2 g左右荔枝核粉,加入30 mL乙酸—乙酸钠缓冲溶液,再加入一定量的纤维素酶,在pH 4.5、酶解温度55℃的条件下,酶解一定时间,90℃灭酶10 min后,加入50 mL 90%乙醇溶液在一定的温度下回流提取一定时间,过滤,用90%的乙醇溶液洗涤滤渣,合并滤液,pH调至7.0,用30%乙醇定容至250mL,取2 mL样液测定总黄酮提取率,提取率计算公式如式(1)所示。
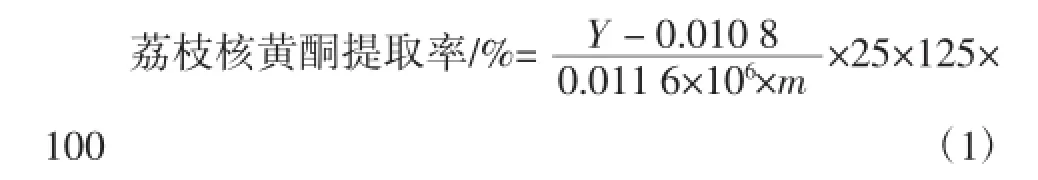
式中:Y为测定液的吸光度;m为荔枝核质量,g。
1.3单因素对荔枝核黄酮提取率的影响
在酶解时间为60 min,醇提温度为70℃,醇提时间为1.5 h的条件下,选定纤维素酶添加量为2 000、3 000、4 000、5 000、6 000 U/g,探究酶添加量对黄酮提取率的影响;在酶添加量为4 000 U/g,醇提温度为70℃,醇提时间为1.5 h的条件下,选定酶解时间为30、45、60、75、90 min,探究酶解时间对黄酮提取率的影响;在酶添加量为4 000 U/g,酶解时间为60 min,醇提时间为1.5 h的条件下,选定醇提温度为40、50、60、70、80℃,探究醇提温度对黄酮提取率的影响;在酶添加量为4 000 U/g,酶解时间为60 min,醇提温度为70℃的条件下,选定醇提时间为0.5、1、1.5、2、2.5,探究醇提时间对黄酮提取率的影响。
1.4正交优化试验设计
根据单因素试验,选取酶添加量(A)、酶解时间(B)、醇提温度(C)、醇提时间(D)进行四因素三水平正交优化试验,各因素水平见表1。
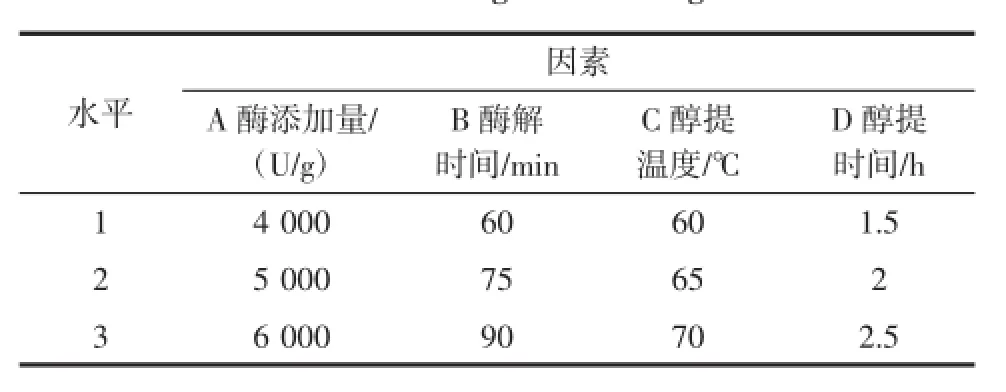
表1 正交试验因素与水平设计Table 1 Orthogonal test design
2 结果与分析
2.1单因素试验结果与分析
2.1.1纤维素酶添加量对荔枝核黄酮提取率的影响
在其他条件不变的情况下,选定纤维素酶添加量为2 000、3 000、4 000、5 000、6 000 U/g,探究酶添加量对黄酮提取率的影响,结果见图1。

图1 纤维素酶添加量对荔枝核黄酮提取率的影响Fig.1 The effect of enzymatic content on extraction rates of litchi seed flavonoids
由图1可知,当纤维素酶添加量为1 000 U/g~5 000 U/g时,荔枝核黄酮提取率显著增加,而纤维素酶添加量大于5 000 U/g,黄酮提取率反而降低。原因可能是在一定的酶解时间内,随着酶添加量的增加,纤维素酶能与更多的底物反应,并加快酶解反应速率,使黄酮物质充分暴露出来,有利于下一步的醇提;当酶达到一定浓度时,受底物数量限制,酶促反应速率将不再增加,此时进一步增加酶量,反而会引起酶之间的竞争,甚至出现抑制作用。因此,根据试验结果,纤维素酶的添加量在4 000 U/g~6 000 U/g为宜。
2.1.2酶解时间对荔枝核黄酮提取率的影响
在其他条件不变的情况下,选定酶解时间为30、45、60、75、90 min,探究酶解时间对黄酮提取率的影响,结果见图2。

图2 酶解时间对荔枝核黄酮提取率的影响Fig.2 The effects of enzymolysis time on extraction rates of litchi seed flavonoids
由图2可知,荔枝核黄酮提取率随着酶解时间的延长而增加,这是因为随着酶解时间的延长,酶与底物的充分反应,荔枝核细胞壁的结构在纤维素酶的作用下降解,使得黄酮物质更容易溶解、扩散于乙醇溶液中,从而提高黄酮的提取率。但是酶解时间大于75 min,黄酮提取率增加较缓慢,可能是由于酶的作用已完全,此时再增加酶解时间,反而会影响提取效率,因此,酶解时间在60 min~90 min为宜。
2.1.3醇提温度对荔枝核黄酮提取率的影响
在其他条件不变的情况下,选定醇提温度为为40、50、60、70、80℃,探究醇提温度对黄酮提取率的影响,结果见图3。
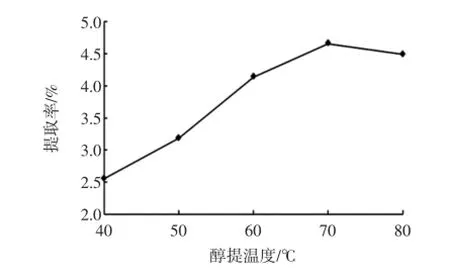
图3 醇提温度对荔枝核黄酮提取率的影响Fig.3 The effects of extraction temperature on extraction rates of litchi seed flavonoids
由图3看出,醇提温度在70℃以下时,温度的升高有利于黄酮提取率的增加。原因在于温度升高利于分子运动速度加快,从而在一定的时间内,加快有效成分的扩散速度,使得更多的黄酮物质溶出。但温度过高,使乙醇蒸发加快,导致溶液中乙醇浓度降低,不利于荔枝核黄酮的溶出[12],同时,溶液的损失也在一定程度上导致溶液中黄酮浓度的增加,细胞内外的渗透压减少也会影响荔枝核黄酮的提取。另外,醇提温度的上升也会产生耗能增加的问题。因此,考虑黄酮提取率和提取耗能,醇提温度在60℃~70℃为宜。
2.1.4醇提时间对荔枝核黄酮提取率的影响
在其他条件不变的情况下,选定醇提时间为0.5、1、1.5、2、2.5 h,探究醇提时间对黄酮提取率的影响,结果见图4。
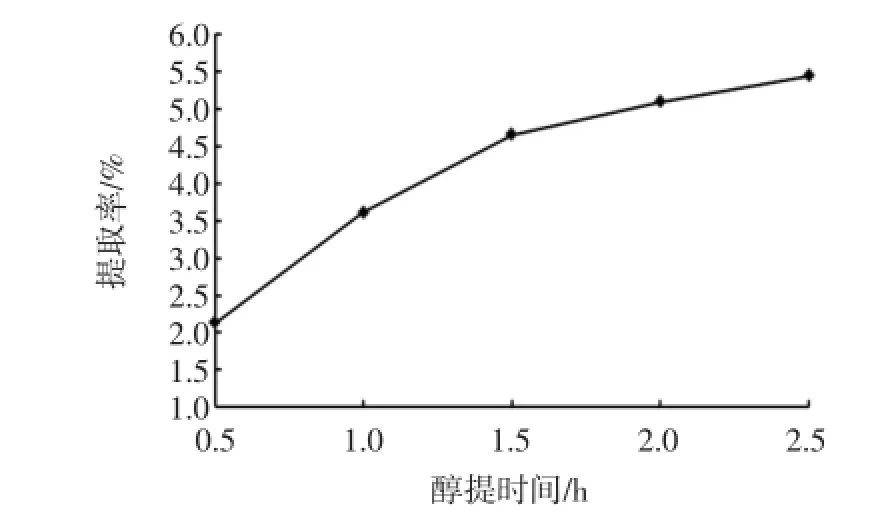
图4 醇提时间对荔枝核黄酮提取率的影响Fig.4 The effects of extraction time on extraction rates of litchi seed flavonoids
由图4看出,随着醇提时间的增加,荔枝核黄酮提取率呈两个阶段变化:第一阶段是醇提时间为0.5 h~1.5 h,此阶段黄酮提取率显著增加;第二阶段是醇提时间为1.5 h~2.5 h,黄酮提取率增加较为平缓。这是由于在醇提初始阶段,由于黄酮类物质在乙醇溶液中浓度很低,荔枝核细胞内外的渗透压大,黄酮物质可迅速溶出,导致黄酮提取率明显增加;但是随着提取时间的延长,溶液趋于饱和,黄酮物质溶解度降低,从而提取率变化缓慢[13]。因此,为了获得较高的黄酮提取率,醇提时间在1.5 h~2.5 h为宜。
2.2正交试验结果与分析
根据单因素试验,选取酶添加量(A)、酶解时间(B)、醇提温度(C)、醇提时间(D)进行四因素三水平正交优化试验,结果见表2。

表2 正交试验结果Table 2 The result of orthogonal experiment

续表2 正交试验结果Continue table 2 The result of orthogonal experiment
表2极差分析结果表明,各因素对黄酮提取率的影响大小次序为D>A>C>B,即醇提时间>酶添加量>醇提温度>酶解时间。由正交优化结果得到的最优工艺组合为A2B3C3D3,即酶添加量为5 000 U/g、酶解时间为90 min、醇提温度为70℃、醇提时间为2.5 h。
2.3验证试验
由于优选的工艺未包括在正交设计表的试验中,故对其进行验证试验。称取2g荔枝核粉,按最优工艺条件A2B3C3D3,进行3次平行试验,分别测定黄酮提取率,计算得出黄酮的平均提取率为5.64%,均高于单因素试验组和正交试验组,表明优化得到的工艺条件合理。
2.4纤维素酶辅助醇提法与乙醇回流提取法比较
称取2 g左右荔枝核粉,加入30 mL乙酸—乙酸钠缓冲溶液,加入50 mL 90%乙醇溶液70℃温度下回流提取2.5 h,过滤,用90%的乙醇溶液洗涤滤渣,合并滤液并定容至250 mL,取2 mL样液测定黄酮提取率,并与纤维素酶辅助醇提最优工艺条件下得到黄酮提取率比较,结果如图5所示。
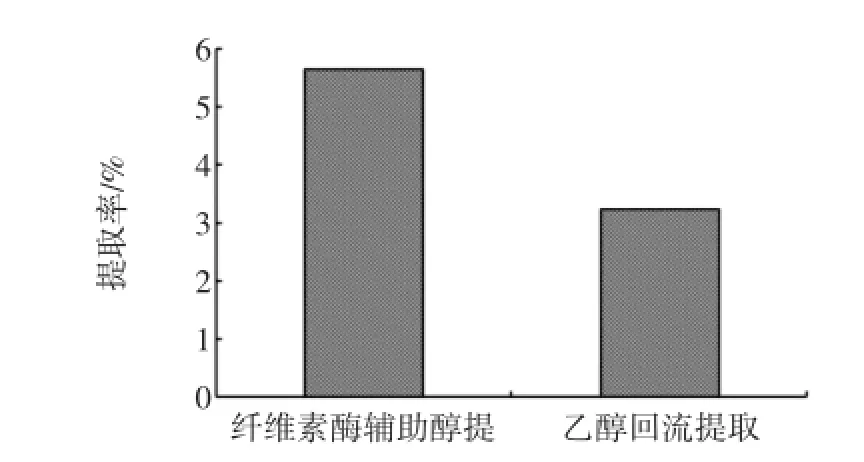
图5 不同提取方法对荔枝核黄酮提取率的影响Fig.5 The effects of different extraction technology on extraction rates of litchi seed flavonoids
由图5可知,乙醇回流2.5 h后,荔枝核黄酮提取率为3.85%;而经过纤维素酶对荔枝核预处理90 min再乙醇回流提取,黄酮提取率提高了74.07%,说明纤维素酶预处理能有效提高荔枝核黄酮提取率。
3 结论与展望
通过单因素和正交优化试验,得出纤维素酶辅助醇提荔枝核黄酮的最优工艺条件为酶添加5 000 U/g、酶解时间90 min、醇提温度70℃、醇提时间2.5 h,在此条件下,荔枝黄酮提取率可达5.64%,比乙醇回流提取提高了74.07%,说明纤维素酶预处理能有效提高荔枝核黄酮提取率,纤维素酶在荔枝核中黄酮成分的提取具有一定的发展前景。
近年来,酶法提取技术作为一种温和、高效的提取技术得到了广泛应用,酶能使植物材料降解形成疏散结构,具有提取效率高、成本低廉等优点。同时,由于酶法提取可以温和的条件下进行,所得的产物纯度、稳定性及活性都较高,且安全无污染[14]。本文研究了纤维素酶解辅助醇提荔枝核黄酮的工艺,并得出最优的工艺参数,而纤维素酶预处理对产物纯度、稳定性及活性的影响需做进一步的研究。
参考文献:
[1]江苏医学院.中药大词典[M].上海:上海科技出版社,1997:235-480
[2]贾敏,黄丽,韦保耀,等.荔枝汁产品中有机酸、糖类和游离氨基酸的对比分析[J].食品科技,2010,35(10):95-99
[3] 屠鹏飞,罗青,郑俊华.荔枝核的化学成分研究[J].中草药,2002,33 (4):300-303
[4]潘竞锵,刘惠纯,刘广南,等.荔枝核降血糖、调血脂和抗氧化的实验研究[J].广东药学,1999,9(1):47-49.
[5]Liu Yaguang.Pharmaceutical composition containing a safe extracts of fruits and vegetables for treating and preventing of diabetes[P]. United States Patent:4985248,1991-01-15
[6]刘朝霞,钱敏,陈海光.荔枝核的加工研究进展[J].广东农业科学, 2011,38(3):87-89
[7] 任伟,吕高辉,王广.酶解技术在食品和制药工业中的应用[J].山西化工,2007,27(4):55-57
[8]汤建萍,周春山,涂秋云,等.荔枝核黄酮类化合物的提取工艺研究[J].应用化工,2007,36(2):109-113
[9]孙哲浩,李宝珍,赵谋明,等.响应面分析法优化荔枝核总黄酮提取工艺的研究[J].食品与机械,2006,22(1):30-32
[10]林大专,惠春,孙全乐,等.超声法提取荔枝核黄酮类化合物的工艺研究[J].医药导报,2013,32(9):1221-1223
[11]孔繁晟,贲永光,孙爱群,等.超声法与连续回流法提取黄芪总黄酮的工艺对比研究[J].中国药房,2010,21(19):1752-1754
[12]陈向明,徐涛,查甫本.山核桃外果皮黄酮提取与纯化[J].农业机械学报,2011,42(12):177-181
[13]谢蓝华,杜冰,叶琼娟,等.正交试验优化酶法提取黄芪总黄酮工艺[J].包装与食品机械,2013,31(3):7-12
[14]蔡小燕,王超,叶宋,等.酶在植物活性成分提取中的应用[J].农业机械,2012,30(10):90-93
DOI:10.3969/j.issn.1005-6521.2015.24.018
收稿日期:2014-07-04
作者简介:姚莉(1977—),女(汉),讲师/质量工程师,硕士,研究方向:食品加工、食品科学方面应用研究。
*通信作者:韩淑琴,讲师,研究方向:天然产物有效成分提取与应用。
Study on Process of Cellulase Assisted Ethanol Extraction of Litchi Seed Flavonoids
YAO Li1,DAI Yuan-wei1,HE Min1,WU Li2,HAN Shu-qin3,*
(1.Department of Biotechnology,Guangdong Vocational College of Science and Trade,Guangzhou 510000,Guangdong,China;2.College of Food Science,South China Agricultural University,Guangzhou 510000,Guangdong,China;3.Zhongshan Vocational and Technical College,Zhongshan 528400,Guangdong,China)
Abstract:Used litchi seed as material,the process of cellulase assisted ethanol extraction of litchi seed flavonoids was on studied.The effects of enzymatic content,enzymolysis time,extraction temperature and extraction time on extraction rates of litchi seed flavonoids were explored,and four factors and three levels of orthogonal test was experimented based on single-factor test.The result showed that the optimal conditions of process of cellulase assisted ethanol extraction of Litchi seed flavonoids were enzymatic content of 5 000 U/g,enzymolysis time of 90 min,extraction temperature of 70℃ and extraction time of 2.5 h.Under these conditions,the extraction rates of litchi seed flavonoids could be up to 5.64%,which was 74.07%higher than that by ethanol extraction.
Key words:litchi seed flavonoids;cellulose;ethanol extraction
