水稻类受体蛋白激酶OsESG1的原核表达
2015-07-18赵丽张国嘉郑世刚等
赵丽 张国嘉 郑世刚等
摘要:水稻类受体蛋白激酶OsESG1在种胚中特异表达,属丝氨酸/苏氨酸蛋白激酶。OsESG1基因全长cDNA经XhoⅠ、BamHⅠ双酶切,与同样经双酶切的原核表达载体pET-28a(+)经T4 DNA连接酶连接,并转化大肠杆菌感受态细胞BL21。原核表达结果显示,OsESG1可受1 mmol/L IPTG诱导表达,且蛋白表达量随诱导时间的延长而逐渐增加,诱导7 h后,蛋白表达至较高水平。对不同浓度IPTG诱导下的蛋白表达情况进行研究,结果显示,0.1 mmol/L IPTG对OsESG1的诱导表达效果最好。
关键词:类受体蛋白激酶;OsESG1;原核表达
中图分类号:S511.01:Q786 文献标识号:A 文章编号:1001-4942(2015)01-0001-05
Abstract Rice receptor-like kinase OsESG1 belongs to serine/threonine protein kinase, which is specifically expressed in rice embryo. In this research, the full length cDNA of OsESG1 was digested by BamH Ⅰ and XhoⅠ, and then linked with the prokaryotic expression vector pET-28a(+) digested by the same double enzymes with T4 DNA ligase. The constructed prokaryotic expression vector of OsESG1-pET-28a(+) was then transformed into host bacteria BL21 for protein expression analysis. The SDS-PAGE showed that OsESG1 could be induced to express by 1 mmol/L IPTG. The expression quantity increased with the elongation of induction time, and reached the maximum level after inducing for 7 h. The induction concentration of IPTG was also studied. The results indicated that 0.1 mmol/L IPTG had the best induction effect.
Key words Receptor-like kinase; OsESG1; Prokaryotic expression
植物细胞具有感受生物和非生物胁迫的能力,并可通过细胞内外信号传导途径,将胞外信号转导至胞内,对胞内转录、翻译等过程进行调控,从而使机体对胞外信号做出一定的响应。类受体蛋白激酶(Receptor Like Kinases,RLKs)广泛存在于植物中,可通过胞外结构域识别信号分子,进而通过磷酸化与去磷酸化反应,将信号传递至下游靶蛋白,调控相关生理、生化过程。
自1989年Lawton等首次在四季豆中成功克隆到植物蛋白激酶基因PVPK-1[1],之后cdc2、ZmPK1等类受体蛋白激酶基因也相继被克隆,相关功能研究也受到普遍关注。根据胞外结构域的不同,类受体蛋白激酶主要分为六个亚家族:S-结构域类受体蛋白激酶、富亮氨酸类受体蛋白激酶、表皮生长因子类受体蛋白激酶、凝集素类受体蛋白激酶、肿瘤坏死因子类受体蛋白激酶、PR5 类受体蛋白激酶[2]。植物类受体蛋白激酶作用广泛,主要参与激素的应答[3]、植物的生长发育调节[4]、自交不亲和[5]、病原菌的识别[6]以及共生[7]等过程。
本实验室前期从水稻中克隆了一个类受体蛋白激酶基因,命名为OsESG1(Oryza Sativa Embryo Specific Gene 1),GenBank序列号为HE584611.1[8]。蛋白结构分析显示,OsESG1包括胞内激酶结构域、跨膜域、胞外受体结构域三个部分,根据其胞外结构特征,属S-结构域类受体蛋白激酶。初步表达模式分析显示该激酶表达具有种胚特异性[9]。本研究将OsESG1基因编码区与原核表达载体pET-28a(+) 融合,获得重组质粒OsESG1-pET-28a(+) ,测序正确后,转入大肠杆菌BL21(DE3) 感受态中,进行原核表达,并对蛋白诱导条件及表达情况进行了优化及鉴定,为进一步在生化水平上解析该基因的结构与功能奠定了基础。
1 材料与方法
1.1 材料及试剂
pET-28a(+) 载体由本实验室保存;前期试验已获得测序正确的OsESG1克隆质粒;大肠杆菌(E.coli)的DH5α和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;DNA凝胶回收试剂盒、限制性内切酶、T4 DNA连接酶均购自TaKaRa公司;高纯质粒回收试剂盒购自北京百泰克生物技术有限公司;引物由上海捷瑞生物工程有限公司合成。
1.2 OsESG1全长序列的扩增
根据OsESG1的基因序列以及pET-28a(+) 的酶切位点,利用Primer premier 5.0设计引物:OsESG1-BamHⅠ-S:5′-CGGGATCCTTTGTGGATAGCTATGTTGCAGTTG-3′、OsESG1-XhoⅠ-A:5′ –CCCTCGAGATCAATCATAATCGTCCATCAGGTT-3′(下划线处分别为BamHⅠ、XhoⅠ酶切位点)。以OsESG1克隆质粒为模板,利用合成的引物进行PCR扩增,得到OsESG1的DNA全长。PCR反应体系(50 μL):Ex Taq premix 25 μL、克隆质粒 2.5 μL、10 μmol/L上下游引物各1.25 μL、ddH2O 20 μL。反应程序为:94℃ 5 min;94℃ 30 s,56.5℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min。endprint
1.3 OsESG1-pET-28a(+) 原核表达载体的构建与转化
将OsESG1的PCR产物与pET-28a(+) 质粒分别进行BamHⅠ、XhoⅠ双酶切,1%凝胶电泳检测并回收纯化酶切产物。pET-28a(+) 和OsESG1的回收产物经电泳检测,条带大小正确后,在T4 DNA连接酶作用下进行连接,并转化大肠杆菌感受态细胞DH5α,将转化后的菌液均匀涂布在含卡那霉素(Kan,50 μg/mL)的LB固体培养基上,37℃倒置避光培养12 h。
随机挑取菌斑进行XhoⅠ、BamHⅠ双酶切以及菌液PCR鉴定。将检测正确的单克隆用载体引物T7进行测序验证,测序由山东省农科院生物技术研究中心测序室完成。
将测序正确的OsESG1-pET-28a(+) 重组质粒以热激法转入大肠杆菌感受态细胞BL21(DE3)内,经菌液PCR检测为阳性的转化子,用于进一步的蛋白诱导表达。
1.4 蛋白诱导表达以及SDS-PAGE
1.4.1 蛋白诱导表达 将含有OsESG1-pET-28a(+) 的菌液按1∶100的比例接种含卡那霉素抗性的LB培养液中,摇菌至菌液OD值在0.6到1.0之间。加入终浓度为1 mmol/L的IPTG(isopropyl β-D-thiogalactoside),25℃下诱导12 h。
诱导后的菌液用10 mmol/L溶菌酶裂解后,经离心,分别取上清与沉淀进行SDS-PAGE电泳,检测OsESG1的表达情况 。
1.4.2 不同诱导时间对蛋白表达的影响 在25℃条件下,以1 mmol/L IPTG诱导蛋白表达,每隔1个小时取样备用,样品经溶菌酶处理后进行SDS-PAGE电泳,鉴定融合蛋白的最佳诱导时间。
1.4.3 不同诱导浓度对蛋白表达的影响 分别使用0.001、0.01、0.1、1、10 mmol/L IPTG进行诱导,不同样品经溶菌酶处理后进行SDS-PAGE电泳,鉴定融合蛋白的最佳诱导浓度。
2 结果与分析
2.1 OsESG1全长序列的扩增
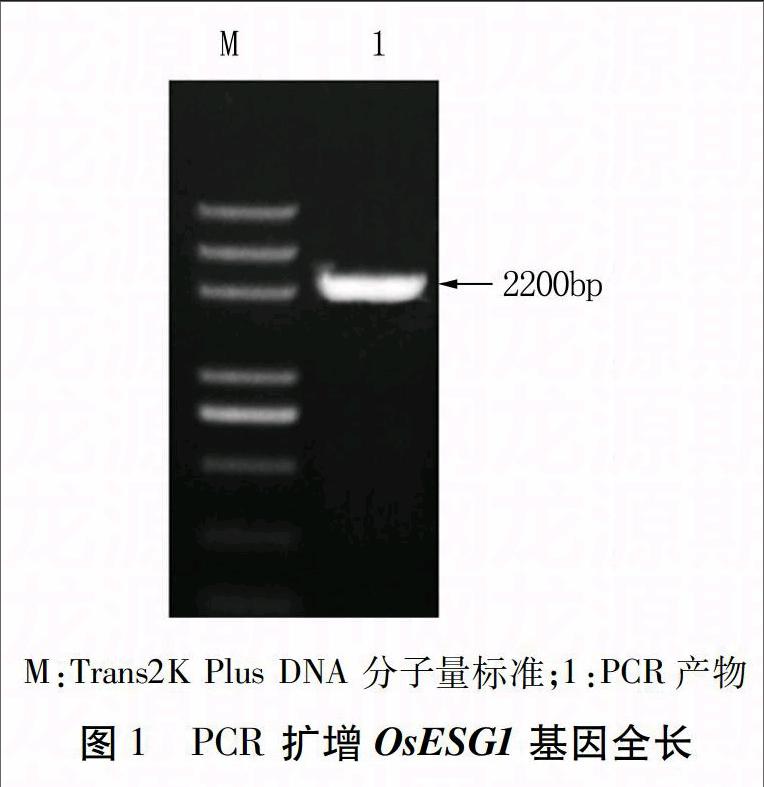
经PCR扩增获得OsESG1的全长序列,约2 200 bp,与本实验室前期获得的基因大小一致(图1)。
2.2 OsESG1-pET-28a(+) 原核表达载体的构建与转化
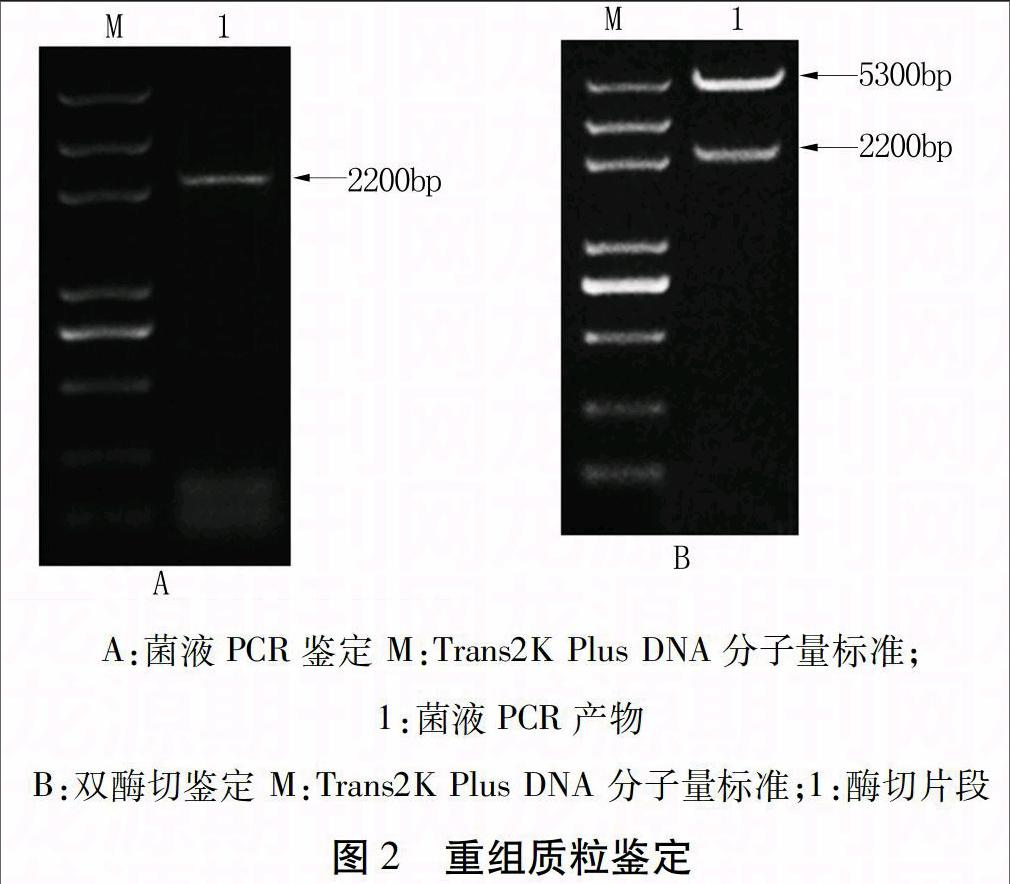
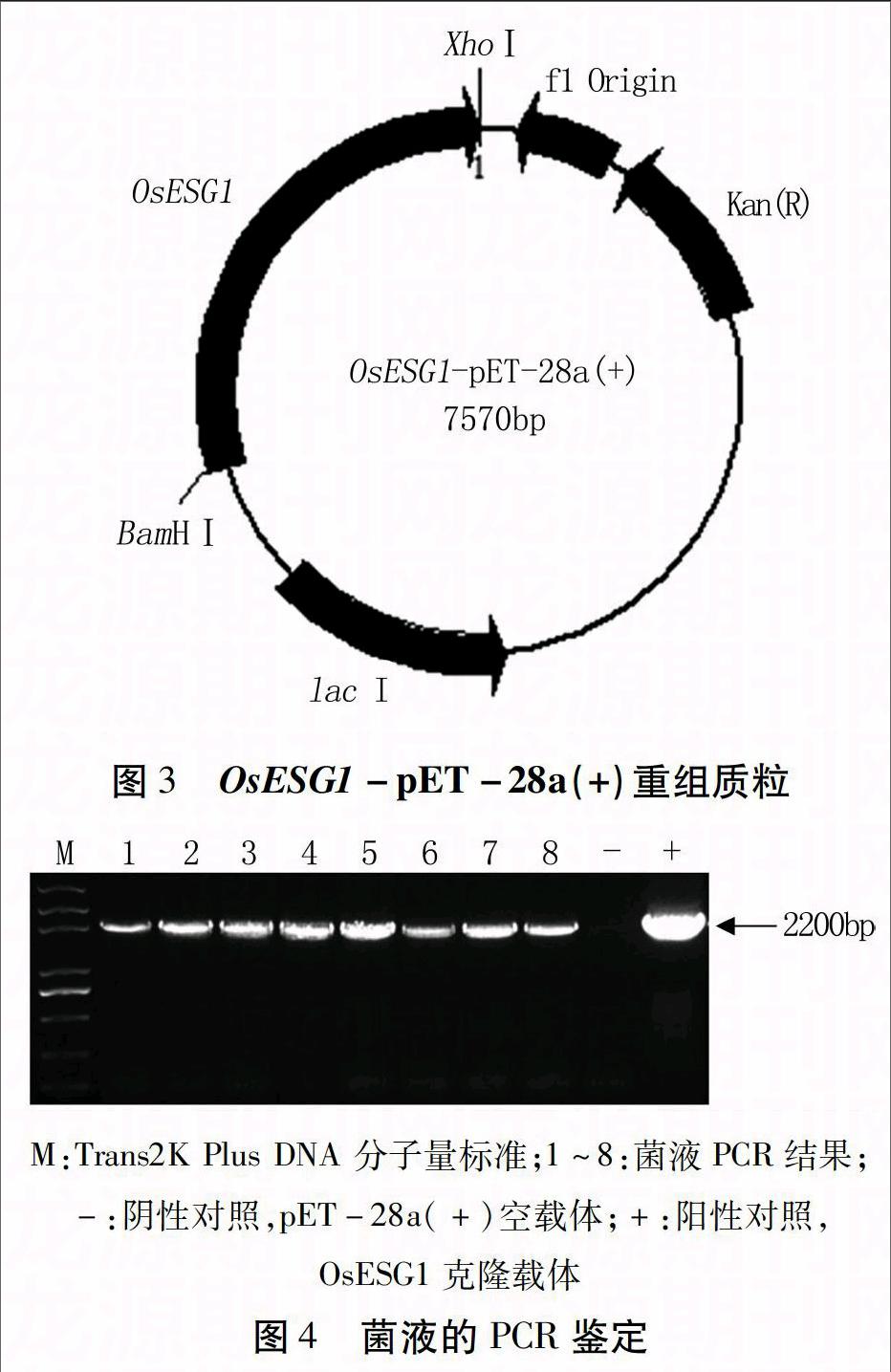
OsESG1全长序列与pET-28a(+) 质粒进行BamHⅠ、XhoⅠ双酶切,回收纯化后以T4 DNA酶连接,转化大肠杆菌感受态,经Kan抗性筛选挑取阳性克隆,经菌液PCR获得约2 200 bp的片段(图2A),重组质粒经BamHⅠ、XhoⅠ双酶切,得到约2 200、5 300 bp的片段(图2B),与预期相符。菌液PCR与质粒双酶切结合测序结果,显示OsESG1已经被正确连接到pET-28a(+)载体上,原核表达载体OsESG1-pET-28a(+)构建成功,载体图谱如图3所示。
将OsESG1-pET 28a(+)重组质粒转入BL21(DE3)中,经卡那霉素抗性筛选,随机挑取菌斑进行PCR检测,均获得阳性条带,表明重组质粒已成功转入BL21(DE3)中(图4)。
2.3 原核蛋白的诱导表达以及SDS-PAGE电泳
含有重组质粒的菌液,经1 mmol/L IPTG在25℃下诱导12 h后,SDS-PAGE电泳结果显示,重组质粒与空载体的菌液上清之间电泳条带差别不明显,含重组质粒的菌液沉淀电泳后出现一条将近80 kD的蛋白条带(图5),而含空载体的菌液沉淀未出现类似条带,表明OsESG1在宿主菌BL21内可被诱导表达,且表达的蛋白产物主要存在于菌液的沉淀中,在上清中含量较少。推测该基因的蛋白产物主要以包涵体的形式存在。
分别取经1 mmol/L IPTG诱导不同时间的菌液,经SDS-PAGE电泳检测,结果显示,1 mmol/L IPTG诱导1 h,几乎检测不到诱导带,随着诱导时间的延长,OsESG1在菌液内的表达量逐渐上升,并在诱导7 h后达到较高的表达水平,之后蛋白质的表达量趋于稳定(图6A)。
以不同IPTG浓度诱导的菌液为样品,经SDS-PAGE电泳显示,0.001 mmol/L的IPTG诱导的蛋白表达量很低,随着IPTG浓度升高,开始出现诱导的蛋白条带,当IPTG浓度达到0.1 mmol/L时,出现明显的蛋白条带,此后随着IPTG浓度的提高,蛋白的表达量没有明显的变化(图6B)。
3 结论与讨论
外源基因表达系统已是生物研究中普遍使用的方法。目前常见的蛋白表达系统有原核表达系统、酵母表达系统、哺乳动物和昆虫表达系统。相对于酵母、昆虫和哺乳动物细胞等真核蛋白表达系统,原核表达系统既是最常用的表达系统,也最经济实惠。其中以大肠杆菌表达系统为代表,是蛋白表达技术中发展最早的表达系统[10]。该表达系统具有遗传背景清楚、培养操作简单、转化和转导效率高、生长繁殖快、成本低廉、可以快速大规模地生产目的蛋白等优点[11]。虽然存在蛋白质翻译后缺乏加工机制,影响如二硫键形成、蛋白糖基化和正确折叠等问题,且得到具有生物活性蛋白的几率较小等缺点,但仍是目前应用最广的经典蛋白表达系统。
目前已有多个水稻基因利用大肠杆菌原核表达系统获得蛋白表达产物。2009年,戈林泉等克隆了水稻β-石竹烯合成酶基因OsCAS并成功进行了原核表达[12];2011年,秦圣光等成功表达了水稻YTB中OSVDAC5蛋白并以蛋白产物制备了抗体[13];2013年,杨加伟等成功表达了水稻Osε-cop1基因并制备了抗体[14]。水稻类受体蛋白激酶基因也有在大肠杆菌表达系统中表达的先例,2008年,程彦伟等利用大肠杆菌系统表达了一个水稻LRR型类受体蛋白激酶胞外区,并成功制备了抗体[15]。由于外源蛋白表达量过大且没有足够的酶对中间体进行折叠加工,导致大多数蛋白通常以无活性包涵体的形式存在,这种情况下,包涵体中的蛋白质依然可以通过His纯化系统进行纯化,且包涵体中的蛋白对抗体的制备并不造成影响。endprint
本研究在前期获得OsESG1基因全长cDNA序列的基础上,利用经典的pET表达系统成功构建了原核表达载体OsESG1-pET-28a(+),并转入大肠杆菌感受态细胞BL21(DE3)内。在初步获得原核蛋白表达产物的基础上,进一步对OsESG1在原核表达系统内的表达条件进行了优化,结果显示,在经1 mmol/L IPTG诱导7 h后,蛋白表达量达到较高水平;且0.1 mmol/L IPTG可诱导蛋白适量表达,为最佳诱导浓度。本试验中,由于OsESG1的蛋白表达产物主要出现在菌液的沉淀部分,推测其主要以包涵体的形式存在,不易溶解于菌液上清,这也是基因进行原核蛋白表达时常见的问题,也使蛋白质的生物活性受到很大影响。下一步将在优化蛋白表达的基础上,进一步对蛋白进行分离纯化,争取获得纯度以及浓度较高的OsESG1,为进一步研究类受体蛋白激酶的活性剂理化功能、分析高级结构以及激酶活性检测及抗体制备等奠定基础。
参 考 文 献:
[1]Lawton M A,Yamamoto R T, Hanks S K, et al. Molecular cloning of plant transcripts encoding protein kinase homologs[J]. Proceedings of the National Academy of Sciences of the United States of America,1989, 86(9):3140-3144.
[2]闫峰,祝传书,庞保平.植物类受体蛋白激酶的研究进展[J].西北植物学报, 2009, 29(4): 851-858.
[3]Clouse S. Brassinosteroid signal transduction: clarifying the pathway from ligand perception to gene expression[J]. Molecular Cell, 2002, 10(5):973-982.
[4]Lally D, Ingmire P, Tong H Y, et al. Antisense expression of a cell wall associated protein kinase, WAK4, inhibites cell elongation and alters morphology [J]. The Plant Cell, 2001, 13(6): 1317-1331.
[5]Hiscock S J, Kües U, Dickinson H G. Molecular mechanisms of self-incompatibility in flowering plants and fungi different means to the same end[J]. Trends in Cell Biology, 1996, 6(11):421-428.
[6]Gomez-Gomez L, Bauer Z, Boller T. Both the extracellular leucine-rich repeat domain and the kinase activity of FLS2 are required for flagellin binding and signaling in Arabidopsis[J]. The Plant Cell, 2001, 13(5):1155-1164.
[7]Endre G, Kereszt A, Devei Z, et al. A receptor kinase gene regulating symbiotic nodule development[J]. Nature, 2002, 417(6892):962-966.
[8]房孝良.水稻中配特异性基因OsESG1及其启动子的研究 [D]. 济南:山东师范大学, 2012.
[9]房孝良,刘炜,安静,等. 水稻种胚特异性启动子OsESP1的克隆及其表达特性[J].作物学报,2011, 37(10): 1904-1909.
[10]Larrick J W, Thomas D W. Producing proteins in transgenic plant and animals [J]. Current Opinion in Biotechnology,2001,12(4):411-418.
[11]Shamik S S, Frederick R B, Sarah W H. Recombinant protein production in an Escherichia coli reduced genome strain [J]. Metabolic Engineering, 2006, 9(2): 133-141.
[12]戈林泉,周国鑫,王祺,等. 水稻β-石竹烯合成酶基因OsCAS的克隆鉴定、原核表达及其遗传转化[J]. 浙江大学学报, 2009, 35(4): 365-371.
[13]秦圣光,程钢,刘学群,等.水稻 YTB 中 OSVDAC5 蛋白的原核表达与抗体制备[J]. 生物技术,2011,21(4):26-29.
[14]杨加伟, 周玲艳, 庄楚雄. 水稻Osε-cop1基因的原核表达及多克隆抗体制备[J]. 基因组学与应用生物学,2013, 32(4):497-502.
[15]程彦伟,李亮,沈嵘,等.水稻 LRR 型类受体蛋白激酶胞外区的原核表达及多克隆抗体制备[J].生物化学与生物物理进展,2008, 35(9):1077-1083.endprint
