水稻抽穗期基因Hd7m的定位及遗传分析
2015-07-18曾莲张华柳絮等
曾莲 张华 柳絮等

摘要:以红旗16为受体、明恢63为供体,经杂交和回交得到BC4F1。利用643对SSR分子标记对所构建的抽穗期基因早晚池和亲本进行多态性筛选,得到4对多态性标记。将筛选出的杂合单株进行自交,获得BC4F2,并从中筛选出抽穗期分离较明显的群体进行田间表型调查和基因型检测。发现目标基因与标记PSM391连锁,位于第7染色体长臂末端,命名为Hd7m。在标记PSM391与第7染色体末端之间合成10对新SSR标记,其中多态性标记RM22156与目标基因相距4.1 cM。该结果为Hd7m基因的精细定位、基因克隆和分子标记辅助育种奠定了基础。
关键词:水稻;抽穗期;基因定位;SSR标记;遗传分析
中图分类号:S511:Q785 文献标识号:A 文章编号:1001-4942(2015)01-0010-04
Abstract Using Hongqi 16 as the receptor and Minghui 63 as the donor, a BC4F1 segregation population was developed through cross between the two parents and backcross with Hongqi 16. The early heading gene pool, late heading gene pool, and the parents were analyzed with 643 pairs of SSR markers, and 4 pairs of polymorphic markers were obtained. BC4F2 populations derived from inbreeding of BC4F1 hybrid plants with obvious segregation phenotype were selected for field investigation and genotype detection. The results showed that the target gene, named Hd7m, was linked to SSR marker PSM391, which located at the end of chromosome 7. Based on the targeted interval, 10 pairs of new SSR markers were synthesized. Among which, the polymorphic marker RM22156 was apart from Hd7m of 4.1 cM. The results laid foundations for fine mapping, gene cloning and molecular marker assisted breeding of Hd7m.
Key words Rice; Heading date; Gene mapping; SSR marker; Genetic analysis
水稻是短日照植物,它的抽穗是通过光周期来调整的。抽穗期是水稻适应环境变化最基本的农艺性状之一。水稻基因间互作及基因和环境间的互作使抽穗期的遗传行为十分复杂。水稻复杂性状遗传学基础的分类,不仅对水稻发展的基础研究方面有很大的影响,对水稻育种也有实际的价值。随着分子标记技术和基因克隆技术的应用,人们对水稻抽穗期遗传机制的研究也逐渐深入,国内外定位了700多个抽穗期QTL(http//www.gramene.org/qtl/index.html),分布在水稻12条染色体上,其中第3、6、7染色体上较多,第10染色体上较少。存在于不同位点上的QTL被检测到的概率取决于自身的效应大小,效应较大的QTL被检测到的概率较大[1]。
日本水稻基因组计划(Rice Genome Research Program, RGP)Yano团队深入研究水稻的QTL,他们用籼粳交组合(Nipponbare/Kasalath)衍生的F2、回交重组自交系(Backcross recombinant inbred line,BIL)和高代回交群体定位了15个水稻抽穗期QTL:Hd1~Hd3a、Hd3b~Hd14[2]。其中,利用日本晴和Kasalath杂种F2代的186个植株和850多个分子标记对影响水稻抽穗期的QTL进行定位,发现2个主效QTLs(Hd1和Hd2)和3个微效QTLs(Hd3、Hd4和Hd5)。其中主效Hd1位于第6染色体中部,另一个基因Hd2位于第7染色体末端[3]。利用日本晴作轮回亲本,Kasalath作供体,分别构建包含Hd1、Hd2和Hd3的近等基因系,并借助RFLP标记对这3个QTLs进行精细定位。其中,Hd1定位于水稻第6染色体RFLP标记R1679和P130之间,并与C235共分离[1]。在Hd1和Hd2座位上,Kasalath等位基因均促进抽穗,在Hd3、Hd4和Hd5座位上,Kasalath等位基因均推迟抽穗。分析表明,通过移除主效基因对表型的影响可以促进微效基因的表达。在BC1F5群体中定位了5个抽穗期QTLs,其中效应较大的2个,分别与Hd1和Hd2处于同一区间,另外3个QTLs(Hd7、Hd8和Hd11)的效应较小[4,5]。以Nipponbare为轮回亲本,对Nipponbare/Kasalath组合进行多次回交和筛选,得到高世代回交群体,用上述遗传背景较单一的回交群体,又检测到两个新的抽穗期QTLs:Hd6和Hd9,两QTL的Kasalath等位基因都推迟水稻抽穗[6,7]。用上述高世代回交群体又定位了Hd4和Hd5,Hd4被定位在第7染色体上,在标记R46和C39最近的区域之间;Hd5被定位在第8染色体短臂C166和R902之间,两个QTLs均为单一的孟德尔因子。Hd5与Hd2在调节抽穗期上表现为加性效应,表明Hd2与Hd5处在不同的光周期途径中。光周期敏感因子Hd3作为与水稻抽穗期相关的QTL最初被定位于第6染色体上,为了验证Hd3的基因型,在长日照和短日照两种条件下分析BC4F2群体Hd3区段中20个重组单株的抽穗期,发现该区段包含两个影响抽穗期的基因,分别命名为Hd3a和Hd3b[8]。后来,在Nippobare/Kasalath衍生的高世代群体中又鉴定到了Hd10、Hd12、Hd13和Hd14共4个影响水稻抽穗期的QTLs[9]。endprint
近年来,国内外在精细定位的基础上克隆了大量与水稻抽穗期相关的基因,如Hd1、Hd2、Hd3a、Hd3b、RFT1、DTH8等,并研究它们对抽穗期调控的相互作用,为国内外学者们对水稻抽穗期的相关研究提供了重要的参考依据。本试验所用的材料BC4F2为高世代回交重组自交群体,其抽穗期性状稳定遗传,受1对等位基因(Hd7m)控制。本研究为Hd7m的精细定位、分子标记辅助育种和基因克隆提供了重要的依据。
1 材料与方法
1.1 试验材料
以红旗16为受体亲本,以明恢63为供体亲本,杂交得F1,以红旗16为回交亲本得BC4F1并收取种子。将回交得到的种子自交得BC4F2,从中选出抽穗期分离较明显的群体。
1.2 试验方法
1.2.1 材料种植 试验在山东省农业科学院生物技术研究中心饮马泉农场进行,2013年4月20日播种、6月2日插秧,同年筛选到抽穗期分离明显的群体,编号R185。选择R185中基因型均表现为杂合的单株种子,于2014年4月28日播种、6月1日插秧,同年筛选出抽穗期分离明显的群体,编号LL。
1.2.2 田间抽穗期调查 每3天进行一次田间调查,以单株的第一个穗子抽出1 cm作为抽穗日,以播种日至抽穗日的天数作为抽穗期,对亲本、回交群体每个单株进行抽穗期记载。
1.2.3 水稻DNA的提取及SSR分子标记分析 用TPS法提取水稻DNA备用。用BSA法[10]分别构建抽穗期DNA早晚池。根据网上(http: // www.gramene.org)已发表的标记序列合成SSR标记。PCR扩增按照Panaud等(1996)的方法[11]进行部分修改后使用。配置20.5 μL反应体系,包括2 μL DNA模板、0.1 μL dNTP、2 μL 10×buffer、13.2 μL ddH2O、0.2 μL Taq酶、3 μL 10 μmol/L引物。PCR仪扩增程序为94℃预变性5 min;94℃ 1 min,55℃ 1 min,72℃ 1 min,35个循环;72℃延伸10 min。PCR产物经6%变性聚丙烯酰胺凝胶电泳及银染显色,记录单株带型结果,拍照保存。
1.2.4 用早熟单株定位Hd7m在染色体上的位置 结合田间表型对基因型进行分析。用筛选出的4对多态性标记对早熟的97个单株逐个进行基因型检测,计算分离群体的重组率,C=(N1+N2/2)/N,其中N为早熟纯合基因型的总株数,N1为晚熟纯合基因型的总株数,N2为杂合基因型的总株数[12]。用MapDraw对目标基因进行连锁分析。
2 结果与分析
2.1 分离群体的表型及遗传分析
明恢63抽穗期为114天,红旗16抽穗期为120天。选用次级分离群体中抽穗期分离较明显的群体LL,其抽穗期在95~143天,呈双峰分布(图1),以107天为分界。卡方分析表明,LL早抽穗植株和晚抽穗植株数目的分离比符合1∶3 (χ2=0.72<χ20.05,1=3.84,表1)[2]。因此,认为分离群体的抽穗期受1对等位基因控制,且晚抽穗对早抽穗表现为完全显性。
2.2 目标基因的定位
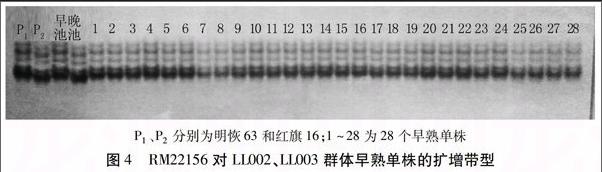
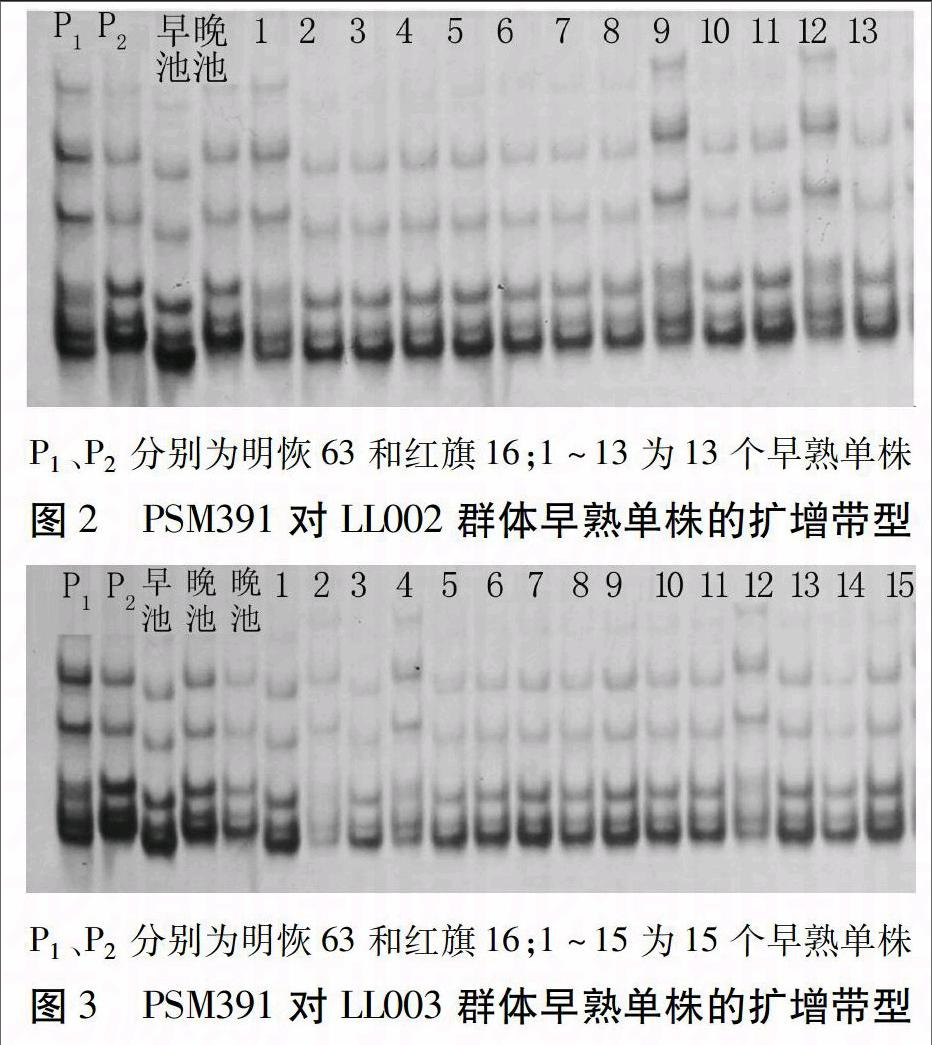
利用合成的643对SSR标记对亲本及所构建的基因早晚池进行多态性筛选,得到多态性标记PSM353、RM505、RM18和PSM391。因LL群体中晚熟植株数量较大且抽穗期较分散,因此,选用早熟的97个单株作为定位群体,用4对标记对LL群体单株进行基因型验证(以LL002和LL003群体为例,图2、3)。经重组率计算,目标基因离4对标记的遗传距离分别为38、34、26.8 cM和13.4 cM。根据物理图谱和田间表型分析,目标基因位于PSM391与第7染色体末端之间,命名为Hd7m。
为了能将Hd7m基因限定在更小的范围内,在标记PSM391与第7染色体末端区域间合成了10对新标记,对亲本及基因早晚池进行多态性筛选,得到多态性标记RM22156。用标记RM22156对LL分离群体中97个早熟单株进行验证(图4)。通过重组率计算,Hd7m与标记RM22156相距4.1 cM(图5)。
3 讨论与结论
抽穗期是影响水稻品种栽培地区和栽培季节的重要农艺性状,对水稻抽穗期基因进行精细定位,有助于抽穗期基因克隆和分子标记辅助育种。目前,国内外学者对不同的水稻品种进行了抽穗期QTL的定位与克隆的研究,通过构建不同QTL的近等基因系,对Hd1、Hd2、Hd3、Hd6和Hd9进行了精细定位分析,其中Hd2定位于第7染色体末端,距RFLP标记C586为0.5 cM[6,13,14],是OsPRR37的同源基因[15,16],OsPRR37的位置为29617430-29628600 bp[2]。本试验定位的Hd7m与第7染色体标记RM22156相距4.1 cM,根据网站(http: //www.gramene.org)得到RM22156的位置为29146343-29146365 bp(C586的位置为29267487-29268073 bp)。Hd7m与OsPRR37和C586分别相距1.9 cM和0.5 cM。推测该基因可能与Hd2等位,然而,二者是否是同一基因,需要经精细定位或等位性分析才能得到证实。
根据本试验结果,LL次级分离群体的抽穗期出现早晚极端表现型,早抽穗植株和晚抽穗植株数目的分离比符合1∶3,推测该次级分离群体抽穗期受1对等位基因控制,且控制早抽穗的等位基因来自供体明恢63,控制晚抽穗的等位基因来自受体红旗16。在本试验进程中,因种植地的面积限制、环境与基因间的互作和该性状遗传基础的复杂性等各方面的影响,需要对已有试验结果的验证和进一步试验的补充才能得到更精确的结果,为Hd7m的精细定位和克隆提供重要信息。
参 考 文 献:endprint
[1]Yano M, Sasaki T. Genetic and molecular dissection of quantitative traits in rice [J]. Plant Mol. Biol., 1997, 35: 145-153.
[2]李广贤. 基于单片段代换系的水稻抽穗期QTL分析[D]. 泰安:山东农业大学, 2014.
[3]Yano M, Harushima Y, Nagamura Y, et al. Identification of quantitative trait loci controlling heading date in rice using a high density linkage map [J]. Theor. Appl. Genet., 1997, 95: 1025-1032.
[4]Lin S Y, Sasaki T, Yano M. Mapping quantitative trait loci controlling seed dormancy and heading date in rice, Oryza sativa L, using backcross inbred lines [J]. Theor. Appl. Genet., 1998, 96: 997-1003.
[5]Yano M, Kojima S, Takahashi Y, et al. Genetic control of flowering time in rice, a short-day plant [J]. Plant Physiol., 2001, 127: 1425-1429.
[6]Yano M, Katayose Y, Ashikari M, et al. Hd1, a major photoperiod sensitivity quantitative trait locus in rice, is closely related to the Arabidopis flowering time gene CONSTANS [J]. Plant Cell, 2000, 12: 2473-2483.
[7]Lin H X, Ashikari M, Yamanouchi U, et al. Identification and characterization of a quantitative trait locus Hd9, controlling heading date in rice [J]. Breed Sci., 2002,52: 35-41.
[8]Monna L, Lin H X, Kojima S, et al. Genetic dissection of a genomic region for a quantitative trait locus, Hd3, into two loci, Hd3a and Hd3b, controlling heading date in rice [J]. Theor. Appl. Genet., 2002, 104: 772-778.
[9]Lin H X, Liang Z W, Sasaki T, et al. Fine mapping and characterization of quantitative trait loci Hd4 and Hd5 controlling heading date in rice [J]. Breed Sci., 2003, 53: 51-59.
[10]Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregation analysis: a rapid method to detect markers in specific genomic regions by using segregating populations [J]. Proc. Natl. Acad. Sci. USA, 1991, 88: 9828-9832.
[11]Panaud O, Chen X, McCouch S R. Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (Oryza sativa L.) [J]. Mol. Gen. Genet., 1996, 252: 597-607.
[12]Zhang Q, Shen B Z, Dai X K, et al. Using bulked extremes and recessive class to map genes for photoperiod-sensitive genic male sterility in rice [J]. Proc. Natl. Acad. Sci. USA, 1994, 91: 8675-8679.
[13]Kojima S, Takahashi Y, Kobayashi Y, et al. Hd3a, a rice ortholog of the Arabidopsis FT gene, promotes transition to flowering downstream of Hd1 under short day conditions [J]. Plant Cell Physiol., 2002, 43(10): 1096-1105.
[14]龚晓平, 杨正林, 赵明芳,等. 一个水稻抽穗期主基因Hd(t)的遗传分析及分子定位[J].作物学报,2007,33 (11): 1906-1909.
[15]Kazuki M, Kiyosumi H, Eri O T, et al. Cloning of quantitative trait genes from rice reveals conservation and divergence of photoperiod flowering pathways in Arabidopsis and rice [J]. Plant Sci., 2014, 5: 193.
[16]Koo B H, Yoo S C, Park J W, et al. Natural variation in OsPRR37 regulates heading date and contributes to rice cultivation at a wide range of latitudes [J]. Mol. Plant, 2013, 6(6): 1877-1888.endprint
