心脏死亡器官捐献供肾移植与司法途径标准供者供肾移植术后早期效果分析比较
2015-07-07邱涛张璐周江桥陈忠宝马枭雄张龙
邱涛 张璐 周江桥 陈忠宝 马枭雄 张龙
长久以来,我国的器官移植主要依赖于司法途径来源的供器官。近5 年来,国家大力提倡心脏死亡器官捐献(donation after cardiac death,DCD),为器官移植开辟了新的供器官来源[1]。DCD 供器官移植有别于传统的司法途径标准供者(standard criteria donors,SCD)供器官移植,在此过程中出现的许多新问题值得进一步研究探讨。武汉大学人民医院器官移植科从2011 年开始进行DCD 供肾移植,本文对我中心施行的DCD 供肾移植与同期开展的SCD 供肾移植的短期效果进行比较,现报道如下。
1 资料与方法
1.1 临床资料
回顾性分析我中心2011 年1 月至2014 年12 月连续施行的74 例DCD 供肾移植和143 例SCD 供肾移植的临床资料。DCD 组74 例受者中男性44 例,女性30 例,平均年龄(46 ±9)岁(21 ~63 岁),二次肾移植2 例;术前检查群体反应性抗体(panel reactive antibodies,PRA)<10% 有61 例,10% ~30%有9 例,>30% 有4 例,HLA 错配数平均为(3.1 ±1.3)个。SCD 组143 例受者中男性101 例,女性42 例,平均年龄(47 ±11)岁(19 ~64 岁),二次肾移植9 例;术前检查PRA <10%有124 例,10% ~30%有16 例,>30% 有3 例;HLA 错配数平均为(2.7 ±1.2)个。
74 例DCD 供肾来自于45 例供者,年龄2 ~71 岁;24 例为脑死亡,12 例为脑心双死亡,9 例为心脏死亡;原发病中脑外伤19 例,脑血管疾病15 例,缺氧性脑病3 例,脑肿瘤6 例,其他2 例。DCD 组和SCD 组受者透析时间分别为5.6 ~53.9 个月、6.5 ~49.0 个月。
两组受者性别、年龄、移植次数、PRA、HLA 错配数、透析时间均具有可比性(P 均>0.05)。DCD组热缺血时间平均为(16 ±6)min,SCD 组平均为(7 ±5)min,差异有统计学意义(t = 11. 72,P <0.05);而DCD 组冷缺血时间平均为(3.4 ±1.4)h,较SCD 组(11 ±7)h 短,差异有统计学意义(t =-11.40,P <0.05)。DCD 组中2 例供肾采用机械灌注,另外72 例DCD 供肾和143 例SCD 供肾全部采用单纯静态低温保存。
移植物功能延迟恢复(delayed graft function,DGF)定义为移植术后1 周内因血清肌酐升高或尿量减少而导致受者出现容量负荷过重,常需要进行透析治疗,以停止血液透析作为判断DGF 恢复的标准[2]。根据2007 Banff 标准确诊移植肾急性排斥反应,以尿量和血清肌酐恢复到发生排斥反应前的水平判定为治愈。根据呼吸道症状、体征、影像学检查以及病原学检查结果确诊术后肺部感染,以临床症状消失、肺部CT 提示感染灶全部吸收判定为治愈。
免疫诱导方案:标准双剂巴利昔单抗或术中开始连续5 d 使用抗胸腺细胞免疫球蛋白(antithymocyte immune globulin,ATG)100 mg/d。DCD 组受者37 例采用ATG 诱导,37 例采用巴利昔单抗诱导;SCD 组受者32 例采用ATG 诱导,111 例采用巴利昔单抗诱导。免疫抑制方案:两组受者均采用三联免疫抑制方案(吗替麦考酚酯+他克莫司+泼尼松)。术前开始口服免疫抑制剂吗替麦考酚酯和他克莫司;术中静脉应用甲泼尼龙0.5 ~1.0 g,术后0.5 g/d,连用3 d。出现移植肾排斥反应时,采用甲泼尼龙冲击治疗,0.5 g/d,总剂量1 ~2 g;若无法逆转,改为ATG 25 ~50 mg/d,连用5 d。他克莫司血药浓度谷值分别维持在8 ~12 μg/L(术后1 ~2 个月)、7 ~8 μg/L(术后3 ~6 个月)、5 ~8 μg/L(术后7 ~12 个月)。
1.2 随 访
术后3 个月内每周随访1 次,复查血常规及肝肾功能、电解质,监测他克莫司血药浓度,监测排斥反应和感染情况。术后4 ~6 个月每2 周随访1 次,6 个月以后每个月随访1 次。当受者出现发热、腹痛、腹泻、尿量减少、血压异常、尿常规提示蛋白尿和镜下血尿等改变时,及时复查。
1.3 统计学方法
采用SPSS 18.0 统计软件进行数据处理。计量资料以均数±标准差()表示,两组受者年龄、透析时间、热缺血时间、冷缺血时间等指标比较采用成组t 检验。计数资料以百分数表示,两组受者和移植肾存活比例、DGF 发生率、排斥反应发生率、肺部感染发生率比较采用卡方检验。P <0.05 为差异有统计学意义。
2 结 果
2.1 受者和移植肾6 个月存活及并发症情况
术后6 个月,DCD 组死亡5 例,其中1 例因发生DGF 后脑出血死亡,1 例因肾动脉破裂行移植肾切除后出现吻合口动脉瘤破裂死亡,3 例因肺部感染死亡;SCD 组死亡8 例,其中1 例因肾动脉破裂死亡,1 例二次肾移植受者因首次肾移植移植肾肿瘤伴转移死亡,1 例因主动脉夹层破裂死亡,1 例因多囊肾切除后出血死亡,4 例因肺部感染死亡。两组受者术后6 个月存活比例分别为93.2%(69/74)和94.4%(135/143),差异无统计学意义(χ2=0.12,P >0.05)。
DCD 组移植肾6 个月存活比例为90.5%(67/74),除5 例受者死亡外,1 例术后创面大出血,移植肾静脉血栓形成行移植肾切除,1 例术后4 个月因发生急性排斥反应而导致移植肾失功,后恢复血液透析。SCD 组移植肾6 个月存活比例为93.0%(133/143),除8 例受者死亡外,1 例因肾静脉根部撕裂出血无法控制致切肾,1 例术后5 个月因排斥反应致移植肾失功恢复透析。两组移植肾存活比例差异无统计学意义(χ2=0.41,P >0.05)。DCD 组和SCD 组术后DGF 发 生 率 分 别 为28. 4% (21/74)和7. 0%(10/143),差异有统计学意义(χ2= 18. 21,P <0.05)。术后6 个月内DCD 组和SCD 组急性排斥反 应 发 生 率 分 别 为13. 5% (10/74)和7. 0%(10/143),差 异 无 统 计 学 意 义(χ2= 2. 48,P >0.05)。术后6 个月内肺部感染发生率分别为14.9%(11/74)和21.0%(30/143),差异无统计学意义(χ2=1.19,P >0.05)。DCD 组有3 例因肺部感染死亡(1 例真菌感染、2 例CMV 感染),SCD 组有4 例(1 例结核、1 例真菌感染,2 例混合感染)。
2.2 移植肾功能评价
DCD 组和SCD 组受者术后1 个月血清肌酐分别为(149 ±65)、(106 ±60)μmol/L,术后3 个月血清肌酐分别为(132 ±78)、(101 ±63)μmol/L,差异均有统计学意义(t =4.74 和2.95,P 均<0.05);术后6 个月血清肌酐分别为(122 ±90)、(107 ±78)μmol/L,差异无统计学意义(t = 1. 22,P >0.05)。详见图1。
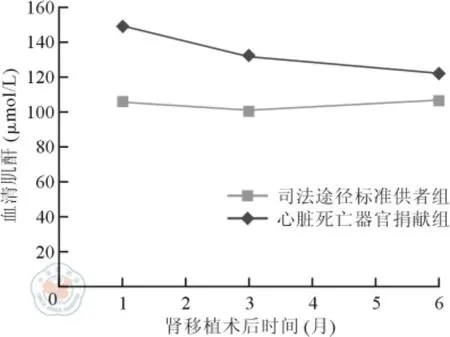
图1 心脏死亡器官捐献组和司法途径标准供者组受者术后6 个月内血清肌酐比较
3 讨 论
供器官来源短缺一直是制约器官移植发展的主要原因。许多终末期肾病患者因为等不到合适的供肾最终在透析中走向死亡[3]。扩展供器官来源,规范器官移植一直是器官移植领域长期追求的目标。2010 年起我国开始试行DCD,为扩展供器官来源提供了一条新的渠道,同时也避免了我国既往使用司法途径来源供器官被国际社会诟病的弊端[4]。DCD供者经历儿茶酚胺风暴,导致全身循环不稳定,易出现组织脏器缺血、缺氧。接受高龄边缘供者,特别是伴有高血压、糖尿病、高脂血症等基础疾病供者的供器官,受者术后并发症更加明显。国外报道,使用DCD 供肾移植,术后原发性移植物无功能和DGF 发生率较高[2]。国内研究也发现,DCD 供肾移植术后DGF 发生率增高[5-6]。本研究结果显示,DCD 供肾移植受者中发生DGF 比例高达28.4%,而SCD 组只有7.0%。受者发生DGF 会增加围手术期肺部感染发生率,DCD 组中21 例发生DGF 的受者中8 例发生肺部感染,其中1 例死亡。同时,DCD 供肾移植后DGF 持续时间长,平均15 d,最长一例达92 d;而SCD 组DGF 持续时间为1 ~3 周。可以通过改善供者血压、氧饱和度以及肾组织间质水肿来降低DGF 发生率,还可以使用机械灌注和体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技术[7]。结合文献报道发现,边缘供肾使用机械灌注后,不仅DGF 发生率降低,同时还减少了DGF 的持续时间[8]。但有文献报道,与脑死亡器官捐献供肾移植相比,虽然DCD 供肾移植术后DGF 发生率更高、持续时间更长,但这并不足以比较在不同移植供者背景下的预后情况[9]。
由于免疫抑制剂的大量使用,特别是免疫诱导药物的使用,可以显著降低围手术期急性排斥反应的发生,因此整体而言,本研究中两组受者急性排斥反应发生率均较低,但与SCD 组相比,DCD 组受者仍显示出较高的排斥反应发生率。出现急性排斥反应后使用甲泼尼龙或者T 细胞清除剂可获得良好的治疗效果[10]。
SCD 组观察期长,病例主要集中在2011 ~2012 年;而DCD 组观察期短,病例主要集中在2013 ~2014 年。因此,我们比较了DCD 组和SCD 组受者术后6 个月内肺部感染发生率,差异无统计学意义,但得出结论仍需长期、大样本的观察研究。Fernández-Ruiz等[11]研究显示,与脑死亡器官捐献组相比,DCD 组DGF 以及移植肾失功发生率更高,但是急性排斥反应发生率和总死亡率较低;DCD 组总体感染率、细菌、CMV 以及非CMV 感染发生率更高。DCD 供肾移植后DGF 状态是感染的潜在危险因素,使用高效价免疫诱导药物和发生排斥反应也增加了移植术后6 个月内机会性感染的风险,同时来源于供器官的病原体传播也是感染增加的一个途径。近2 年来,我中心开始实施全面预防治疗,针对CMV 和肺孢子菌使用更昔洛韦和磺胺类药物预防性治疗6 个月,从而使肾移植术后6 个月内感染率显著降低。目前针对肾移植受者,推荐普遍预防策略,即移植后对所有受者均给予抗病毒药物预防性治疗,特别是对接受ATG 诱导治疗、伴发DGF、伴发排斥反应等高危受者,可以显著降低移植后感染发生率[12]。
影响受者存活的因素除肺部感染外,还包括发生DGF 期间出现的心脑血管意外。有研究显示,动脉粥样硬化是肾移植术后早期移植失败甚至受者死亡的高危因素[13]。本研究中,两组都有因心脑血管意外造成受者死亡的病例。国外报道DCD 来源的供器官引发受者术后真菌感染率升高,真菌侵蚀移植肾动脉吻合口,会造成大出血死亡。由于真菌侵蚀肾动脉可能造成移植肾丢失甚至受者死亡,因此需要采取积极应对措施,包括预防供、受者真菌感染治疗以及吻合口重建等[13]。
国内外研究均提示,DCD 移植肾功能恢复缓慢,术后3 个月基本可恢复正常,受者发生DGF 虽增加住院天数,但不影响受者和移植物生存率[14-15],这同本研究相一致。DCD 供肾移植后移植肾功能恢复缓慢,一部分原因是供肾本身质量问题:包括高龄供者、移植肾急性损伤、供者存在高血压和糖尿病等基础疾病以及较长的热缺血时间。本研究中,肾移植术后1 个月内SCD 组受者血清肌酐明显优于DCD 组,这种差距在术后6 个月后缩小,统计学上无明显差异,这同其他研究报道的DCD 供肾移植后肾功能恢复的时间趋势是相一致的[15-17]。
总体而言,DCD 供肾移植术后DGF 和急性排斥反应的发生率升高,短期移植肾功能恢复慢,肺部感染发生率增加,但短期移植物及受者存活情况同SCD 供肾移植相一致。
1 中华医学会器官移植学分会. 中国心脏死亡器官捐献工作指南(2 版)[J/CD]. 中华移植杂志:电子版,2012,6(3):221-220.
2 Seo CH,Ju JI,Kim MH,et al. Risk factors and long-term outcomes of delayed graft function in deceased donor renal transplantation[J].Ann Surg Treat Res,2015,89(4):208-214.
3 Link DK,Saxena R. The right patient,the right treatment,the right access and the right time[J]. Adv Chronic Kidney Dis,2014,21(4):360-364.
4 Huang J,Wang H,Fan ST,et al. The national program for deceased organ donation in China[J]. Transplantation,2013,96(1):5-9.
5 刘斌,曾凡军,陈知水,等. 心脏死亡器官捐献供者肾移植的近期效果评价[J]. 第三军医大学学报,2015,37(1):64-68.
6 陈国栋,袁小鹏,李军,等. 心脏死亡器官捐献供肾与传统尸体供肾肾移植的疗效比较[J]. 中华器官移植杂志,2013,34(7):392-395.
7 Wszola M,Kwiatkowski A,Diuwe P,et al. One-year results of a prospective,randomized trial comparing two machine perfusion devices used for kidney preservation[J]. Transpl Int,2013,26(11):1088-1096.
8 项和立,薛武军,田普训,等. 心脏死亡器官捐献供体器官功能的评估和维护[J]. 中华泌尿外科杂志,2014,35 (1):20-23.
9 Tojimbara T,Fuchinoue S,Iwadoh K,et al. Improved outcomes of renal transplantation from cardiac death donors:a 30-year single ceter experience[J]. Am J Transplant,2007,7(3):609-617.
10 Chen GD,Lai XQ,Ko DS,et al. Comparison of efficacy and safety between rabbit anti-thymocyte globulin and anti-T lymphocyte globulin in kidney transplantation from donation after cardiac death:a retrospective cohort study[J]. Nephrology (Carlton),2015,20(8):539-543.
11 Fernández-Ruiz M,Andrés A,López-Medrano F,et al. Infection risk in kidney transplantation from uncontrolled donation after circulatory death donors[J]. Transplant Proc,2013,45(4):1335-1338.
12 Hodson EM,Craig JC,Strippoli GF,et al. Antiviral medications for preventing cytomegalovirus disease in solid organ transplant recipients[J]. Cochrane Database Syst Rev,2008,5(4):85-86.
13 Ram Reddy C,Ram R,Swarnalatha G,et al. " True" mycotic aneurysm of the anastomotic site of the renal allograft artery[J]. Exp Clin Transplant,2012,10(4):398-402.
14 Ledinh H,Weekers L,Bonvoisin C,et al. Results of kidney transplantation from controlled donors after cardio-circulatory death:a single center experience[J]. Transpl Int,2012,25(2):201-209.
15 Xiaoming P,Xiang H,LinJuan L,et al. Preliminary results of transplantation with kidneys donated after cardiac death:a path of hope for organ transplantation in China[J]. Nephrol Dial Transplant,2015,30(9):1590-1596.
16 Salmeron-Rodriguez MD, Navarro-Cabello MD, Agüera-Morales ML,et al. Short-term evolution of renal transplant with grafts from donation after cardiac death:Type Ⅲ Maastricht category[J].Transplant Proc,2015,47(1):23-26.
17 Wadei HM,Heckman MG,Rawal B,et al. Comparison of kidney function between donation after cardiac death and donation after brain death kidney transplantation[J]. Transplantation,2013,96(3):274-281.
