盐胁迫对低温预处理石榴种子萌发及幼苗生理生化的影响
2015-07-04尹燕雷陶吉寒杨雪梅冯立娟
武 冲,尹燕雷,陶吉寒,杨雪梅,冯立娟
(山东省果树研究所,山东泰安271000)
盐渍化地区林木稀少、土地荒芜、生态条件恶化,严重制约了当地农林经济和社会发展[1]。如今人们越来越重视耐盐植物的资源调查、耐盐机制探索、耐盐植物筛选利用以及耐盐植物新品种培育的研究[2]。石榴(PunicagranatumL.)属石榴科(Punicaceae)石榴属(PunicaL.)植物,其果实具有抗细菌、抗寄生、抗病毒和抗癌等作用,花具有很高的观赏价值,是集生态、经济、社会效益、观赏价值与保健功能于一身的优良果树。
石榴是海涂盐浸土地果树开发的先锋树种之一,可在含盐量0.3%左右土壤上正常生长[3]。目前有关石榴的研究重点集中在新品种选育、果实组分分析、果色形成机理等方面[4-7],而在石榴抗逆性方面研究工作还很薄弱。低温预处理可以提高种子抗盐能力已在草本植物中得到多方面的证实[8-10],而在木本植物种子方面的相关研究很少,目前还没有关于低温预处理石榴种子耐盐萌发研究的报道。因此,本试验以山东枣庄主栽石榴品种‘峄城大青皮甜’种子为材料,研究了低温预处理石榴种子在盐胁迫下的萌发能力、保护酶活性、可溶性蛋白含量、相对电导率等指标响应特征,初步探讨石榴种子的抗盐机理,以期为生产实践提供理论依据。
1 材料和方法
1.1 试验材料
供试材料为2013年9月底在山东枣庄峄城采集的‘峄城大青皮甜’石榴。于2014年1月取出果实内的种子,用纱布反复搓洗干净备用。种子千粒重28.53g。
1.2 试验处理
1.2.1 低温预处理 2014年5月22日开始进行发芽试验。将种子用3层湿纱布包裹,置于25℃培养室内进行催芽。催芽时,每天用清水冲洗种子,保证种子萌发所需水分。2周后,选取籽粒饱满的种子2 000 粒为一组,1800粒试验,200粒待用,共4组。用0.5% HgCl2对种子表面消毒10min,之后用清水反复冲洗5 次。将种子放入覆盖湿纱布的15cm 培养皿中,置于2~4℃低温下分别处理0(未低温预处理,CK1)、5、10和15d后用于NaCl胁迫处理。
1.2.2 NaCl溶液处理 试验设置0.1%、0.2%、0.3%、0.4%、0.5%和0.6%等6种浓度NaCl溶液处理,以清水作为对照(CK2),3次重复,每重复100粒。在直径15cm 培养皿中置2层滤纸,先用少量相应浓度NaCl溶液浸润,将不同处理的石榴种子整齐摆放其中,培养温度为25℃。在人工培养箱中萌发25d后取样测定相关指标。
1.3 测定指标及方法
1.3.1 发芽能力指标 参照《国际种子检验规程》[11]公式计算发芽率和发芽势:
发芽率(%)=种子发芽数/供试种子数×100%
发芽势(%)=发芽进程当日发芽最多种子发芽数/供试种子数×100%
1.3.2 幼苗形态指标 发芽试验结束后,在每个处理3次重复中分别随机抽取10株幼苗,测其上胚轴和胚根长。
1.3.3 幼苗抗氧化酶活性和渗透调节物质含量 取各处理已完全展开叶片,立即带回实验室进行超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,以及脯氨酸和可溶性蛋白含量的测定。SOD 活性的测定采用NBT 氧化还原法;POD 活性的测定采用愈创木酚法,以上指标的测定方法均参照《植物生理生化实验原理和技术》[12]。CAT 活性测定采用紫外吸收法;脯氨酸含量的测定用茚三酮法;可溶性蛋白含量测定用考马斯亮蓝G-250染色法,均参照《植物生理实验指导》[13]。所有指标测定均重复3次,最终结果为试验平均值。
1.3.4 细胞膜透性 采用电解质外渗电导法测定[14]。称取0.3g发芽种子,冲洗干净,加入10mL去离子水,充分振荡后静置24h,采用DDS211型电导率仪测定其电导率初值L1,沸水浴10 min冷却至室温,测其电导率终值L2,计算相对电导率,5次重复。
相对电导率(L)=(L1-蒸馏水电导率)/(L2-蒸馏水电导率)×100%
1.4 数据处理
利用Excel 2007计算各指标的平均值,并绘制图表,采用SAS 统计软件中的ANOVA 方法对测量数据进行方差分析,用Duncan法进行多重比较(LSD)[15]。
2 结果与分析
2.1 低温预处理对盐胁迫下石榴种子萌发的影响
由表1可知,随着盐浓度升高,各低温预处理石榴种子的发芽率和发芽势均表现出先升高后降低的趋势,并在0.1%盐浓度下达到最高值。在0.1%盐浓度下,石榴种子可以正常萌发,除低温处理5d的发芽势和发芽率与对照(CK2)相近外,其它处理均显著高于CK2;在0.2%盐浓度下,石榴种子发芽率除低温处理5d外均显著低于CK2,而发芽势均与对照(CK2)差异不显著;但当盐浓度高于0.3%时,各盐胁迫处理的发芽率和发芽势显著低于CK2。在相同浓度盐胁迫下,各低温预处理石榴种子的发芽率和发芽势也随着处理间延长先升后降,并均在处理5d时达到最大。低温处理5d时,各盐分梯度下种子萌发率和发芽势均高于相应未低温处理对照(CK1);低温预处理10d时,盐浓度低于0.4%处理的发芽率和发芽势也高于相应CK1,其余均低于相应对照,但未达到显著水平;低温预处理15d时,各处理种子的发芽率均低于相应CK1,当盐浓度低于0.3%时种子发芽势也低于CK1。可见,低温处理5和10d能显著提高石榴种子发芽率和发芽势,并以低温处理5d效果较好,长时间低温处理则抑制了种子萌发;石榴种子可以在盐浓度低于0.2%条件下正常萌发,当盐浓度高于0.2%时萌发受到抑制,且随着盐浓度升高抑制作用越显著;石榴种子在适当的低温处理(5d)和低盐胁迫(0.1%)条件下的萌发力比单一低温或者低盐处理更强。
2.2 低温预处理对盐胁迫下石榴幼苗形态的影响
表2显示,低温预处理5d时,石榴幼苗胚根、胚轴长度均显著大于其它处理(P<0.05);低温预处理10d石榴幼苗胚根、胚轴长度稍小于CK1;低温预处理15d 时,幼苗生长受到抑制,显著小于CK1。不同盐浓度处理种子对幼苗胚根、胚轴生长影响差异显著(P<0.05)。其中,幼苗胚根、胚轴长度在盐浓度为0.1%时显著大于对照CK2,在浓度为0.2%时稍小于对照CK2,而当高于0.3%时显著小于对照CK2。另外,种子萌发最重要的是获得壮苗,根冠比的大小是壮苗的重要标志,根冠比越大,幼苗越壮,反之越弱。表2结果表明低温处理5d、0.1%的低盐浓度时石榴幼苗根冠比最大,幼苗健壮。可见,低温处理和低盐胁迫对石榴幼苗生长有促进作用,但长时间的低温和高浓度盐处理对幼苗会造成伤害;幼苗在低温处理5d和0.1%盐浓度下的生长比单独低温处理或低盐胁迫条件下更快,即适当低温处理可以促进石榴种子在低盐条件下健壮生长。

表1 低温预处理对盐胁迫下石榴种子发芽影响Table1 Effect of pre-chilling treatment on germination of black Punica granatum seeds under salt stress
2.3 低温预处理对盐胁迫下石榴幼苗保护酶活性的影响
2.3.1 SOD 活性 由表3可知,在盐胁迫下,石榴幼苗SOD 活性随着盐浓度的升高呈先升高后下降的趋势,且各处理幼苗SOD 活性均在盐浓度为0.3%时达到最大值,说明石榴幼苗在低于0.3%盐浓度下可以通过提高SOD 活性来适应外界盐分变化,但当盐浓度高于0.3%时SOD 活性受到抑制,从而造成盐害。同时,低温处理5和10d不同程度地提高了幼苗SOD 活性,增强了石榴种子抗盐萌发能力,且在低温处理5d时与其它处理间差异显著;低温处理15d 时,幼苗SOD 活性显著低于对照CK1,说明长时间的低温处理对石榴幼苗生长会造成伤害。
2.3.2 POD 活性 各低温预处理石榴幼苗POD活性均随盐浓度的升高呈先升高后下降变化趋势,并在盐浓度0.3%时达到最大;在无盐胁迫条件下(CK2),除低温处理15d幼苗POD 活性显著低于其它低温处理外,而其它低温处理间无显著性差异;但在不同浓度盐胁迫下,幼苗POD 活性在低温处理5d均显著大于其它处理,在低温处理10d与对照CK1差异不显著,而在低温处理15d时显著低于低温对照。说明在盐胁迫环境中,低温处理5d能显著增强幼苗POD 活性,但长时间的低温处理对石榴幼苗生长反而会造成伤害。

表2 低温预处理对盐胁迫下幼苗生长的影响Table2 Effect of pre-chilling treatment on seedling growth under salt stress
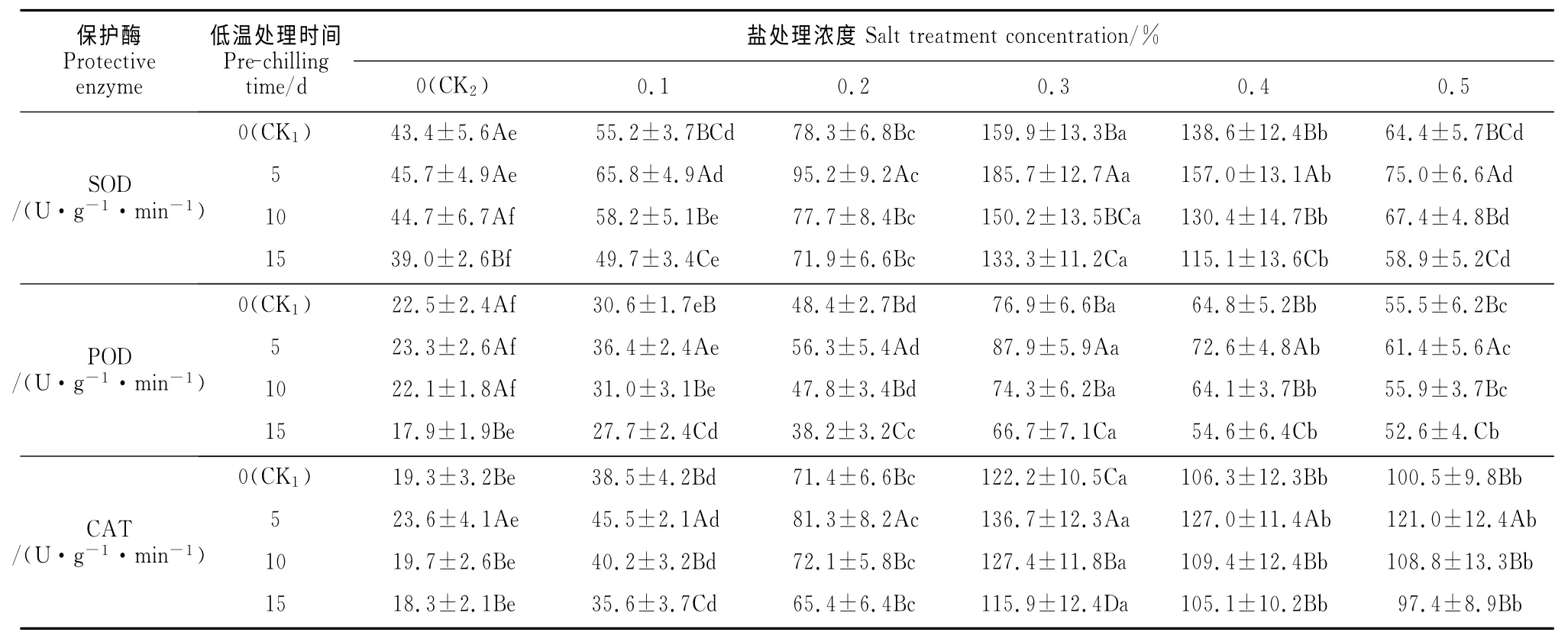
表3 低温预处理对盐胁迫下幼苗保护酶活性的影响Table3 Effect of pre-chilling treatment on SOD,POD and CAT activities under salt stress
2.3.3 CAT活性 在相同低温预处理时间内,石榴幼苗CAT 活性变化趋势与SOD、POD 相同,即随着盐浓度的升高而先升高后下降,当盐浓度0.3%时达到最大。低温处理5d石榴幼苗CAT 活性在各盐浓度处理下均显著大于其它低温处理;低温处理10d幼苗CAT 活性除在0.3%盐浓度下显著高于CK1外,在其余盐浓度下均与CK1无显著差异;低温处理15d幼苗CAT 活性在0.1%和0.3%盐浓度下显著低于对照CK1,在其它盐浓度下均与CK1差异不显著。
以上结果表明适当时间的低温处理(5d)可显著提高石榴幼苗的保护酶活性,但长时间的低温处理(15d)则降低了幼苗的保护酶活性;石榴幼苗在外界盐浓度为低于0.3%时可以通过保护酶系统调节适应盐胁迫环境,而当盐浓度高于0.3%时超出了其保护酶系统的调节范围,从而发生盐害。
2.4 低温预处理对盐胁迫下石榴幼苗可溶性蛋白和脯氨酸含量的影响
在盐胁迫下,植物体内的可溶性蛋白含量增加,可能有助于提高植物对盐胁迫适应能力的逆境蛋白合成[16]。由表4知,随着盐浓度的升高,各低温处理石榴幼苗可溶性蛋白含量逐渐增高,并在不同浓度盐处理间差异显著(P<0.05),且大多显著大于对照CK2。随预处理时间延长,各盐浓度处理石榴幼苗的可溶性蛋白含量先降后升,其在低温处理5d时比CK1不同程度降低,而在低温处理10d和15d时却不同程度地增加,但大多未达到显著水平。即长时间的低温预处理可以提高石榴幼苗可溶性蛋白的合成。
同时,随盐浓度的升高,各低温预处理石榴幼苗间脯氨酸含量逐渐升高,但盐浓度低于0.2%的各处理间差异不显著,而当盐浓度高于0.3%时显著增加,尤其在0.4%和0.5%盐浓度下剧增。随着低温预处理时间的延长,各盐浓度处理石榴幼苗表现出先降后升的趋势,且盐浓度越高这种趋势越明显;各低温处理间脯氨酸含量在低盐浓度胁迫下差异不显著,当盐浓度高于0.3%时差异达到显著水平(P<0.05)。说明盐胁迫和低温刺激促进了石榴幼苗自身脯氨酸的合成,且盐浓度越高、低温处理时间越长脯氨酸在石榴幼苗体内积累越多。
2.5 低温预处理对盐胁迫下石榴幼苗电导率的影响
植物膜系统会在盐胁迫下受到影响,对盐敏感的植物膜系统先遭到破坏[17]。由表5知,各低温处理石榴幼苗电导率随着盐胁迫浓度的升高逐渐增加,其在0.1%和0.2%盐浓度之间无显著差异外,而在其它处理间差异显著(P<0.05),尤其当盐浓度为0.5%时,其相对电导率约为对照(CK2)的3倍,说明石榴幼苗膜系统在高盐浓度下已受到严重破坏。同时,各盐处理石榴幼苗电导率随低温处理时间延长先降低后升高,并在预处理5d时达到最低值。在无盐胁迫下(CK2),低温预处理5d幼苗相对电导率均显著小于对照(CK1),而其余低温处理与CK1均无显著差异;在0.1%和0.2%盐浓度时,不同低温处理间相对电导率差异不显著;当盐浓度高于0.3%时,仅低温处理15d相对电导率显著高于其余处理,其它处理间差异不显著。可见,适当时间的低温处理能增加石榴幼苗抗盐力,但长时间的低温处理抑制幼苗在盐环境正常生长。

表4 低温预处理对盐胁迫下对幼苗可溶性蛋白和脯氨酸的影响Table4 Effect of pre-chilling treatment on soluble protein contents and proline under salt stress

表5 低温预处理对盐胁迫下对幼苗电导率的影响Table5 Effect of pre-chilling treatment on conductivity under salt stress
3 讨 论
试验结果表明,适当时间低温预处理(5d)和低盐胁迫(0.1%)可以提高石榴种子发芽率、发芽势和幼苗根冠比,有利于壮苗形成;但长时间的低温处理和高浓度盐胁迫却降低种子的发芽率、发芽势和根冠比,抑制幼苗生长。另外,低温处理5d石榴种子在0.2%盐浓度下可以正常萌发,说明低温预处理可以提高石榴种子抗盐力,0.2%盐浓度可以作为石榴种子抗盐萌发的临界点。据报道,石榴树对土壤盐浸化有较好的适应性,但含盐量超过0.3%时会导致石榴树势减弱、黄化、早衰、发生冻害严重等现象,含盐量超过0.4%时则会导致根系、枝条韧皮部和木质部以及叶片发生盐害死伤[18]。可见,本研究结果与之相似,其可能原因是石榴种子能在低盐浓度中萌发,随着幼树生长,其抗盐能力也逐渐增强,但超过一定浓度时也会对树体造成伤害。
同时,本研究发现盐胁迫下低温预处理石榴幼苗保护酶(SOD、POD、CAT)活性均呈先上升后下降的趋势,当盐浓度为0.3%时达到最大。即石榴幼苗在低盐胁迫下可通过抗氧化酶系统SOD、POD和CAT 活性增强来清除过多自由基,而高盐胁迫使体内代谢趋于紊乱,体内自由基急剧升高,这在李属(Prunus)[19]、柽柳(TamarixchinensisLour.)[20]等植物中也得到验证。同时,石榴在盐逆境萌发过程中,低温处理5d幼苗的SOD、POD 和CAT 活性均比对照有不同程度提高,说明低温处理石榴种子可以提高石榴幼苗在盐环境的适生能力,这一结论与刺槐(RobiniapseudoacaciaL.)种子经低温处理能抗盐萌发结论相同[21]。
另外,植物在失水时产生的一些渗透调节物质具有脱水保护功能[22-25],本试验结果表明随着盐浓度的升高,石榴幼苗的渗透调节物质(可溶性蛋白和脯氨酸)含量也逐渐增加。据报道,大豆(Glycine max)品种Clark和Forrest的耐盐性与叶片可溶性蛋白、脯氨酸的积累有关[26];黑麦草在低温和盐渍胁迫之间存在“交叉适应”现象,低温处理3~5d显著提高了种子萌发期的抗盐能力[27];低温诱导小麦种子可以促进种子内源激素合成,从而提高种子抗盐萌发性[28]。本试验表明长时间的低温处理可以提高石榴幼苗渗透调节物质的合成,而且随着盐浓度的升高它们在体内逐渐累积。未经盐胁迫石榴幼苗的相对电导率在低温处理间差异显著,并在低温预处理5d时显著低于常温对照,说明低温预处理石榴种子可以提高幼苗抗盐能力。
综上所述,石榴种子萌发、幼苗生长及生理生化特性与低温处理、盐胁迫关系密切,适当的低温处理及低盐环境可促进种子萌发。在低盐环境下,低温处理石榴种子幼苗能通过调整自身生长增强幼苗植株的渗透调节能力,保证植株正常生长所需水分,同时可溶性蛋白和脯氨酸含量的增加,保证幼苗自身保护酶的合成,维持正常的细胞代谢活性;另外,通过降低细胞膜脂过氧化程度,保证细胞膜的完整性等来提高其逆境适应能力,从而有效降低膜脂过氧化对植株的伤害,表现出较强的抗盐性。本研究表明,石榴种子萌发前经适度时间的低温预处理,有利于石榴种子在盐胁迫下的萌发和幼苗生长,且低温处理5d在0.1%盐浓度环境中有利于石榴壮苗形成,是生产实践中可以应用的技术措施。
[1] YIN J D(尹建道),GONG H ZH(龚洪柱).Earlier stage study of forest exploition and utilization on salinized soil in Shandong Province——analysis of soil salt composition and salt harmfulness to plants[J].JournalofNortheastForestryUniversity(东北林业大学学报),1998,26(1):29-33(in Chinese).
[2] SUN SH W(孙守文),LI H(李 宏),ZHENG CH H(郑朝晖),etal.Study on salt tolerance of six main tree species in Xinjiang and their photosynthetic characteristics under salt stress[J].JournalofSouthwestForestryUniversity(西南林业大学学报),2011,31(5):10-14(in Chinese).
[3] WANG L J(汪良驹),MA K(马 凯),JIANG W B(姜卫兵),etal.Study on contents of sodium and potassium ions of pomegranate and peach plants under sodium chloride stress and their salt tolerance[J].ActaHorticulturae(园艺学报),1995,22(4):336-340(in Chinese).
[4] LANSKY E P,NEWMAN R A.Punicagranatum(Pomegranate)and its potential for prevention and treatment of inflammation and cancer[J].JournalofEthnopharmacology,2007,109(3):177-206.
[5] AVIRAM M,VOLKOVA N,COLEMAN R,etal.Pomegranate phenolics from the peels,arils,and flowers are antiatherogenic:studiesin vivoin atherosclerotic apolipoprotein e-deficient(E 0)mice andinvitroin cultured macrophages and lipoproteins[J].JournalofAgricultureandFoodChemistry,2008,56(4):1 148-1 157.
[6] MEHTA R,LANSKY E P.Breast cancer chemorpreventive properties of pomegranate fruit extracts in a mouse mammary organ culture[J].Eur.J.CancerPrev.,2004,13(4):345-348.
[7] LANSKY E P,HARRISON G,FROOM P.Pomegranate pure chemicals show possible synergistic inhibition of human PC-3prostate cancer invasion across Matrigel[J].InvestNewDrugs,2005,23(2):121-122.
[8] IRWIN A U.Halophyte seed germination[J].TheBotanicalReview,1978,44:233-264.
[9] CHAUDHURI I I,WLEBE H H.Influence of calcium pretreatment on wheat germination on salt media[J].PlantandSoil,1968,28:208-216.
[10] ZAI X M(宰学明),WU G R(吴国荣),LU CH M(陆长梅),etal.The effects of pre-chilling on vigour index and active oxygen metabolism of soybean seeds[J].SoybeanScience(大豆科学),2001,20(3):163-166(in Chinese).
[11] 国际种子检验协会(ISTA).国际种子检验规程[M].北京:北京农业大学出版社,1985:54-57.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:195-197.
[13] 张治安.植物生理实验指导[M].北京:中国农业科学出版社,2004:18-20.
[14] 赵世杰,李德全.现代植物生理学实验指南[M].北京:科技出版社,1999:305-306.
[15] 黄少伟,谢维辉.使用SAS编程与林业实验数据分析[M].广州:华南理工大学出版社,2001:46-53.
[16] WU L Y(吴丽云),CAO B H(曹帮华).Germination characteristics ofFraxinusvelutinaandMEliaazedarachseeds in saline land[J].ChineseBulletinofBotany(植物学通报).2005,22(6):668-672(in Chinese).
[17] GUAN SH Y(关世英),SU W A(苏维埃).Approach of mechanism of plant chilling resistance related with phosphatidyl-glycerol[J].PlantPhysiologyCommunications(植物生理学通讯),1995,31(3):167-173(in Chinese).
[18] 曹尚银,侯乐峰.中国果树志——石榴卷[M].北京:中国林业出版社,2013:80-85.
[19] HU X L(胡晓立),LI Y H(李彦慧),CHEN D L(陈东亮).Physiological responses of three colored-leaf species ofPrunusunder NaCl stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(2):370-376(in Chinese).
[20] ZHU J F(朱金方),XIA J B(夏江宝),LU ZH H(陆兆华).Growth,physiological and biochemical characteristics ofTamarixchinensisseedlings under salt-drought intercross stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(1):124-130(in Chinese).
[21] CAO B H(曹帮华),ZHAI M P(翟明普),WU L Y(吴丽云).Effects of pre-chilling on germination ofRobiniapseudoacaciaunder salt stress[J].JournalofBeijingForestryUniversity(北京林业大学学报),2005,27(4):39-42(in Chinese).
[22] HUSAINI A M,ABDIN M Z.Development of transgenic strawberry(FragariaxananassaDuch.)plants tolerant to salt stress[J].Plant Sci.,2008,174:446-455.
[23] LI H Y(李洪燕),ZHENG Q S(郑青松),LIU ZH P(刘兆普).Effects of various concentration of seawater on the growth and physiological characteristics ofLactucaindicaseedlings[J].ChineseBulletinofBotany(植物学报),2010,45(1):73-78(in Chinese).
[24] LIU B X(刘炳响),WANG ZH G(王志刚),LIANG H Y(梁海永),etal.Effects of salt stress on physiological characters and salt-tolerance ofUlmuspumilain different habitats[J].ChineseJournalofAppliedEcology(应用生态学报),2012,23(6):1 481-1 489(in Chinese).
[25] WANG C(王 聪),ZHU Y L(朱月林),YNAG L F(杨立飞),etal.Effects of NaCl stress on polyamines metabolism in vegetable soybean[J].ChineseJournalofAppliedEcology(应用生态学报),2011,22(11):2 883-2 893(in Chinese).
[26] ELSAMAD H M,SHADDAD A K.Salt tolerance of soybean cultivars[J].BiologiaPlantarum,1997,39(2):263-269.
[27] SONG X F(宋晓芳),CAO SH H(曹社会),CHEN X L(陈秀丽).Cross-adptation of perennial ryegrass in germination stage to pre-chilling and salt stress[J].JournalofNorthwestA&FUniversity(Nat.Sci.Edi.)(西北农林科技大学学报·自然科学版),2013,41(11):185-190(in Chinese).
[28] IQBAL M,ASHRAF M.Changes in hormonal balance:apossible mechanism of pre-sowing chilling-induced salt tolerance in spring wheat[J].JournalofAgronomyandCropScience,2010,196(6):440-454.
