根际低氧胁迫对网纹甜瓜幼苗植株碳水化合物含量的影响
2015-07-04孙艳军郭世荣
孙艳军,郭世荣,徐 刚
(1 南京农业大学 园艺学院,农业部南方蔬菜遗传改良重点开放实验室,南京210095;2 江苏省农业科学院蔬菜研究所,南京210014)
O2是植物正常生长发育必不可少的条件,植株正常的生理代谢需要适当浓度的氧。洪涝灾害、灌水过多或无土栽培管理不当时常常造成作物根际氧气缺乏,低氧逆境已成为作物生产的主要限制因子之一,因此研究低氧逆境胁迫对作物发育和生理代谢的影响具有重要的意义。低氧胁迫下,植物的光合作用及光合产物的转运都受到抑制,植物体内碳水化合物的含量会发生改变。一般来说,植物地上部通过碳水化合物的供应来控制地下部的养分吸收和生长,反之,地下部则通过无机养分与水分的供应来控制地上部的生长发育。近年来研究表明,碳水化合物对植物在胁迫环境下的存活具有重要意义。碳水化合物是植物光合作用的主要产物,按其存在形式可以分为结构性碳水化合物(structural carbohydrates)和 非 结 构 性 碳 水 化 合 物(non-structural carbohydrates,NSC)。前者(如木质素、纤维素)主要用于植物体形态建成,而后者(如葡萄糖、果糖、蔗糖、果聚糖和淀粉)则是参与生命代谢的重要物质[1]。碳水化合物的代谢除受植物本身遗传特性影响外,许多环境因子、养分因素也都影响植物体内非结构性碳水化合物的变化[2]。
网纹甜瓜(CucumismeloL.var.raticulalus)已列入世界十大主要水果,也成为世界无土栽培的主栽作物之一,但无土栽培的网纹甜瓜存在根系耗氧快、对根际低氧逆境敏感等问题,严重制约网纹甜瓜无土栽培的大面积生产[3]。为了逐步揭示网纹甜瓜植株低氧伤害和耐性机理,本试验以耐低氧性具有显著差异的2个网纹甜瓜品种为材料,在精确控制营养液溶氧浓度的条件下,研究低氧胁迫下植株体内碳水化合物含量的变化,明确植株体内碳水化合物含量与低氧耐性之间的关系。
1 材料和方法
1.1 材料培养与处理
以低氧耐性较强的网纹甜瓜品种‘东方星光’(Dongfang xingguang,东方正大公司提供,引自泰国)和耐性较弱的品种‘西域一号’(Xiyu No.1,新疆西域种子公司提供)为材料。种子消毒后催芽,发芽的种子播于装有石英砂的育苗盘育苗,温室昼温27~30 ℃,夜温16~18 ℃,待第一片真叶完全展开后开始浇灌1/2 倍Hoagland 营养液[pH (6.3±0.1),EC 值1.2~1.3 mS/cm]。待幼苗达三叶一心时,选整齐一致的幼苗(每品种30株)定植于装有100L1倍Hoagland营养液[pH (6.3±0.1),EC值1.9~2.0 mS/cm]的栽培槽中,气泵正常通气(DO 维持在8.0~8.5mg·L-1),预培养2d后,将‘东方星光’和‘西域一号’植株各分成两部分进行正常通气水培(对照,CK)和低氧水培处理,采用溶氧浓度调节器(美国Quantum,Q25D 型)调节营养液的溶氧浓度,设定值为2.0 mg·L-1(误差小于±0.20mg·L-1)。每处理重复3次。
1.2 测定指标及方法
参考於新建等[4]的方法,将新鲜植株分为根、叶及茎后在110 ℃烘箱内鼓风固定15min,然后调温至70 ℃烘至恒重。磨碎过筛后称取50mg,样品倒入15mL刻度试管,加入10mL 80%的酒精,置于80 ℃水浴振荡保温30min,冷却后,于4 000×g离心3min,收集上清液,其残渣加80%的酒精重复提取两次,合并上清液。在上清液中加入10mg活性碳,80 ℃脱色30min,定容至25mL,过滤后取滤液进行相关指标测定。
1.2.1 可溶性总糖含量 取2mL 提取液,加入5 mL蒽酮试剂,在90 ℃下保温10min,取出后迅速冷却,显色10 min 后在620nm 处测定吸光度值(OD620)。
1.2.2 蔗糖含量 取2mL 提取液,加入50μL 2 mol·L-1NaOH,90 ℃保温5min,迅速冷却,加入5mL蒽酮试剂,80 ℃水浴反应10min,取出后迅速冷却,显色10min测定OD620。
1.2.3 果糖含量 取2mL 提取液,加入5mL 蒽酮试剂,在40 ℃下保温10 min,取出后迅速冷却,显色10min后测定OD620。
1.2.4 葡萄糖含量 取2mL 酶制剂30 ℃水浴,待酶液温度上升后加入1 mL 提取液,摇匀,5 min后加入4mL 10mol·L-1H2SO4,测定OD525。
1.2.5 淀粉含量 将提取可溶性糖以后的残渣加入10mL 52%高氯酸,于4 000r/min离心3min,收集上清液,在上清液中加入10mg活性碳,80 ℃脱色30min,定容至25mL,过滤后取滤液测定淀粉含量。取滤液2 mL,加入5 mL 蒽酮试剂,立即摇匀,在80 ℃水浴反应10min,冷却,在暗处显色10 min后测定OD620。
2 结果与分析
2.1 低氧胁迫下植株体内淀粉含量的变化特征
图1显示,低氧胁迫处理前,‘东方星光’的根淀粉含量略高于‘西域一号’,且达到显著差异水平。在低氧胁迫条件下,‘东方星光’和‘西域一号’2个网纹甜瓜品种幼苗根系淀粉含量在处理4d后分别较通气对照(CK)显著降低13.18%和17.05%;在处理6、8d时,‘东方星光’根系淀粉含量较通气对照仍分别显著降低23.18%、15.51%,‘西域一号’根系淀粉含量与通气对照无显著差异。同时,2 个品种幼苗茎部淀粉含量在低氧胁迫期间均呈现先增加后下降的变化趋势,‘东方星光’在处理2 和4d较对照分别显著提高12.08%、20.50%,而在处理的6~8d与对照无显著差异;‘西域一号’在处理2~6 d 分 别 显 著 高 于 对 照19.94%、18.34%、11.75%,而在处理8d与对照无显著差异。另外,‘东方星光’幼苗叶片淀粉含量在低氧胁迫下呈现先增加后降低的变化趋势,且在整个处理期间均显著高于对照,增幅为15.66%~69.41%;而‘西域一号’幼苗叶片淀粉含量在处理的2~4d与对照相比差异不显著,在处理的6和8d较对照分别显著增加8.64%和12.91%。以上结果表明低氧胁迫下网纹甜瓜根系淀粉含量下降,而茎部和叶片中有淀粉积累的现象,且在耐低氧性强的‘东方星光’叶片中淀粉积累更明显。
2.2 低氧胁迫下植株体内可溶性糖含量变化特征
低氧胁迫下‘东方星光’和‘西域一号’2个品种根系、茎部和叶片的可溶性糖含量均呈现先增加后降低的变化趋势,且与同期对照相比均显著增加(图2)。其中,2个品种根系的可溶性糖含量在低氧胁迫下变化趋势相同,且2个品种根系可溶性糖含量间也没有显著差异。‘东方星光’茎部可溶性糖含量在低氧胁迫处理4~8d间较对照分别增加272.19%、264.41%、374.89%,叶 片 分 别 增 加177.56%、144.67%、59.76%;‘西域一号’茎部可溶性糖含量同期较对照分别增加226.29%、204.25%、257.11%,叶片分别增加97.00%、92.32%、37.40%。以上结果表明网纹甜瓜根系、茎部和叶片中可溶性糖低氧胁迫下均显著积累,且在茎部和叶片中积累更显著;2个品种比较,耐低氧性较强的‘东方星光’茎部、叶片中可溶性糖含量显著高于耐低氧性较弱的‘西域一号’。
2.3 低氧胁迫下植株体内蔗糖含量的变化特征

图1 低氧胁迫下网纹甜瓜幼苗淀粉含量的变化Fig.1 The starch content of muskmelon seedlings under hypoxia stress
由图3可以看出,2个网纹甜瓜品种根系的蔗糖含量在低氧胁迫下均呈现先增加后降低的趋势,并均在处理4d时达到最大值。‘东方星光’根系的蔗糖含量在胁迫处理4d 时较对照显著增加22.46%,而在处理的6~8d又下降,且与对照相比无显著差异;‘西域一号’的根系蔗糖含量在胁迫处理4d时较对照显著增加20.58%,在处理6d又下降,但仍显著高于同期的对照。‘东方星光’茎部的蔗糖含量在低氧胁迫2d时下降,而在处理的4~8d时迅速大幅增加,在处理4、6、8d 时较对照分别增加57.34%、208.65%、258.21%;‘西域一号’茎部的蔗糖含量在胁迫处理2d时高于对照,在处理的4~8 d时迅速增加,在处理4、6、8d时较对照分别增加42.30%、62.92%、84.66%。另外,2个品种叶片的蔗糖含量在低氧胁迫处理期间均呈现先增加后降低的变化趋势,且均高于同期的对照,并均在处理6d时达到最大值且增幅最大,此时‘东方星光’和‘西域一号’叶片蔗糖含量分别较相应对照显著增加189.40%和66.65%。可见,低氧胁迫下网纹甜瓜2个品种茎部和叶片中蔗糖含量均显著增加,且‘东方星光’增幅高于‘西域一号’;同时,耐低氧性较强的‘东方星光’茎部和叶片中的蔗糖含量在低氧胁迫下也明显高于耐低氧性较弱的‘西域一号’。

图2 低氧胁迫下网纹甜瓜幼苗可溶性糖含量的变化Fig.2 The soluble sugar content of muskmelon seedlings under hypoxia stress
2.4 低氧胁迫下植株体内果糖含量的变化特征
在低氧胁迫条件下,‘东方星光’的根系果糖含量呈现先增加后降低的趋势,并在处理4d时达最高值,此时较对照显著增加150.37%;‘西域一号’根系果糖的含量先增加到较高水平,在处理2~6d维持一段时间后又降低,其在处理2和4d时分别较对照增加95.00%和118.06%(图4)。同时,低氧胁迫下‘东方星光’茎部果糖含量呈现先增加后降低再增加的趋势,并在处理4d时达最大值,其在处理4、6和8d时分别为对照的7.17倍、4.20倍和6.44倍;同期‘西域一号’茎部果糖含量呈现先增加后降低的趋势,也在处理4d时达到最大值,此时为对照的5.16倍。另外,低氧胁迫下‘东方星光’和‘西域一号’叶片果糖含量均呈现先增加后降低的变化趋势,它们分别在处理6和4d时达到最大值;‘东方星光’叶片果糖含量在处理2、4、6和8d时分别为对照的1.64倍、3.42倍、2.87倍和1.65倍,而‘西域一号’则分别为对照的1.69倍、3.06倍、2.64倍和1.48倍。以上结果表明低氧胁迫下2个网纹甜瓜品种根系、茎部和叶片中果糖均大量积累,且耐低氧性较强的‘东方星光’的茎部和叶片中果糖含量高于耐低氧性较弱的‘西域一号’。

图3 低氧胁迫下网纹甜瓜幼苗蔗糖含量的变化Fig.3 The sucrose content of muskmelon seedling under hypoxia stress

图4 低氧胁迫对网纹甜瓜幼苗果糖含量的变化Fig.4 The fructose content of muskmelon seedlings under hypoxia stress
2.5 低氧胁迫下植株体内葡萄糖含量的变化特征
图5显示,低氧胁迫下2个甜瓜品种的根系葡萄糖含量均呈现逐渐下降的趋势,‘东方星光’根系葡萄糖含量在处理2、6d时较对照分别显著降低17.81%和23.16%。低氧胁迫下2 个品种的茎部和叶片中葡萄糖含量均呈现先增加后下降的变化趋势,并均在处理2d时最高,此时‘东方星光’茎、叶片葡萄糖含量分别较对照显著增加19.43%和22.87%,‘西域一号’则较对照分别显著增加32.40%和30.51%;随着处理时间的延长两个品种的茎部和叶片中葡萄糖含量又逐渐下降,在处理8d时‘东方星光’茎、叶片葡萄糖含量分别显著低于对照18.93%和31.82%,同期‘西域一号’茎部葡萄糖含量显著低于对照19.34%。以上结果说明低氧胁迫后期植株体内葡萄糖含量均显著降低,并以耐低氧性强的‘东方星光’叶片的葡萄糖含量降低更明显,且显著低于同期耐低氧性弱的‘西域一号’。
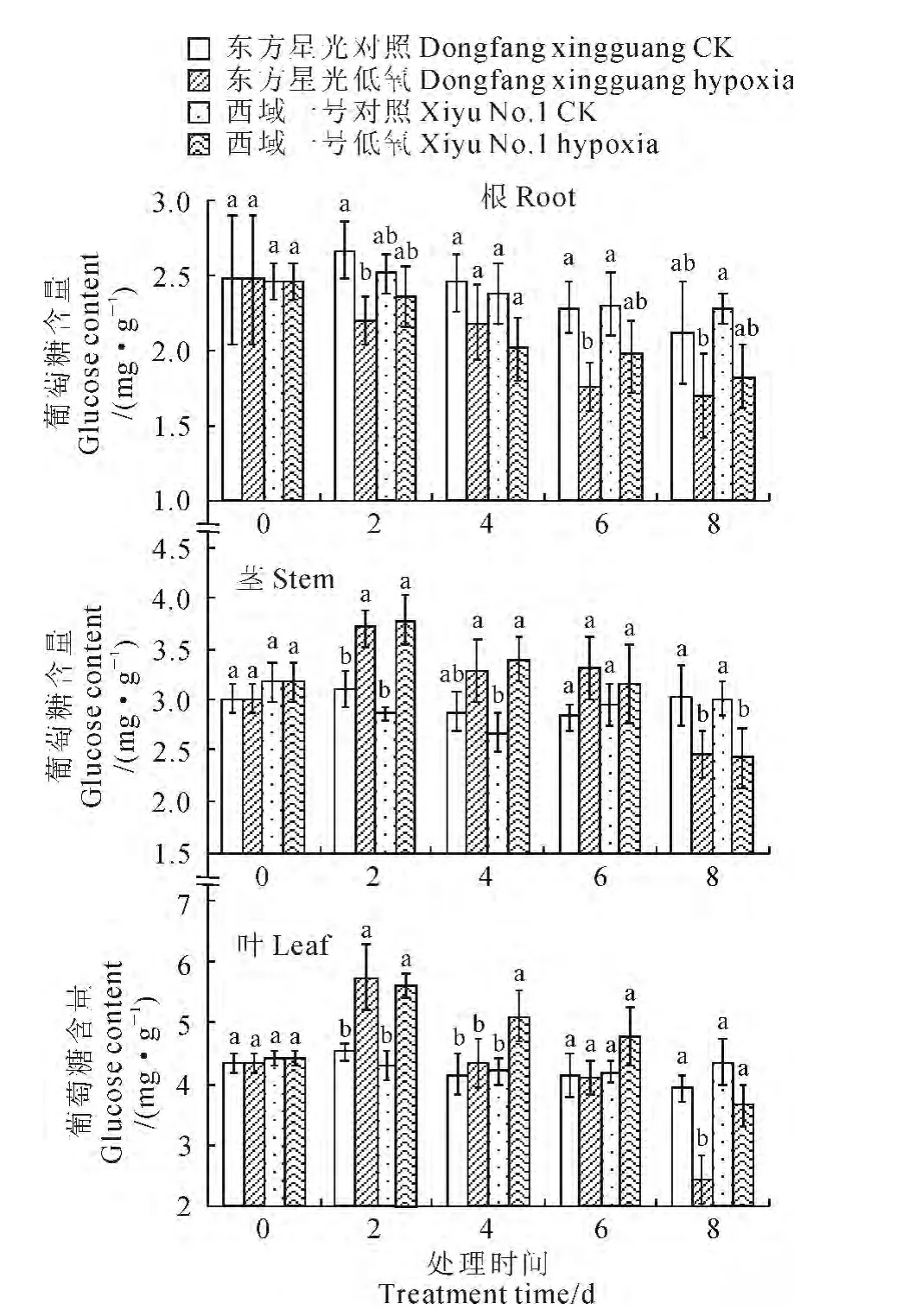
图5 低氧胁迫下网纹甜瓜幼苗葡萄糖含量的变化Fig.5 The glucose content of muskmelon seedlings under hypoxia stress
3 讨 论
碳水化合物是植物光合作用的主要产物,其中葡萄糖、果糖、蔗糖、淀粉等是参与植株生命代谢的重要物质。淀粉是植物体内主要的碳水化合物贮存形式之一,蔗糖是高等植物光合作用的主要产物,也是碳水化合物运输的主要形式,它可以运输到植物生长发育的各个器官[5]。已有研究表明在低氧胁迫下植株根系淀粉含量会降低而叶片淀粉含量却升高[6-7]。本试验发现低氧胁迫下‘东方星光’和‘西域一号’2个网纹甜瓜品种的根系淀粉含量均有下降,这与胡晓辉等[8]在黄瓜(Cucumissativus)上和张恩让等[9]在辣椒(CapsicumannuumL.)上的研究结果一致,这可能是因为低氧胁迫下光合作用效率降低[10]及光合产物运输受限[11],根系需要消耗自身的淀粉来满足无氧呼吸的需求[12],所以根系中的淀粉减少。同时,低氧胁迫下‘东方星光’和‘西域一号’2个品种茎部的淀粉含量先增加后降低,这和张恩让等[9]的研究结果相似,在胁迫2d时茎部的淀粉含量升高,这可能与低氧胁迫下韧皮部运输受阻[13]以及淀粉水解速度降低导致转移受阻有关,在处理后期淀粉含量降低,可能与光合作用效率降低、光合产物减少有关。
另外,低氧胁迫下‘东方星光’叶片中淀粉含量有明显积累,而‘西域一号’叶片中淀粉含量没有明显积累。低氧胁迫下叶片淀粉含量的增加,这和胡晓辉[14]、张恩让等[9]的研究结果相似,可能是由于低氧胁迫下光合产物的转运机制受抑制碳水化合物由叶片运输到根系的速度降低[15];耐低氧性较强的‘东方星光’叶片中淀粉含量增加较多,这可能与其在低氧胁迫下仍能保持相对较高的光合作用效率有关[16]。
碳水化合物是植物体内主要的能量贮存物质,大量研究报道了碳水化合物在许多植物耐低氧能力中的作用[17-19],植物体内不同类型的糖类在抵抗低氧胁迫上起重要作用[20]。低氧胁迫下,植物体内的糖类含量增加,耐低氧能力增强[21-23]。可溶性糖、蔗糖和果糖含量的增加可以提高植物组织低氧下的生存能力[6,24],可溶性糖和蔗糖含量的增加也有利于氧缺乏时植物进行糖酵解和乙醇发酵[20]。本试验中,‘东方星光’和‘西域一号’根系、茎部和叶片的可溶性糖、蔗糖和果糖含量在低氧胁迫下都较对照增加,且在茎部和叶片中增加更明显,这与前人的研究结果是一致的[25-27]。低氧胁迫下,耐低氧性强的‘东方星光’的茎部和叶片的可溶性糖、蔗糖、果糖含量比耐低氧性弱的‘西域一号’茎部和叶片中含量更高。低氧胁迫下可溶性糖、果糖含量增加可以为植物的呼吸作用提供充足的底物,以满足无氧呼吸对底物的需求,还能调节体内的代谢,因而能在一定程度上减轻低氧胁迫的危害,这可能是植物在低氧逆境下的一种适应机制。同时,低氧胁迫下,本试验中‘东方星光’和‘西域一号’根系葡萄糖含量降低,而茎部和叶片中葡萄糖含量先增加后降低,并在处理8d时低于对照,这与Wample等[28]在向日葵及张恩让等[9]在辣椒等植物上的研究结果相似。低氧胁迫下网纹甜瓜植株体内葡萄糖含量的降低可能是由于无氧呼吸的加强而过分消耗所致。
综上所述,在低氧胁迫条件下,网纹甜瓜根系淀粉含量下降,而茎部和叶片中有淀粉积累,且在耐低氧性强的‘东方星光’叶片中淀粉积累更明显;同时,网纹甜瓜根系葡萄糖含量下降,而茎部和叶片中葡萄糖含量先增加后降低,并在处理8d后低于对照;另外,网纹甜瓜根、茎、叶中可溶性糖、蔗糖、果糖含量均增加,且在耐低氧性强的‘东方星光’中增加更明显。从而表明网纹甜瓜体内碳水化合物含量与植株的耐低氧性密切相关,耐低氧性强的品种体内可溶性糖、蔗糖、果糖含量在低氧胁迫下比耐低氧性弱的品种含量高,较高的可溶性糖、蔗糖和果糖含量是对低氧胁迫的一种适应性反应。
[1] SHI M F(施美芬),ZENG B(曾 波),SHEN J H(申建红),etal.A review of the correlation of flooding adaptability and carbohydrates in plants[J].ChineseJournalofPlantEcology(植物生态学报),2010,34(7):855-866(in Chinese).
[2] SHI J W(史建伟),ZHANG Y P(张育平),WANG M B(王孟本),etal.Non-structural carbohydrates change in plants and its influencing factors[J].HubeiAgriculturalSciences(湖北农业科学),2008,47(1):112-115(in Chinese).
[3] 郭世荣.无土栽培学(第2版)[M].北京:中国农业出版社,2011:271-277.
[4] 於新建,张振清.植物材料中可溶性糖的测定[M]//汤章城.现代植物生理学实验指南.北京:科学出版社,1999:127-128.
[5] LERNER H R.Plant responses to environmental stresses,from phytohormones to genome reorganization[M].New York:MarcelDekker,1999:373-393.
[6] BOUNY J M,SAGLIO P H.Glycolytic flux and hexokinase activities in anoxic maize root tips acclimated by hypoxic pretreatment[J].PlantPhysiology,1996,111(1):187-194.
[7] CHEN H J,QUALLS R G,BLANK R R.Effect of soil flooding on photosynthesis,carbohydrate partitioning and nutrient uptake in the invasive exoticLepidiumlatifolium[J].AquaticBotany,2005,82(4):250-268.
[8] HU X H(胡晓辉),GUO SH R(郭世荣),LI J(李 璟),etal.Effects of Ca2+on carbohydrate metabolism in roots of cucumber seedlings under hypoxia stress[J].JournalofShenyangAgriculturalUniversity(沈阳农业大学学报),2006,37(3):322-326(in Chinese).
[9] ZHANG E R(张恩让),REN Y Y(任媛媛),LI X H(李晓慧).Effect of Ca2+on growth and carbohydrate contents of pepper seedlings under root-zone flood stress[J].ChineseAgriculturalScienceBulletin(中国农学通报),2012,28(22):151-157(in Chinese).
[10] 高洪波.根际低氧胁迫下网纹甜瓜幼苗生理代谢的特征及Ca2+、GABA 生理调节功能[D].南京:南京农业大学,2005:48-49.
[11] SIJ J W,SWANSON C A.Effect of petiole anoxia on phloem transport in squash[J].PlantPhysiology,1973,51(2):368-371.
[12] PERATA P,LORETI E,GUGLIELMINETTI L,etal.Carbohydrate metabolism and anoxia tolerance in cereal grains[J].ActaBotanica Neerlandica,1998,47:269-283.
[13] DONGEN J T,SCHURR U,PFISTER M,etal.Phloem metabolism and function have to cope with low internal oxygen1[J].Plant Physiology,2003,131(4):1 529-1 543.
[14] 胡晓辉.钙对低氧胁迫下黄瓜幼苗碳、氮代谢的影响[D]南京:南京农业大学,2006:73-74.
[15] SAGLIO P H,RAYMOND P,PRADET A.Oxygen transport and root respiration of maize seedlings.A quantitative approach using the correlation between ATP/ADP and the respiration rate controlled by oxygen tensionZeamays[J].PlantPhysiol.,1983,72(4):1 035-1 039.
[16] GAO H B(高洪波),GUO SH R(郭世荣),ZHANG T J(章铁 军),etal.Effect of nutrient solution hypoxia stress on the growth and physiological metabolism of muskmelon seedlings[J].JournalofShenyangAgriculturalUniversity(沈阳农业大学学报),2006,37(3):368-372(in Chinese).
[17] KATO-NOGUCHI H.Sugar utilization and anoxia tolerance in rice roots acclimated by hypoxic preatment[J].JournalofPlantPhysiology,2004,161(7):803-808.
[18] ZHANG Y H(张艳红),ZENG B(曾 波),FU T F(付天飞),etal.Effects of long-term flooding on non-structural carbohydrates content in roots ofSalixvariegateFranch[J].JournalofSouthwestChinaNormalUniversity(西南师范大学学报),2006,31(3):153-156(in Chinese).
[20] BERTRAND A,CASTONGUAY Y,NADEAU P,etal.Oxygen deficiency affects carbohydrate reserves in overwintering forage crops[J].JournalofExperimentalBotany,2003,54(388):1 721-1 730.
[21] MUSTROPH A,ALBRECHT G.Tolerance of crop plants to oxygen deficiency stress:fermentative activity and photosynthetic capacity of entire seedlings under hypoxia and anoxia[J].PhysiologiaPlantarum,2003,117(4):508-520.
[22] GEIGENBERGER P.Response of plant metabolism to too little oxygen[J].CurrentOpinioninPlantBiology,2003,6(3):247-256.
[23] ALBRECHT G,MUSTROPH A,FIX T C.Sugar and fructan accumulation during metabolic adjustment between respiration and fermentation under low oxygen conditions in wheat roots[J].PhysiologiaPlantarum,2004,120(1):93-105.
[24] RICARD B,TOAI T V,CHOUREY P.Evidence for critical role of sucrose synthase for anoxic tolerance of maize roots using a double mutant[J].PlantPhysiol.,1998,116(4):1 323-1 331.
[25] KANG Y Y,GUO SH R,LI J,etal.Effect of root applied 24-epibrassinolide on carbohydrate status and fermentative enzyme activities in cucumber(CucumissativusL.)seedlings under hypoxia[J].PlantGrowthRegul.,2009,57(3):259-269.
[26] IMÉNE G,BÉRÉNICE R,SAMIRA S,É.Increased hexose transport in the roots of tomato plants submitted to prolonged hypoxia[J].Planta,2009,230(2):441-448.
[27] KANG Y Y(康云艳),YANG X(杨 暹),GUO SH R(郭世荣),etal.Effects of 24-epibrassinolide on carbohydrate metabolism and enhancement of tolerance to root-zone hypoxia in cucumber(CucumissativusL.)[J].ScientiaAgriculturaSinica(中国农业科学),2011,44(12):2 495-2 503(in Chinese).
[28] WAMPLE R L,DAVIS R W.Effect of flooding on starch accumulation in chloroplasts of sunflower(HelianthusannuusL.)[J].Plant Physiology,1983,73(1):195-198.
