细胞红蛋白在低氧预适应小鼠大脑组织中的表达及其临床意义
2015-06-23黄丽华贾平平
黄丽华,邵 国,贾平平,张 冬
·论著·
细胞红蛋白在低氧预适应小鼠大脑组织中的表达及其临床意义
黄丽华,邵 国,贾平平,张 冬
目的 探讨细胞红蛋白(CYGB)在低氧预适应小鼠大脑组织中的表达及其临床意义。方法 2014年11月8—12日,选取昆明种雄性成年小鼠60只,随机分为空白对照组、实验对照组和低氧预适应组,每组20只。空白对照组小鼠常氧条件下正常饲养,实验对照组小鼠进行1次低氧预适应模型制备过程,低氧预适应组小鼠完成4次低氧预适应模型制备过程。采用免疫蛋白印迹试验检测各组小鼠CYGB蛋白表达情况,实时定量PCR检测各组小鼠CYGB mRNA表达情况。结果 低氧预适应组小鼠CYGB蛋白相对表达量高于空白对照组和实验对照组,实验对照组小鼠CYGB蛋白相对表达量高于空白对照组(P<0.01)。低氧预适应组、实验对照组小鼠CYGB mRNA表达量高于空白对照组(P<0.01),而实验对照组与低氧预适应组小鼠CYGB mRNA相对表达量比较,差异无统计学意义(P>0.05)。结论 低氧预适应是一种内源性保护机制,CYGB可能参与低氧预适应过程。
低氧预适应;海马;细胞红蛋白;小鼠
近年研究发现,低氧预适应是机体耐受低氧或缺血损伤的内源性保护机制,其定义为:预先给予机体一个亚致死性低氧/缺血刺激可增强机体对随后发生的致死性低氧/缺血的耐受性,低氧预适应已被证实为细胞内源性防护机制的启动因子[1]。低氧预适应的作用机制一直是国内外研究的热点,Shao等[2]研究认为,急性重复低氧预适应的细胞组织分子作用机制可能是抑制脑组织损伤基因上调,促进脑组织损伤基因下调。细胞红蛋白(CYGB)是近年研究发现的第4种携氧球蛋白[3],广泛分布于脑神经元胞质和胞核[4-5],在机体缺氧应激过程中具有重要的组织细胞保护作用[6-7]。脑组织中海马区对低氧/缺血较敏感,本研究通过制备急性重复低氧预适应小鼠模型,探讨CYGB在低氧预适应小鼠大脑组织中的表达及其临床意义。
1 材料与方法
1.1 实验动物与试剂 昆明种雄性成年小鼠60只,体质量18~22 g,周龄6~8周,由内蒙古大学动物实验中心提供。主要试剂:Tris碱购自SIGMA公司,丙烯酰胺购自SIGMA公司,DEMD购自SIGMA公司;BCA蛋白试剂盒购自PIERCE公司,ECL试剂盒购自PIERCE公司;β-actin兔多克隆抗体购自Santa Cruze公司,Cytoglobin兔多克隆抗体购自Santa Cruze公司,辣根酶标记的山羊抗兔IgG购自北京中杉金桥生物技术有限公司,Kodak X-Omat BT Film购自Kodak公司;TRIzol(GIBCO BRL)、溴化乙啶(EB)、三氯甲烷购自重庆化学试剂厂,异丙醇和乙醇购自博奥公司。
1.2 动物模型制备 2014年11月8—12日,将所有小鼠随机分为空白对照组、实验对照组和低氧预适应组,每组20只,空白对照组小鼠常氧条件下正常饲养;实验对照组和低氧预适应组小鼠参照吕国蔚教授[8-9]模型制备方法制备急性重复低氧预适应模型:先将小鼠置于经过标定的125 ml广口瓶内,使用橡皮塞密闭瓶口,并进行观察,当小鼠出现大口喘式呼吸、翻转反射消失、大小便失禁、烦躁不安和不停跳跃等低氧表现时立即拔除橡皮塞,将小鼠取出,小鼠第1次低氧完成(实验对照组);第1次低氧完成后,立即将小鼠转移至另一相同容积且含有新鲜空气的广口瓶内,迅速使用橡皮塞密闭并再次进行观察,小鼠出现上述低氧症状时取出,上述步骤重复4次(低氧预适应组)。模型制备完成后对所有小鼠进行断头处死,迅速小心剥离海马组织,置于-80 ℃冰箱保存。
1.3 免疫蛋白印迹试验 取各组小鼠海马组织匀浆液,采用BCA 法进行总蛋白定量并配置样品缓冲液,每组小鼠取缓冲液60 μg上样,配置成10% SDS-聚丙烯酰胺凝胶,电泳约2 h;电泳完成后将胶上的总蛋白通过转膜器转到硝酸纤维膜上,5%脱脂奶粉封固1 h后采用Cytoglobin兔多克隆抗体稀释液进行稀释,稀释比例为1∶8 000,孵育4 h,4 ℃冰箱过夜;采用TTBS洗膜3次,辣根过氧化物酶标记二抗,1∶5 000稀释,孵育硝酸纤维膜,TTBS洗膜3次,将ECL化学发光试剂按比例加在硝酸纤维膜上,暗房X线胶片上曝光、显影、定影。以β-actin为内参照,采用凝胶成像分析系统扫描胶片,以目的蛋白条带面积/β-actin面积为CYGB蛋白相对表达量。
1.4 实时定量PCR 采用Triziol提取各组小鼠海马组织总RNA,按照反转录试剂盒说明书将总mRNA反转录为cDNA,总量为20 μl,置于-20 ℃冰箱保存;在含ABI的96孔板中依次在每孔中加入cDNA 1 μl,上、下游引物各12.5 μl,无菌水等;之后将96孔板置于7900实时定量PCR反应仪上,每个样本设6个复孔;实时定量PCR反应条件:95 ℃变性2 min,94 ℃,30 s;56 ℃,35 s,72 ℃,30 s,共40个循环;72 ℃延伸7 min后停止反应。实时定量PCR反应引物序列:CYGB上游引物:3′-CCATCCTGGTGAGGTTCTTT-5′,下游引物3′-CTTCCTTGTAGGCTGCGGT-5′;β-actin 上游引物:3′-GAACGGTGAAGGCGACAG-5′,下游引物:3′-TTGGGAGGGTGAGGGACT-5′。以β-actin 为内参,CYGB mRNA相对表达量以2-△△CT表示,△CT=CT目的基因-内参基因。

2 结果
2.1 CYGB蛋白表达情况 空白对照组小鼠CYGB蛋白相对表达量为(0.358±0.047),实验对照组为(0.469±0.083),低氧预适应组为(0.732±0.065),3组小鼠CYGB蛋白相对表达量比较,差异有统计学意义(F=166.150,P=0.000);低氧预适应组小鼠CYGB蛋白相对表达量高于空白对照组和实验对照组,差异有统计学意义(q值分别为25.098、17.649,P<0.01),实验对照组小鼠CYGB蛋白相对表达量高于空白对照组,差异有统计学意义(q=7.449,P<0.01,见图1~2)。

图1 3组小鼠CYGB电泳图
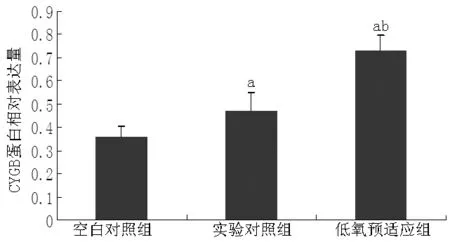
注:与空白对照组比较,aP<0.01;与实验对照组比较,bP<0.01
图2 3组小鼠CYGB蛋白相对表达量比较
Figure 2 Comparison of CYGB protein expression among the three groups
2.2 CYGB mRNA表达情况 空白对照组小鼠CYGB mRNA相对表达量为(23.00±4.90),实验对照组为(33.85±6.40),低氧预适应组为(38.60±10.24),各组小鼠CYGB mRNA相对表达量比较,差异有统计学意义(F=22.590,P=0.000)。低氧预适应组、实验对照组小鼠CYGB mRNA表达量高于空白对照组,差异有统计学意义(q值分别为9.273、6.449,P<0.01),而实验对照组与低氧预适应组小鼠CYGB mRNA相对表达量比较,差异无统计学意义(q=2.823,P>0.05,见图3)。

注:与空白对照组比较,aP<0.05
图3 3组小鼠CYGB mRNA相对表达量比较
Figure 3 Comparison of CYGB mRNA expression among the three groups
3 讨论
氧是细胞、组织代谢和维持生命的重要物质,在与氧相关储存和转运生理过程中,携氧球蛋白——血红蛋白和肌红蛋白发挥着重要作用。2002年,Burmester在人类和小鼠体内发现了第4种携氧球蛋白——CYGB,其广泛分布于人体各组织和器官,具有携氧和运输氧功能[3,10]。大量研究表明,组织和细胞缺氧时CYGB表达明显上调,这可能是组织细胞自我保护的机制之一[11-13]。
脑低氧预适应是脑组织对低氧/缺血的一种内源性防护机制,自从脑低氧预适应被发现以来,大量研究对其作用机制进行了探讨和分析,提出了包括氧化应激、一氧化氮作用、低温等在内的多种假说,但其确切作用机制目前尚不清楚。鉴于CYGB在组织缺氧中的重要作用,探讨CYGB在低氧预适应小鼠大脑组织中的表达对阐明低氧预适应作用机制具有重要意义。
马海然等[14]在体外培养的神经元中发现,CYGB mRNA及蛋白表达量随低氧时间延长而增高,推测CYGB可能参与低氧预适应及脑保护作用;本研究结果显示,低氧预适应组小鼠CYGB蛋白相对表达量高于空白对照组和实验对照组,实验对照组小鼠CYGB蛋白相对表达量高于空白对照组,低氧预适应组、实验对照组小鼠CYGB mRNA表达量高于空白对照组,与上述文献报道结果基本一致。本课题组前期研究结果显示,急性重复低氧可上调低氧诱导因子1(HIF-1)的表达[15-16];Wystub等[17]研究发现,CYGB启动子的上游基因序列包含能与HIF-1特异位点结合的低氧应答元件(HREs),并在3′端非翻译区发现了保守的可经缺氧诱导的mRNA信号位点,因此推测低氧预适应过程中HIF-1促进了CYGB的转录,进而导致CYGB表达上调。CYGB参与低氧预适应及脑保护作用的可能机制主要有以下几个方面:(1)CYGB能够通过与NO紧密结合而清除低氧/缺血导致的机体分泌的过量NO[18],从而避免过量的NO对神经元造成损伤;(2)CYGB具有过氧化物酶和超氧化物歧化酶作用[19],可利用亚铁原卟啉和硫醇残基清除活性氧,能在氧化应激时保护细胞免受损伤;(3)CYGB具有过氧化氢酶作用,能促进糖酵解和ATP生成,在低氧/缺血时为细胞提供能量[20];(4)低氧环境下,有氢离子和还原性物质存在时,CYGB易发生变构而利于释放氧,从而更好地发挥运输氧和储氧功能。
综上所述,低氧预适应是一种内源性保护机制,CYGB可能参与低氧预适应过程,但其具体作用机制目前尚不清楚,如能分离、纯化或在体外合成低氧预适应过程中产生的具有脑保护物质,这将为临床防治脑卒中或其他低氧缺血疾病提供新选择,本研究拟在今后的研究中通过敲除小鼠CYGB基因而进一步验证CYGB在低氧预适应中的作用。
[1]Bergeron M,Giddy JM,Yu AY,et al.Role of hypoxia-inducible factor-1 in hypoxia induced ischemia tolerance in neonatal rat brain[J].Ann Neurol,2000,48(3):285-296.
[2]Shao G,Lu GW.Hypoxic preconditioning in an autohypoxic animal model[J].Neurosci Bull,2012,28(3):316-320.
[3]Ascenzi P,Gustincich S,Marino M.Mammalian nerve globins in search of functions[J].IUBMB Life,2014,66(4):268-276.
[4]Hundahl CA,Allen GC,Hannibal J,et al.Anatomical characterization of cytoglobin and neuroglobin mRNA and protein expression in the mouse brain[J].Brain Res,2010,1331:58-73.
[5]Beckerson P,Svistunenko D,Reeder B,et al.Effect of the distal histidine on the peroxidatic activity of monomeric cytoglobin[J].F1000Res,2015,4:87-94.
[6]Fordel E,Geuens E,Dewilde S,et al.Cytoglobin expression is upregulated in all tissue upon hypoxia:an in vitro and in vivo study by quantitative real-time PCR[J].Biochem Biophys Res Commun,2004,319(2):342-348.
[7]Tian SF,Yang HH,Xiao DP,et al.Mechanisms of neuroprotection from hypoxia-ischemia(HI)brain injury by up-regulation of cytoglobin(CYGB)in a neonatal rat model[J].J Biol Chem,2013,288(22):15988-16003.
[8]Zhang S,Zhang Y,Jiang S,et al.The effect of hypoxia preconditioning on DNA methyltransferase and PP1γ in hippocampus of hypoxia preconditioned mice[J].High Alt Med Boil,2014,15(4):483-490.
[9]Li S,Zhang Y,Shao G,et al.Hypoxic preconditioning stimulates angiogenesis in ischemic penumbra after acute cerebral infarction[J].Neural Regen Res,2013,8(31):2895-2903.
[10]Ostojic J,Sakaguchi DS,de Lathouder Y,et al.Neuroglobin and cytoglobin:oxygen-blinding proteins in retinal neurons[J].Invest Ophthalmol Vis Sci,2006,47(3):1016-1023.
[11]Raida Z,Reimets R,Hay-Schmidt A,et al.Effect of permanent middle cerebral artery occlusion on Cytoglobin expression in the mouse brain[J].Biochem Biophys Res Commun,2012,424(2):274-278.
[12]Emara M,Turner AR,Allalunis-turner J.Hypoxia differentially upregulates the expression of embryonic,fetal and adult hemoglobin in human glioblastoma cells[J].Int J Oncol,2014,44(3):950-958.
[13]Yu X,Gao D.Overexpression of cytoglobin gene inhibits hypoxic injury to SH-SY5Y neuroblastoma cells[J].Neural Regen Res,2013,23(8):2198-2203.
[14]马海然,史雪川.胞红蛋白在缺氧神经元中的表达[J].中国儿童保健杂志,2014,22(5):492-496.
[15]邵国,周卫华,高翠英,等.低氧预适应对小鼠海马组织HIF-1与EPO低氧应答元件结合活性的影响[J].中国应用生理学杂志,2007,23(1):1-4.
[16]Shao G,Zhang R,Gao CY,et al.Expression alterations of hypoxia-inducible factor-1 alpha subunit in the hippocampus of mice acutely and repeatedly exposed to hypoxia[J].Neuroscience Bulletin,2005,21(4):278-282.
[17]Wystub S,Ebner B,Fuchs C,et al.Interspecies comparison of neuroglobin,cytoglobin and myoglobin:sequence evolution and candidate regulatory elements[J].Cytogenet Genome Res,2004,105(1):65-78.
[18]Petersen MG,Dewilde S,Fago A.Reactions of ferrous neuroglobin and cytoglobin with nitrite under anaerobic conditions[J].J Inorg Biochem,2008,102(9):1777-1782.
[19]McRonald FE,Risk JM,Hodges NJ.Protection from intracellular oxidative stress by cytoglobin in normal and cancerous oesophageal cells[J].PLoS One,2012,7(2):e30587.
[20]Kawada N,Kristensen DB,Asahina K,et al.Characterization of a stellate cell activation-associated protein(STAP)with peroxidase activity found in rat hepatic stellate cells[J].J Biol Chem,2001,276(27):25318-25323.
(本文编辑:鹿飞飞)
Expression and Clinical Significance of Cytoglobin in Brain Tissue of Hypoxia Preconditioning Mice
HUANGLi-hua,SHAOGuo,JIAPing-ping,etal.
PublicHealthSchoolofBaotouMedicalCollege,Baotou014010,China
Objective To explore the expression and clinical significance of cytoglobin in brain tissue of hypoxia preconditioning mice.Methods From November 8 to 12 in 2014,a total of 60 Kunming species male adult mice were randomly divided into A group,B group and C group,each of 20 mice.Mice of A group were normally feed in normal oxygen content,mice of B group were prepared for hypoxia preconditioning model for one time,while mice of C group were prepared for hypoxia preconditioning model for four times.Immune protein imprinting test was used to detect the cytoglobin protein expression,real-time quantitative PCR was used to detect the cytoglobin mRNA expression.Results The relative cytoglobin protein expression of C group was statistically significantly higher than that of B group and A group,respectively,and relative cytoglobin protein expression B group was statistically significantly higher than that of A group(P<0.01).The relative cytoglobin mRNA expression of C group and B group was statistically significantly higher than that of A group,respectively(P<0.01),while no statistically significant differences of relative cytoglobin mRNA expression was found between B group and C group(P>0.05).Conclusion Hypoxia preconditioning is a kind of endogenesis protect mechanisms,and cytoglobin maybe play an important role in the process.
Hypoxia preconditioning;Hippocampus;Cytoglobin;Mice
国家自然科学基金(81160244);内蒙古自治区高等学校科学研究项目(NJZY12225)
014010内蒙古包头市,包头医学院公共卫生学院(黄丽华,张冬),生物医学中心(邵国),药学院(贾平平)
黄丽华,邵国,贾平平,等.细胞红蛋白在低氧预适应小鼠大脑组织中的表达及其临床意义[J].实用心脑肺血管病杂志,2015,23(7):43-46.[www.syxnf.net]
R 854.22 R 332
A
10.3969/j.issn.1008-5971.2015.07.012
2015-04-15;
2015-07-10)
Huang LH,Shao G,Jia PP,et al.Expression and clinical significance of cytoglobin in brain tissue of hypoxia preconditioning mice[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2015,23(7):43-46.
