家蝇幼虫溶菌酶II基因的克隆、表达及抑菌活性研究
2015-06-09邵清唐艳万玲孔令聪裴志花马红霞
邵清,唐艳,万玲,孔令聪,裴志花,马红霞,2∗
(1.吉林农业大学动物科学科技学院,长春130118;2.动物生产与产品质量安全教育部重点实验室,长春130118)
家蝇幼虫溶菌酶II基因的克隆、表达及抑菌活性研究
邵清1,唐艳1,万玲1,孔令聪1,裴志花1,马红霞1,2∗
(1.吉林农业大学动物科学科技学院,长春130118;2.动物生产与产品质量安全教育部重点实验室,长春130118)
以本实验室构建的鸡致病性大肠杆菌诱导家蝇幼虫抑制性消减杂交文库(SSH)为基础,对家蝇幼虫溶菌酶II基因(MdL-II)进行克隆,得到全长为532 bp的cDNA片段,其开放阅读框(ORF)与GenBank中登录号为HQ897688.1的MdL-II基因全序列同源性为95%。将MdL-IIORF序列插入到pET-32a(+)表达载体中成功构建重组质粒,其表达产物经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,结果显示约在34 ku处出现表达条带且与目的蛋白大小相符。当诱导温度为37℃,IPTG浓度为0.6 mmol/L时可获得大量可溶性Trx-MdL-II融合蛋白,纯化融合蛋白并进一步检测该蛋白的抑菌活性,结果表明融合蛋白对大肠杆菌和链球菌均有抑菌作用,且对大肠杆菌的抑菌作用相对较强。
家蝇幼虫;家蝇溶菌酶II基因;克隆表达;蛋白纯化
溶菌酶作为抗菌肽家族中的一员,在抵抗病原微生物方面发挥着举足轻重的作用[1-2]。相关研究表明,溶菌酶基因可在经病原微生物刺激的家蝇幼虫肠内和脂肪内高效表达[3],从而杀灭入侵的病原微生物起到保护自身不受伤害的作用,这也是家蝇幼虫能长期生存在恶劣环境中而自身不感染病原菌的主要原因之一,其抗菌机理可能是通过消化细菌细胞壁的肽聚糖层水解N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的β-1,4糖苷键来破坏微生物细胞壁使细胞失去保护而裂解凋亡[4]。本研究以鸡致病性大肠杆菌诱导三日龄家蝇幼虫后构建的家蝇幼虫抑制性消减杂交文库(SSH)为基础,对筛选出的差异基因家蝇幼虫溶菌酶II基因(Musca domestica lysozyme-II,MdL-II)进行克隆表达,并对纯化产物进行活性检测,以期为进一步研究Trx-MdL-II融合蛋白的相关活性及构效关系奠定基础。
1 材料与方法
1.1 材料
1.1.1 SSH文库、受体菌和表达载体 以临床分离获得的鸡肠道致病性大肠杆菌诱导家蝇3日龄幼虫后构建的SSH文库,3’和5’-RACE Ready cDNA由吉林农业大学兽医药理学实验室成员完成[5]。感受态细胞E.coli DH5α、感受态细胞E.coli BL21(DE3)、原核表达载体pET-32a(+)均由本实验室保存。
1.1.2 主要试剂 SMARTTMRACE cDNA Amplifica⁃tion,Clontech Laboratories,Inc公司。Ex TaqTMDNA聚合酶、限制性内切酶Xho I、Bam H I、Hin d III、pMD18-T载体试剂盒、DL 2000DNA Marker、λ-Hin d III digest DNA Marker、T4 DNA Ligase,大连宝生物工程有限公司。DNA凝胶回收试剂盒购自生工生物工程(上海)股份有限公司。异丙硫代β-D半乳糖苷(IPTG)、氨苄青霉素(AMP),自北京鼎国昌盛生物技术有限责任公司。琼脂糖、DTT(二硫苏糖醇)、TEMED(四甲基乙二胺)、尿素、Imidazole(咪唑),Sigma公司。His TrapTMFF crude预装柱,瑞典GE healthcare公司。其余试剂均为国产分析纯。
1.1.3 引物合成及DNA测序 引物合成及重组质粒的测序均由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 家蝇幼虫溶菌酶II基因的cDNA末端快速扩增(RACE) 针对SSH文库中筛选获得的MdL-II基因cDNA序列设计特异性引物。利用Primer5.0软件根据SMARTTMRACE cDNA Amplification Kit说明书中设计特异性引物的原则设计3’RACE和5’RACE特异性引物如下GSP2:5’-GCACTCATCG⁃TAGGAGAAGGCACC-3’;GSP1:5’-GGCTCTCGCGAC⁃TATGGTATCTTCC-3’。将特异性引物送由生工生物工程(上海)股份有限公司合成,扩增3’RACE和5’RACE由本实验室成员独立完成。RACE扩增产物经回收纯化后与pMD18-T载体连接,连接产物转化入E.coli DH5α感受态细胞中,将酶切验证为阳性的重组质粒送由生工生物工程(上海)股份有限公司测序分析。
1.2.2 MdL-II基因开放阅读框的扩增 将测序成功后得到的5’和3’末端序列利用DNAMAN软件拼接获得MdL-II基因的全长cDNA序列。运用在线网站http://www.ncbi.nlm.nih.gov/gorf/gorf.html寻找该序列的ORF序列。利用Primer5.0软件对该ORF序列设计特异性引物MdL-IIF和MdL-IIR如下:MdL-IIF,5’-TAGGATCC ATGTTCAAATTCACC-3’(含Bam H I酶切位点);MdL-IIR,5’-CACTC⁃GAGTTAGAAGCAATCATCA-3’(含XhoⅠ酶切位点)。
以家蝇幼虫5’-RACE-Ready cDNA为模板对MdL-II基因ORF序列进行PCR扩增,回收PCR产物并纯化后与pMD18-T载体连接,连接产物转化入E.coli DH5α感受态细胞中。提取质粒经双酶切验证为阳性后,将重组质粒送由生工生物工程(上海)股份有限公司测序分析。将该重组质粒命名为pMD18-T-MdL-II。
1.2.3 MdL-II基因ORF序列的测定及序列同源性分析 运用NCBI网站http://blast.ncbi.nlm.nih.gov/Blast.cgi对MdL-II基因ORF序列进行BLASTN分析。运用DNAMAN软件分析MdL-II基因ORF序列与已知溶菌酶基因序列的同源性。
1.2.4 MdL-II基因原核表达质粒的构建 将原核表达载体质粒pET-32a(+)与重组质粒pMD18-TMdL-II进行Bam H I和Xho I双酶切,酶切产物经1%琼脂糖凝胶电泳后回收MdL-II目的基因和pET-32a(+)原核表达载体。将MdL-II目的基因与pET-32a(+)原核表达载体连接过夜,次日将连接产物转化至E.coli DH5α感受态细胞中,提取重组质粒并进行双酶切鉴定,将获得的阳性重组质粒送由生工生物工程(上海)股份有限公司测序分析。将重组质粒命名为pET-32a-MdL-II。
1.2.5 重组质粒pET-32a-MdL-II表达产物的SDS-PAGE分析 将测序成功的重组阳性质粒pET-32a-MdL-II转化到E.coli BL21(DE3)感受态细胞中,参照文献[6]的方法挑取单克隆菌落接种于含5μLAmp的5 mL液体LB培养基中,37℃150 r/min振荡培养过夜后取3 mL菌液接种于300 mL液体LB培养基中,监测菌液OD600值在0.6~0.8之间时,加入IPTG进行诱导表达。诱导表达的菌液经TE反复吹洗2次后,冰浴超声波破碎,分别取上清和沉淀进行SDS-PAGE电泳分析。
1.2.6 重组质粒pET-32a-MdL-II表达条件的优化挑取含有重组质粒pET-32a-MdL-II的单克隆菌落进行培养,检测目的基因在诱导剂(IPTG)浓度和诱导温度不同时表达水平的变化。参照文献[6]的方法针对起始浓度(OD600为0.7)、诱导时间(6 h)和诱导温度(37℃)相同的菌液变化IPTG终浓度0、0.2、0.4、0.6、0.8、1.0 mmol/L观察其表达水平的变化;对起始浓度(OD600为0.7)、诱导时间(6 h)和IPTG终浓度(0.6 mmol/L)相同的菌液变化诱导温度10、20、28、37℃观察其表达水平的变化。对上述试验菌液各取1mL进行SDS-PAGE电泳,分析目的蛋白的表达量从而确定重组质粒pET-32a-MdL-II的最佳表达条件。
1.2.7 Trx-MdL-II融合蛋白的亲和纯化 收集最优诱导条件下表达的菌液,以TE(pH 8.0)缓冲液反复洗涤菌体2次,冰浴超声波破碎菌体后,4℃12000 r/min离心30 min。取超生破碎后的上清液进行亲和纯化,操作过程参照GE healthcare的His TrapTMHP说明书进行。
1.2.8 Trx-MdL-II融合蛋白抑菌活性检测 用超滤管将纯化获得的融合蛋白进行浓缩,采用牛津杯法检测融合蛋白的抑菌活性[7]。取100μL菌液(105CFU/mL)均匀涂布于LB平板上,放入牛津杯,杯内加入100μLTrx-MdL-II融合蛋白,37℃培养12 h,观察有无抑菌环出现,并测量抑菌环大小。
2 结果
2.1 MdL-II基因的cDNA末端快速扩增 用MdL-II基因的特异性引物进行PCR扩增(图1),将3’与5’扩增产物分别与pMD18-T克隆载体连接,提质粒经双酶切(Xho I,Hin d III)验证为阳性后,送生工生物工程(上海)股份有限公司测序分析,获得一条411 bp的3’端片段(图2),获得一条362 bp的5’端片段(图3),利用DNA软件进行拼接得到大小为532 bp的全长序列。
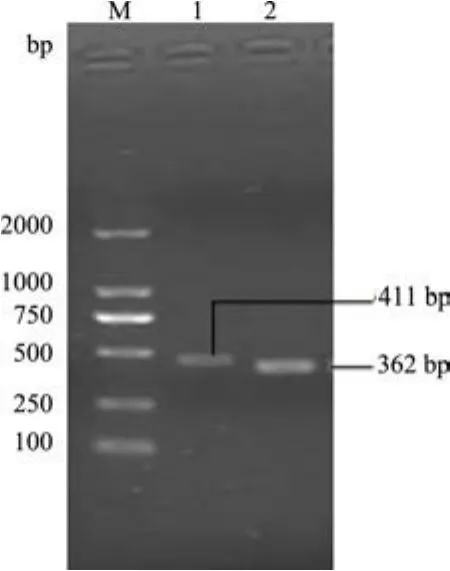
图1 MdL-II基因的RACE扩增结果

图2 MdL-II基因3’重组质粒酶切鉴定结果

图3 MdL-II基因5’重组质粒酶切鉴定结果
2.2 全长基因的PCR扩增 用MdL-II基因的全长引物进行PCR扩增得到一条约为429 bp的片段(图4)。pMD18-T-MdL-II重组质粒双酶切验证显示,获得的条带与429 bp大小相符(图5),证明克隆载体重组质粒构建成功。
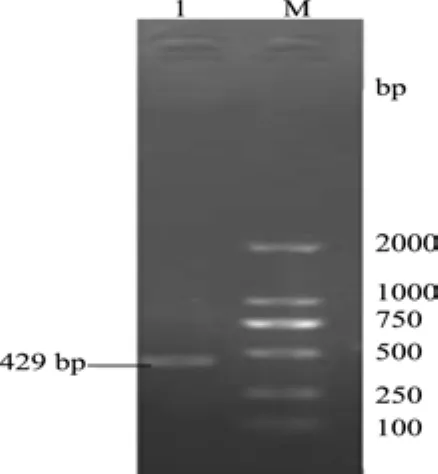
图4 MdL-II全长基因的扩增结果
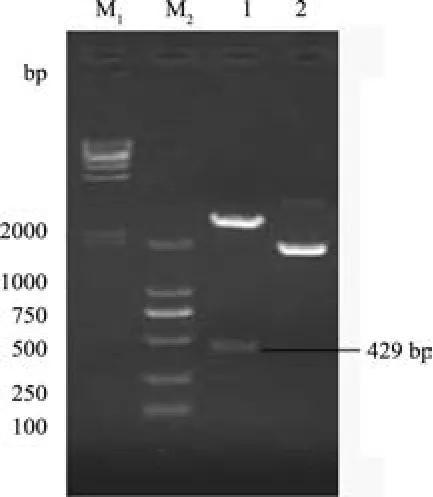
图5 pMD18-T-M dL-II重组质粒的双酶切验证
2.3 MdL-II基因ORF序列的测定及序列同源性分析 MdL-II基因ORF片段长度为429 bp,运用NCBI网站对MdL-II全长基因序列进行BLAST比对分析,结果显示MdL-II基因与Genbank中登录号为HQ897688.1的家蝇溶菌酶II基因全序列同源性为95%,氨基酸序列同源性为97%,且差异氨基酸散在分布于氨基酸序列当中。此外,MdL-II基因与登录号为AY344588.1的家蝇富含赖氨酸的溶菌酶2基因序列同源性为93%,与登录号为AY344589.1的家蝇溶菌酶1基因序列同源性为74%。
2.4 pET-32a-MdL-II重组质粒的构建 pET-32a-
MdL-II重组质粒经双酶切验证后,获得大小约为429 bp和5900 bp的片段(图6),分别为MdL-II全长基因目的片段和pET-32a(+)表达载体,表明pET-32a-MdL-II原核表达重组质粒构建成功。
2.5 MdL-II基因表达产物的SDS-PAGE分析分别诱导带有pET-32a(+)空载体质粒的E.coli BL21(DE3)菌液和带有pET-32a-MdL-II重组质粒的E.coli BL21(DE3)菌液表达,取诱导后的表达产物进行SDS-PAGE分析。结果显示,经诱导的重组菌液在约34 ku大小处出现表达条带,与预期表达蛋白大小相符(图7)。对重组菌进行冰浴超声破碎,电泳检测发现目的蛋白大部分存在于上清液中,在沉淀中含量较少,属于可溶性表达(图8)。

图6 pET-32a-MdL-II重组质粒酶切鉴定
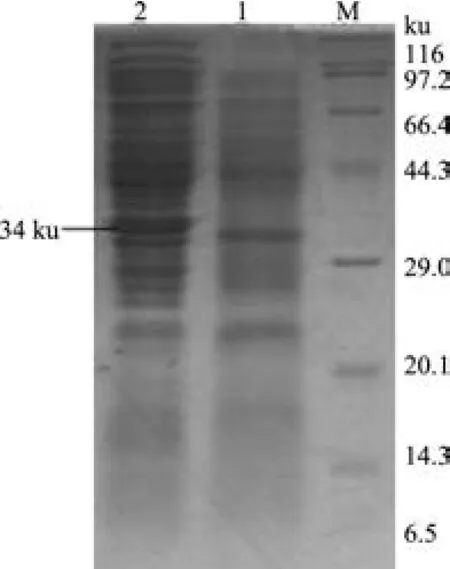
图7 重组质粒表达产物PAGE电泳

图8 融合蛋白在上清和沉淀中表达量的对比
2.6 重组质粒pET-32a-MdL-II表达条件的优化分别采用不同浓度的IPTG进行诱导,各取1 mL诱导菌液进行SDS-PAGE电泳分析(图9),结果表明当IPTG浓度为0.6 mmol/L时融合蛋白获得高效表达。在IPTG浓度为0.6 mmol/L条件下,分别采用10、20、28、37℃进行诱导,各取1 mL诱导菌液进行SDS-PAGE电泳分析(图10),结果显示当诱导温度为37℃时融合蛋白表达量较大。
2.7 Trx-MdL-II融合蛋白的纯化 采用镍离子亲和层析方法纯化经超声破碎后含有目的蛋白的上清液。SDS-PAGE结果显示,140 mM的咪唑洗脱液中含有分子量约为34 ku的融合蛋白目的条带(图11)。
2.8 Trx-MdL-II融合蛋白的抑菌活性检测 大量收集纯化后的融合蛋白并以超滤管浓缩后得到浓度为2.312 mg/mL的融合蛋白。以洗脱液为对照与浓缩后的融合蛋白进行抑菌效果的比较(图12-图13)。

图9 不同浓度IPTG诱导下融合蛋白表达量分析

图10 不同诱导温度下融合蛋白表达量分析

图11 Trx-MdL-II融合蛋白的纯化产物

图12 融合蛋白对链球菌的抑菌实验
浓缩后的融合蛋白对链球菌和大肠杆菌均有抑菌环出现,融合蛋白对链球菌的抑菌环直径为7 mm,对大肠杆菌的抑菌环直径为16 mm,而洗脱液没有抑菌环出现,说明融合蛋白对链球菌和大肠杆菌均有抑菌作用。
3 讨论
在微生物的诱导刺激下家蝇可通过部分基因的选择性表达对自身免疫反应进行调控,以合成的一系列免疫活性物质对异物的侵袭进行抵御[8]。相关研究表明与家蝇免疫防御功能相关的基因包括:防御素基因、攻击素基因、天蚕素基因、溶菌酶基因、肽聚糖识别蛋白基因、金属硫蛋白基因、热休克蛋白70基因等[9-10],这些基因均与家蝇免疫反应休戚相关。近年来,随着人们对家蝇免疫基因进行深入研究,溶菌酶做为抗菌肽的主要成员已逐步受到了人们的高度重视。
研究人员在对溶菌酶的进一步研究中发现不同来源的溶菌酶抑菌活性各不相同,并且具有较广的抗菌谱。相关研究报道重组海参溶菌酶C端基因(SjLys-C)的表达产物对溶壁微球菌和副溶血弧菌有较高的抑菌活性[11]。赵燕静等[12]发现天然三倍体淇河鲫不同组织器官中的溶菌酶抑菌活性存在差异,对霍乱弧菌的抑制作用最强的为肝胰脏和肾脏中的溶菌酶。宋佳[13]以3种微生物(大肠杆菌、蛹虫草菌及柞蚕微孢子虫)诱导柞蚕蛹后,研究免疫血淋巴的抑菌作用结果显示3个处理组的柞蚕踊血淋巴中提取的溶菌酶对溶壁微球菌所产生的抑菌圈直径均在14-22 mm之间。王梅梅等[14]成功构建了pET-32a-MdL-1原核表达载体,并对其融合蛋白的生物学活性进行鉴定,结果显示溶菌酶融合蛋白对鸡致病性大肠杆菌有抑菌活性。
本试验对MdL-II差异基因进行了克隆表达,该基因与王梅梅等克隆的家蝇溶菌酶1基因序列同源性为68%,氨基酸序列同源性为73%,为进一步研究MdL-II差异基因的生物学活性,本实验构建了pET-32a(+)-MdL-II表达载体,探索了不同浓度IPTG对Trx-MdL-II融合蛋白表达量的影响,进而对融合蛋白的体外抑菌活性进行了检测。结果表明,选用浓度为0.6 mmol/L的IPTG时融合蛋白表达量较高并多以可溶蛋白的形式存在于裂解液上清中;融合蛋白对大肠杆菌和链球菌均有抑菌作用,且对大肠杆菌的抑菌活性明显高于家蝇溶菌酶1基因的表达产物,因此,Trx-MdL-II融合蛋白在农业和医药等行业中具有潜在应用和开发价值。
[1] Hikima S,Hikima J,Rojtinnakorn J,et al.Characterization and function of kuruma shrimp lysozymepossessing lytic activity against Vibrio species[J].Gene 2003(316):187-195.
[2] 沈芃.溶菌酶抗菌作用及其在防控医院感染中的应用[J].中国消毒学杂志,2014,31(10):1089-1091.
[3] 郑立,李娟,郭亚伟,等.家蝇溶菌酶2基因的克隆及其性质研究[J].四川动物,2011,30(5):705-710.
[4] 陈一.工程蝇蛆中免疫活性物质的研究[D].天津科技大学,2003.
[5] 左红梅.大肠杆菌诱导家蝇幼虫抑制性消减文库构建及部分差异基因分析[D].吉林农业大学,2011.
[6] J.萨姆布鲁克,D.W.拉塞尔.分子克隆实验指南[M].北京:科学出版社,2002:91-95,1226-1227.
[7] Chao Song,Hao Yu,Min Zhang,et al.Physicochemical properties and antioxidant activity of chitosan from the blowfly Chrysomya megacephala larvae[J].International Journal of BiologicalMacro⁃molecules,2013,60(19):347-354.
[8] Tang H.Regulation and function of the melanization reaction in Drosophila[J].Fly(Austin),2009,3(1):105-111.
[9] 马红霞,孙娜,裴志花,等.家蝇抗菌肽的研究进展[J].中国兽药杂志,2007,41(11):45-49.
[10]汤晴,顾若兰,孙文种,等.家蝇幼虫抗菌活性诱导研究[J].中国抗生素杂志,2012,37(2):98-131.
[11]常艺海,丛丽娜,卢冬,等.重组海参溶菌酶C端基因(SjLys-C)的可溶性表达和抑菌活性分析[J].Journal of Agricultural Biotechnology,2012,20(4):443-450.
[12]赵燕静,武向敏,蒋昕,等.淇河鲫不同组织器官溶菌酶与抑菌活性比较[J].水生态学杂志,2014,35(1):87-90.
[13]宋佳.微生物诱导柞蚕血淋巴溶菌酶基因表达及分析[D].沈阳农业大学,2013.
[14]王梅梅,万玲,孔令聪,等.家蝇溶菌酶1基因的克隆、序列分析及原核表达[J].中国兽药杂志,2014,48(3):10-14.
(编辑:陈希)
Cloning and Prokaryotic Expression of the Lysozyme IIGene from Musca domestica Larvae
SHAO Qing1,TANG Yan1,WAN Ling1,KONG Ling-cong1,PEIZhi-hua1,MA Hong-xia1,2∗
(1.College of AnimalScience and Technology,Jilin Agriculural University,Changchun 130118,China;2.Animal Production&Product Quality and Security,Ministry ofEducation,Changchun 130118,China)
The experiment was based on the suppression subtractive hybridization library(SSH)induced by Pathogenic Escherichia coli of chicken which constructed by Animal Pharmacology and Toxicology Laboratory.Amplify Md-lysozyme IIgene’sfull-length cDNA,then sequencing analysis showed that the full-length cDNA of Md-lysozyme II gene was 532 bp,in size,the homology of the open reading frame cDNA sequence with the Md-lysozyme II(HQ897688.1)from GenBank is up to 95%.The Md-lysozyme IIgene was ligated into expression vector pET-32a(+).The recombinant protein was verified by SDS-PAGE,the results showed that the recombinant protein was about 34 ku and consistent with the size of the target protein.When the induction temperature was 37℃and the concentration of IPTG was 0.6 mmol/L we could get a large amount of soluble Trx-MdL-IIrecombinant protein..In order to obtain high purity recombinant protein we used nickel ion affinity chromatography to purify Trx-MdL-II recombinant protein.While the recombinant protein could inhibit the growth of Escherichia coli and Streptococcus,the inhibitory effect on Escherichia coli was relatively stronger than on Streptococcus.Key words:Musca domestica larvae;Md-lysozyme II;cloning and expression;protein purification
2014-11-25
A
1002-1280(2015)02-0001-06
S852.6
教育部新世纪优秀人才项目(NCET-10-0174);吉林省世行贷款农产品质量安全项目(2011-Y05);吉林省科技厅项目(20111820)
邵清,硕士研究生,从事动物药理与毒理学方面研究。
马红霞。E-mail:hongxia0731001@163.com
