鸭甲肝病毒VP1基因克隆及序列分析
2015-06-09藏玉婷王彬宋扬丁国杰
藏玉婷,王彬,宋扬,丁国杰
鸭甲肝病毒VP1基因克隆及序列分析
藏玉婷,王彬,宋扬,丁国杰∗
(哈药集团生物疫苗有限公司研发中心,哈尔滨150069)
通过PCR技术,从自行分离的鸭甲肝病毒JS株基因组中扩增出病毒衣壳蛋白VP1完整基因片段,并对该片段进行序列测定及分析。结果显示JS-VP1与DHAV-A的VP1基因序列酸核苷酸同源性在62.0%~64.4%之间,与DHAV-B的VP1基因序列酸核苷酸同源性在63.6%~63.8%之间,与DHAV-C的VP1基因序列酸核苷酸同源性在92.3%~98.5%之间,分析表明JS株为鸭甲肝病毒基因C型,血清型分型为韩国新型。进化树表明JS株与SD02株的亲缘关系较进,进一步说明VP1基因的核苷酸序列是DHAV基因组中的高度可变区,可作为DHAV基因型研究的标记,分离毒株为DHAV的防治及疫苗的设计奠定了基础。
鸭甲肝病毒;VP1基因;序列分析
鸭甲肝病毒(Duck hepatitis A virus,DHAV)是小RNA病毒科禽肝病毒属成员,鸭甲肝病毒可引起鸭病毒性肝炎,鸭病毒性肝炎是危害养鸭业的重要传染病。其中,DHAV分为血清1型、“台湾新型”和“韩国新型”,对应于基因A型(DHAV-A)、B型(DHAV-B)和C型(DHAV-C)[1-2]。近两年来,我国许多养鸭地区同时流行DHAV-A和DHAV-C[3]。由于不同型DHAV之间缺乏交叉保护,而我国多数鸭场只针对DHAV-A采取措施,因此我国现地流行株主要为DHAV-C,并给养鸭业造成巨大的经济损失。VP1(Viral protein 1)蛋白包含了小RNA病毒的主要抗原位点及细胞膜受体结合位点,能够诱导动物机体产生中和性抗体[4],因此,VPl基因核苷酸序列同源分析比较,已成为不同DHAV毒株血清型分型的分子生物学基础。为了进一步研究DHAV毒株的分子生物学特性、变异趋势,本研究于2009年在江苏省某鸭场分离病毒DHAV-JS株,并对所分离到的JS株VP1基因进行序列分析,从分子水平研究其基因特征,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 病料 病料取自江苏省徐州市某鸭场疑似鸭病毒性肝炎的病死鸭。
1.1.2 实验鸭胚 10日龄SPF鸭胚,购自中国农科院哈尔滨兽医研究所。
1.1.3 引物及主要试剂 根据文献[5]合成引物DHAV-A VP1引物序列P1:5’-GGTGATTCTAAC⁃CAGTTGG-3’,P2:5’-TTCAATTTCCAGATTGAGT-3’,DHAV-C VP1引物序列P3:5’-CAGATGGCCGCCAAT⁃GATCAG-3’,P4:5’-GTCTCTGACATTTCGAAATTGG⁃TATGA-3’,由上海生物工程技术有限公司合成。M-MLV反转录酶、DNA Marker、PMD18-T载体、感受态DH5α、限制性内切酶Hin dⅢ、Bam HⅠ均购自大连宝生物有限公司;病毒RNA提取试剂盒、质粒提取试剂盒、琼脂糖、胶回收试剂盒购自上海华舜生物有限公司;其他试剂为分析纯。
1.2 方法
1.2.1 样品处理 将病变肝脏、脾脏剪碎、研磨,用灭菌pH 7.4磷酸盐缓冲液(PBS)作1∶5稀释,经3000 r/min离心30 min,取上清液加入抗生素,使每毫升组织液含有2000 IU青霉素和2000μg链霉素,于37℃温箱作用30 min后按4∶1加入分析纯三氯甲烷,充分混匀后放置37℃温箱作用60min,经3000 r/min离心30min,取上清液经无菌、支原体和外源病毒检验合格后,作为接种用样品。
1.2.2 病毒分离 用灭菌pH7.4磷酸盐缓冲液(PBS)将上述样品做100倍稀释,经尿囊腔接种10日龄SPF鸭胚,每胚0.2 mL,37℃培养7 d,记录死胚情况。收集48~96 h死亡鸭胚的胚体及尿囊液。反复冻融3次,4000 r/min离心30min,取上清经无菌、支原体和外源病毒检验合格后,作为鸭胚毒,命名为DHAV-JS,-40℃保存备用。
1.2.3 病毒RNA提取和反转录 参照病毒RNA提取试剂盒及M-MLV反转录酶说明书进行。合成的cDNA模板,置-20℃保存备用。
1.2.4 VP1基因的PCR扩增 按以下顺序加入各溶液建立50μL PCR反应体系:ddH2O 35μL、10×PCR Buffer 5μL、mix dNTP(2.5 mmol/L)4μL、上游引物(50 pmol/μL)1μL、下游引物(50 pmol/μL)1μL、 cDNA 3μL、Taq酶0.5μL。优选的最佳反应条件为:95℃预变性5min、94℃变性1min、50℃退火1min、72℃延伸1min,共30个循环,72℃延伸10min。
1.2.5 扩增产物鉴定 将PCR产物在1.0%糖凝胶中电泳,溴化乙锭染色,紫外投射仪上观察与拍照,与DNA Marker比较。
1.2.6 PCR产物的纯化 将扩增片段参照试剂盒说明书进行胶回收。
1.2.7 PCR产物的克隆和鉴定 将PCR回收产物在16℃下连接到PMD18-T载体上,连接体系为:PMD18-T载体0.5μL;SolutionⅠ5μL;目的片断4.5μL;连接时间为3 h。将连接产物10μL加入100μL的感受态菌DH5α中于37℃摇床培养1 h,涂布于AMP+的LB固体培养基上,37℃培养16~18 h,挑取白色菌落于LB液体培养基中37℃扩增培养10 h,参照质粒提取试剂盒说明书提取阳性质粒进行酶切鉴定。
1.2.8 基因序列测序和分析 将经过鉴定确定为阳性的菌液寄送上海生物工程有限公司进行测序,并将结果用DNASTAR软件进行序列分析,参考序列见表1。

表1 参考序列
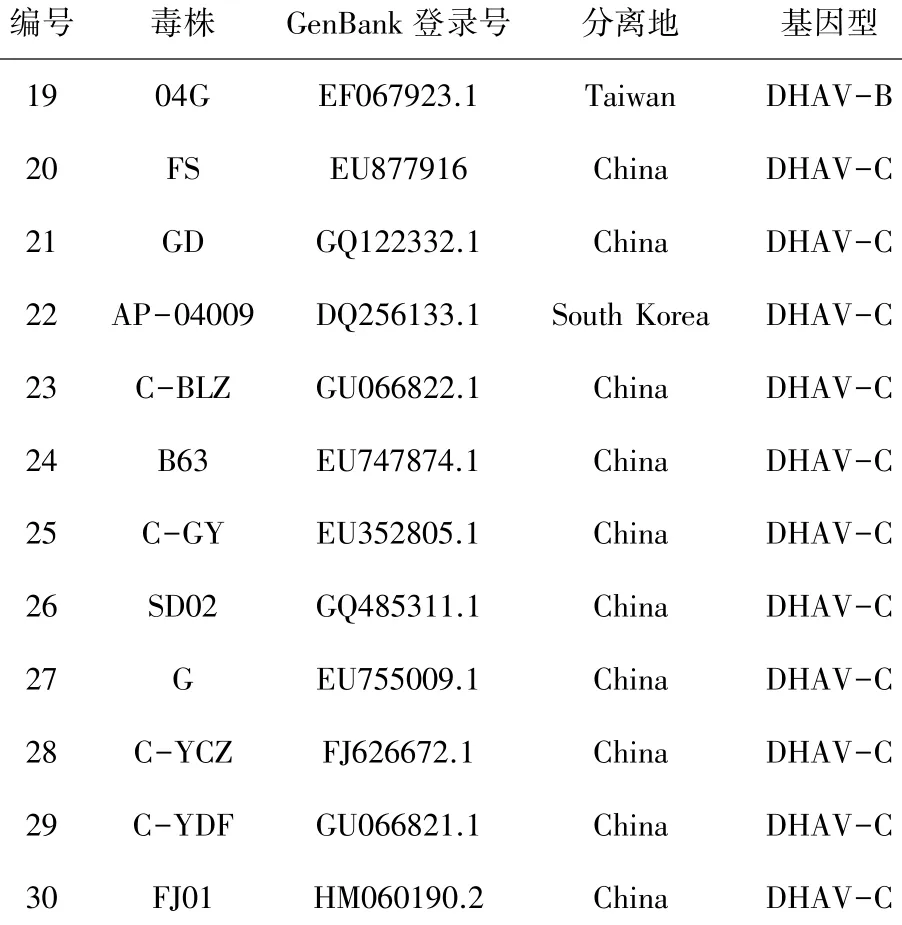
续表
2 结果
2.1 PCR结果 以cDNA为模板进行PCR扩增,经电泳分析,扩增出约714 bp左右的片段,与预期大小一致(图1)。

图1 PCR产物电泳图
2.2 JS-VP1同源性比较及基因进化树分析 将JS-VP1的基因序列与参考毒株的相应序列进行比较,JS-VP1与DHAV-A的VP1基因序列酸核苷酸同源性在62.0%~64.4%之间,与DHAV-B的VP1基因序列酸核苷酸同源性在63.6%~63.8%之间,与DHAV-C的VP1基因序列酸核苷酸同源性在92.3%~98.5%之间(表2)。进化树分析表明,所分离到的JS株与SD02株(DHAV-C)的亲缘关系较近(图2)。

表2 不同毒株的VP1基因序列比较分析%
3 讨论
VP1蛋白被普遍认为是小RNA病毒的最重要的抗原蛋白,编码该蛋白的VP1基因的核苷酸序列是DHAV基因组中的高度可变区[6-7]。不同血清型DHAV的抗原性主要与病毒的表面结构蛋白VPl有关。本试验根据序列测定及分析表明,JS-VP1的基因与DHAV-A的VP1基因序列酸核苷酸同源性在62.0%~64.4%之间,与DHAV-B的VP1基因序列酸核苷酸同源性在63.6%~63.8%之间,与DHAV-C的VP1基因序列酸核苷酸同源性在92.3%~98.5%之间,依据同属小RNA病毒的人肠病毒血清型分型标准,即VPl蛋白的核苷酸同源性≥75%和/或氨基酸同源性≥88%即可判定为同一血清型[8],对VP1核苷酸序列同源性比较表明,JS株与DHAV-C属于同一血清型,而与DHAV-A和DHAV-B属于不同的血清型。
本试验将JS-VP1与不同地区和不同时间分离发表的DHAV-VP1序列比较,进化树分析表明,JS株与SD02株(中国)、AP-04009株(韩国)及B63株(中国)等基因序列的同源性均在96%以上,表明DHAV-C的分子流行相对较稳定,病毒的变异较小,这为我国对该病的诊断和防制提供了重要的依据。
彭小薇等指出近年来DHAV-C或韩国新型在我国的地区分布已较为广泛,我国许多鸭场针对传统的DHAV-A采取措施后仍发生鸭病毒性肝炎的根本原因是DHAV-A及DHAV-C在我国许多养鸭地区的同时流行[9]。目前市场上尚无DHAV-C疫苗,该试验结果可指导疫苗及诊断试剂的研发,对疾病的防控具有重要意义。
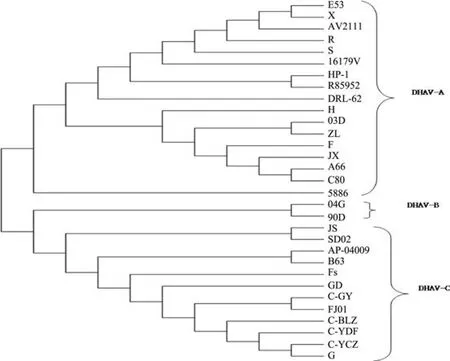
图2 JS-VP1基因与参考毒株进化树分析
[1] Tseng CH,TsaiH J.Molecular characterization of a new serotype of duck hepatitis virus[J].Virus Res,2007,126:19-31.
[2] Kim M C,Kwon Y K,Joh S J,et al.Recent Korean isolates of duck hepatitis virus revealed the presence of a new geno and serotype when compared to duck hepatitis virus type1 type strains[J].Arch Virol,2007,152:2059-2072.
[3] 张大丙.鸭甲肝病毒的分子生物学研究进展[J].中国兽医杂志,2010,46(3):59-60.
[4] Oberste M S,Maher K,Kilpatrick DR,et a1.Molecular evolution of the human enteroviruses:correlation of serotype with VPI sequence and application to picomaviruses[J].J Virol,1999,76:1244-1251.
[5] 范书才,李虹,袁率珍,等.新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报,2009,31(10):770-775.
[6] Liu G,Wang F,Ni Z,etal.Genetic diversity of the VP1 gene of duck hepatitis virus typeⅠ(DHV-Ⅰ)isolates from southeast China is related to isolate attenuation[J].Virus Res,2008,137(1):137-141.
[7] 邵泽香,韦强,鲍国连,等.鸭肝炎病毒浙江分离株全基因组测序及其VP1基因的序列分析[J].中国兽医学报,2010,30(8):1052-1055.
[8] Oberste M S,Maher K,Kilpatrick D R,et al.Molecular evolution of the human enteroviruses:correlation of serotype with VP1 sequence and application to picornavirus classification[J].J Virol,1999,73(3):1941-1948.
[9] 彭小薇,徐永亮,王笑言,等.鸭甲肝病毒VP1基因的克隆和序列分析[J].中国兽医杂志,2009,45(9):18-19.
(编辑:李文平)
Clone and Sequence Analysis of VP1 Gene of Duck Hepatitis A Virus
ZANG Yu-ting,WANG Bin,SONG Yang,DING Gou-jie∗
(Harbin Pharmaceutical Group Co Ltd Biological Vaccine,Harbin 150069,China)
VP1 gene of duck hepatitis A virus was amplified from the gene by PCR,and then sequenced.The result of sequence analysis showed that the gene of VP1 of JS strain and DHAV-A shared identities of 62.0%~64.4%,DHAV-B shared identities of 63.6%~63.8%,and DHAV-C shared identities of 92.3%~98.5%which showed that JS strain was DHAV-C and a new serotype strain in Korea.Phylogenetic analysis showed that it had the closest relationship with SD02 strain.This conclusion further illustrated that the nucleotide sequence of VP1 gene was highly variable area of DHAV,and could be used as DHAV genotype research.The isolate will lay a theoretical basis for the disease prevention and vaccine design.
DHAV;VP1 gene;sequence analysis
2014-10-14
A
1002-1280(2015)02-0018-04
S858.32
藏玉婷,硕士,从事兽用疫苗研制工作。
丁国杰。E-mail:445298136@qq.com
