胃癌根治术后腹腔热灌注化疗联合XELOX方案的临床效果观察
2015-06-09路琳崔秀洁姜北
路琳,崔秀洁,姜北
论著·临床
胃癌根治术后腹腔热灌注化疗联合XELOX方案的临床效果观察
路琳,崔秀洁,姜北
目的 观察胃癌根治术后腹腔热灌注化疗联合奥沙利铂(OXA)+卡培他滨(Xeloda)(XELOX方案)辅助化疗的临床疗效与安全性。方法 2011年1月—2012年3月收治胃癌术后患者112例,按术后治疗方法分为观察组(54例)和对照组(58例),观察组术后给予腹腔热灌注化疗(顺铂+5-氟尿嘧啶)2~3次,2周后予XELOX 4周期化疗方案;对照组术后仅予XELOX 4周期化疗方案。比较2组化疗期间药物毒性反应,化疗结束后30 d采血检测肿瘤标志物[癌胚抗原(CEA)、糖蛋白抗原19-9(CA19-9)]水平,随访观察患者复发率、转移率与3年生存率。结果 观察组化疗后30 d CEA水平为(4.2±2.0)μg/L,CA19-9水平为(19.7±6.5) U/ml,对照组分别为(7.1±3.1)μg/L、(37.4±15.1) U/ml,均显著低于治疗前(P<0.01),且治疗后观察组水平明显低于对照组(U=5.923、8.153,P<0.01)。观察组特异性毒性反应主要为腹膜刺激症状40例(18.5%),明显高于对照组的2例(3.4%)(χ2=6.639,P=0.010),其余药物毒性反应发生率差异无统计学意义(P>0.05)。观察组随访期内复发率为13.5%、远处转移率为19.3%,均低于对照组的32.1%、30.4%,其中复发率差异有统计学意义(χ2=5.267,P=0.022)。观察组3年生存率为77.8%,明显高于对照组的58.6%(χ2=4.705,P=0.030)。结论 胃癌根治术后在行XELOX方案辅助化疗基础上,联合行腹腔热灌注化疗能进一步杀灭脱落癌细胞,降低肿瘤复发与远处转移率,延长远期生存时间,不良反应轻微可控。
胃癌根治术;腹腔热灌注化疗;XELOX化疗方案;肿瘤标志物;复发率;生存率
外科手术是治疗胃癌的最佳手段,若肿瘤侵犯浆膜或临近淋巴结,即便实施根治术,术后仍可有50%的患者因为腹腔种植造成局部复发或远处转移[1],因此胃癌根治术后进行辅助化疗对于消除微小转移灶或脱落癌细胞尤为必要。腹腔热灌注化疗( hyperthermic peritoneal perfusion chemotherapy, HPPC)是一种集热疗、化疗、低渗冲洗于一体的肿瘤治疗方法,近年来逐步应用于胃肠道手术术后的辅助化疗。奥沙利铂(OXA)联合卡培他滨(Xeloda)是高效低毒的胃肠道肿瘤一线化疗方案,笔者在对胃癌术后患者行OXA+Xeloda辅助化疗基础上,联合应用HPPC治疗,并对其远期疗效进行了随访观察,现将结果报道如下。
1 资料与方法
1.1 临床资料 2011年1月—2012年3月我院诊治胃癌术后患者112例,入选标准:经病理组织学确诊为胃癌,胃癌根治术后患者,年龄<70岁,Karnofsky(KPS)评分≥70分,骨髓功能、心肝肾功能正常,签订治疗随访协议。排除标准:术后复发者,术前行辅助放化疗治疗者,术后有化疗禁忌证者及合并严重感染者。112例中男61例,女51例,年龄34~68岁。腺癌72例,黏液腺癌29例,印戒细胞癌11例;国际抗癌联盟TNM分期II期22例,III期78例,IV期12例;有家族史者43例;实施近端胃癌根治术38例,远端胃癌根治术44例,全胃切除术30例。根据术后化疗方法不同将患者分为观察组(54例)与对照组(58例),2组患者性别、年龄、病情、手术方式等比较差异无统计学意义(P>0.05),具有可比性。见表1。全部患者或家属均签署知情同意书,研究获得医院医学伦理委员会审查批准。
1.2 术后化疗方案 观察组给予腹腔热灌注联合全身化疗方案:(1)手术关腹前置热灌注管与引流管,按照顺铂(DDP)100 mg/m2+5-氟尿嘧啶(5-FU)500 mg/m2+地塞米松10 mg加生理盐水4 000~5 000 ml配制化疗液,采用珠海和佳HG-CZ-102型热灌注机进行腹腔热灌注化疗,设定进体温度(44±0.5)℃、出体温度(41±0.5)℃、灌注速度500~600 ml/min,持续灌注60 min,灌注后嘱患者反复翻身,以助药物在腹腔内均匀分布。灌注结束后,开放引流管,保留化疗液1 000 ml于腹腔。每周灌注2次,共灌注2~3次。(2)灌注化疗2周后行奥沙利铂联合卡培他滨(XELOX方案)全身化疗。化疗前静脉推注盐酸格拉司琼9 mg、奥沙利铂(OXA) 130 mg/m2加5%葡萄糖注射液500 ml静脉滴注3 h,第l天;卡培他滨(Xeloda)1 250 mg/m2口服,每日2次,第1~14天。 每21天为1个化疗周期,连续化疗4个周期。对照组仅给予XELOX方案化疗化疗4个周期。
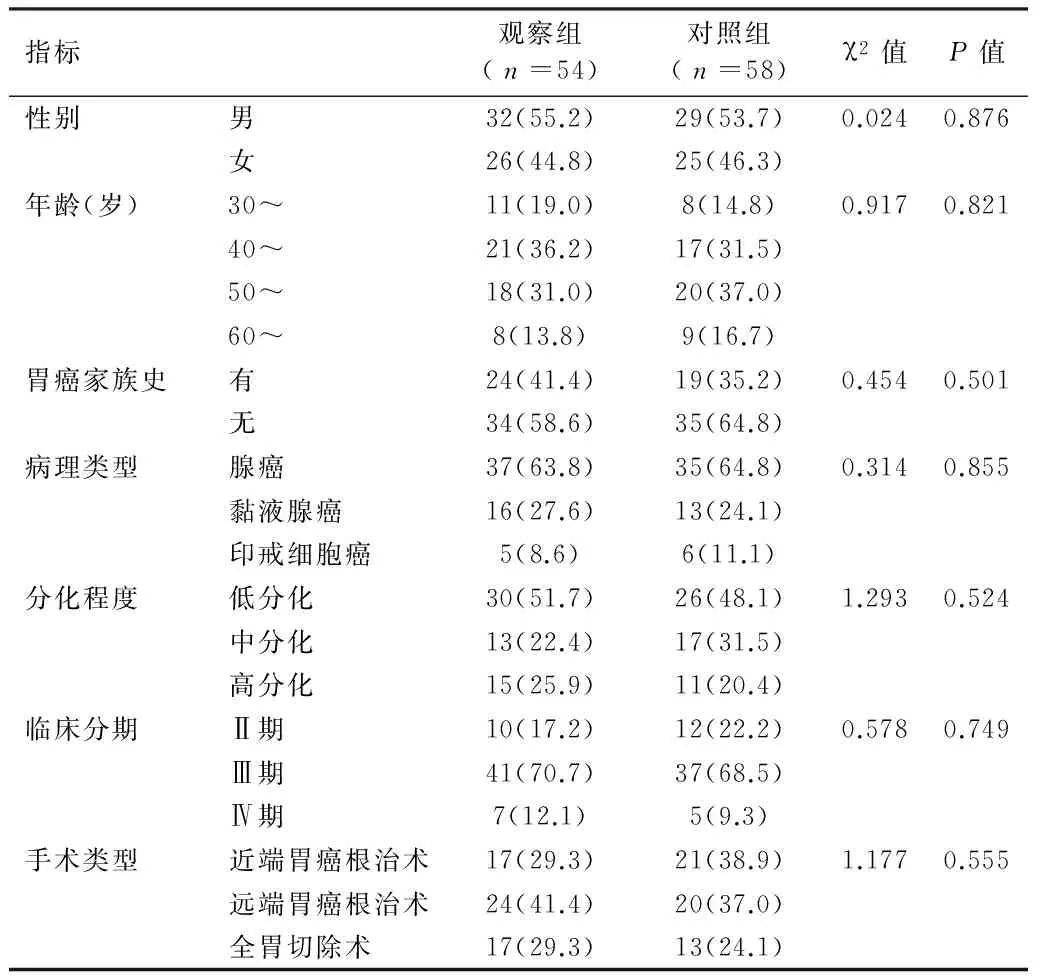
表1 2组患者一般临床特征比较 [例(%)]
1.3 观察项目 (1)肿瘤标志物:术前与化疗结束后30 d采取空腹肘静脉血,采用罗氏E170 型电化学发光分析仪及罗氏公司配套试剂盒(电化学发光法)测定癌胚抗原(CEA)、糖蛋白抗原19-9(CA19-9)水平。(2)化疗药物毒性反应:参照美国国家癌症研究所制定的常见毒性分级标准NCI-CTC 3.0版标准[2],记录化疗期间药物毒性反应及程度,0度(无反应),I度(轻度反应),II度(中度可耐受),III度(中度不可耐受),IV度(有严重并发症)。(3)随访分析:化疗结束后进行随访,记录局部复发、远处转移情况及生存时间。
2 结 果
2.1 肿瘤标志物比较 与术前比较,化疗结束后30 d,2组肿瘤标志物水平均显著下降(P<0.05),且观察组CEA、CA19-9水平均明显低于对照组(P<0.01)。见表2。
2.2 药物毒性反应比较 2组均未出现因化疗药物毒性反应而终止疗程者。观察组特异性毒性反应主要是灌注药液后产生的腹胀、腹痛等腹膜刺激症状,发生率明显高于对照组(P<0.05),但并未出现药物性腹膜炎、吻合口瘘、切口裂开、粘连性肠梗阻等严重药物相关性并发症。其余药物毒性反应类型相近,观察组发生率略高于对照组,差异无统计学意义(P>0.05)。见表3。
2.3 随访情况比较 2组化疗结束后进行随访,其中2组各失访2例。随访时间15~36个月。随访期间,观察组局部复发7例(13.5%)、腹膜后淋巴结转移7例(13.5%)、肝转移3例(5.8%);对照组局部复发18例(32.1%),腹膜后淋巴结转移10例(17.9%)、肝转移5例(8.9%)、肺转移2例(3.6%);2组患者复发率差异有统计学意义(χ2=5.267,P=0.022),观察组远处转移率(19.3%)低于对照组(30.4%),但差异无统计学意义(χ2=1.780,P=0.182)。
2.4 生存情况比较 化疗结束36个月后,观察组生存42例,对照组生存34例,2组3年生存率(77.8% vs.58.6%),差异有统计学意义(χ2=4.705,P=0.030)。2组生存时间分布经Log-rank检验显示差异有统计学意义(χ2=129.995,P<0.01)。见图1。
3 讨 论
胃癌术后减少复发和远处转移是提高胃癌术后生存率的关键因素。胃癌手术后,患者可因癌细胞侵透胃浆膜、术中切缘癌细胞的脱落及阻断血管、淋巴管内残留的癌细胞等因素造成局部复发或转移[3];同时,原发肿瘤的切除客观上会造成残留微小癌灶的快速增殖[4]。而胃癌是对化疗相对敏感的肿瘤,因此,胃癌术后常通过辅助化疗,清除腹腔内的微小转移灶与游离癌细胞,避免复发为实体瘤。
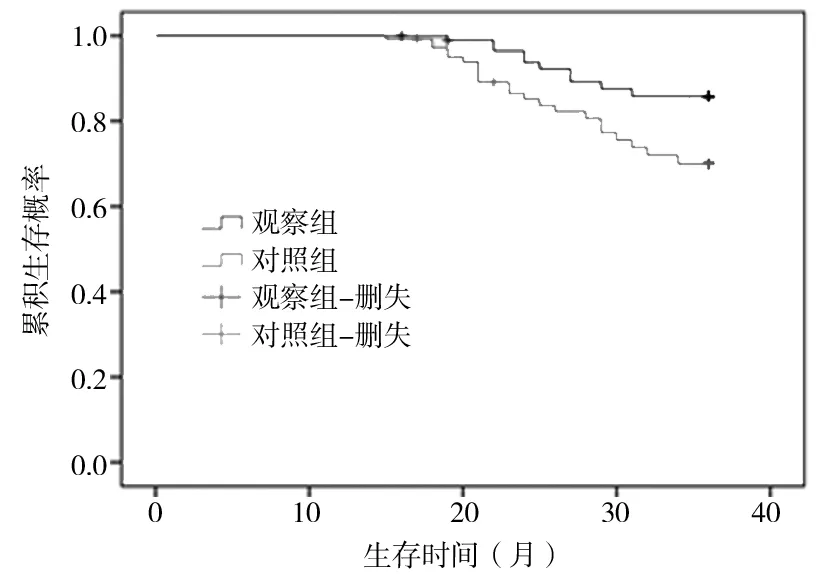
图1 2组化疗结束后生存时间比较
氟尿嘧啶类药物联合铂类药物是消化道肿瘤化疗用药的经典方案。本研究中采用了高效低毒的XELOX方案为基础化疗方案,其中,OXA是继卡铂(CBP)、顺铂(DDP)之后的第三代铂类药物,通过与肿瘤DNA链上的G共价结合,形成铂化加合物,抑制肿瘤细胞DNA的合成及修复;OXA与CBP、DDP无交叉耐药性,且无心、肾、耳毒性,血液毒性小于CBP,胃肠道毒性小于DDP。Xeloda是新一代口服氟尿嘧啶类药物,是5-FU的前体,通过阻断脱氧核糖尿苷酸细胞内胸苷酸合成酶转化为胸苷酸,干扰肿瘤RNA和蛋白质的合成。口服Xeloda较静脉应用5-FU具有使用方便、胃肠道局部浓度高,且不良反应小的优势[5]。研究报道[6]。应用XELOX方案治疗晚期胃癌的总体有效率为41.5%~46.7%,无疾病进展时间6.2~7.5个月[7]。冯丹等[8]报道,mFOLFOX方案与XELOX方案治疗老年晚期胃癌的近期有效率分别为41.4%、38.9%;疾病控制率分别为79.3%、77.8%,且2组不良反应均可耐受。CEA、CA19-9 是胃肠道肿瘤的标志物,阳性界值分别为CEA>5 μg/L、CA19-9>39 U/ml[9],本研究中,笔者观察到2组患者术后肿瘤标志物均较术前显著下降,可推测XELOX能明显抑制体内肿瘤细胞的生长。虽然术后静脉化疗可消除手术不能识别的微小转移灶,但由于血浆—腹膜屏障的存在使腹腔内药物浓度较低,静脉全身化疗效果并不理想。研究中对照组术后局部复发率为32.1%,远处转移率为30.4%,3年生存率为58.6%。
表2 2组患者术前与化疗结束后30d肿瘤标志物水平比较

表3 2组患者化疗药物毒性反应发生率比较 [例(%)]
HPPC是一种集热疗、局部化疗和低渗灌洗为一体的区域化疗方法。该疗法借助大量生理盐水作为灌注载体,使腹腔内脱落癌细胞和残留微小癌灶直接持续浸润在化疗液中,较静脉化疗局部药物浓度提高10~30倍[10]。同时,43℃是多数恶性肿瘤细胞的临界致死温度;42℃热疗可显著增强顺铂对胃癌SGC-7901细胞的毒性作用,诱导癌细胞凋亡[11]。常温下化疗药物对肿瘤组织仅能渗透到3 mm,而高温可以促进渗透增加到5 mm[12]。 HPPC将药物加热至42~45℃,该温度能改变癌细胞细胞膜的通透性,加速肿瘤细胞内的溶酶体活性与肿瘤细胞的崩解及癌细胞DNA的断裂[13]。国外报道[14],热疗能增强NK细胞、T淋巴细胞和巨噬细胞的活性,并促进IL-6、IL-8、TNF-α等细胞因子的合成,增强体积免疫能力。此外,化疗药物经门静脉入肝脏代谢,仅少量药进入体循环,既能有效杀死肝内的游离癌细胞,又能减轻药物对全身的不良反应。文献报道[15],腹腔循环热灌注联合DCF或ECF化疗总体有效率为68.3%、临床获益率为92.5%,均显著高于单纯静脉化疗方案的48.8%、72.7%(P<0.05)。本研究中观察组在实施XELOX化疗之前,给予2~3次DDP联合5-FU 的HPPC治疗,治疗结果表明,化疗结束后30 d,观察组肿瘤标志物水平较对照组下降更为明显,而随访期内观察组复发率、远处转移率均显著低于对照组,而3年生存率则显著高于对照组,说明胃癌术后HPPC治疗序贯XELOX方案化疗较单纯XELOX化疗更能杀灭腹腔内残留肿瘤细胞,减少复发率,进而延长存活时间,提高远期生存率。实施HPPC治疗,除腹膜刺激症状外,并未明显增加患者的药物不良反应,也说明胃癌术后实施HPPC治疗具有临床安全性。
综上所述,HPPC治疗集热疗、局部化疗和低渗灌洗于一身,具有热增敏、改善药物代谢、降低药物毒性反应等优势,胃癌患者术后实施HPPC治疗联合XELOX全身化疗,能进一步杀灭腹腔内残留的微小转移灶与游离癌细胞,达到改善局部治疗效果,提高远期生存率的目的。
1 郭继红,闰志峰,张祖平.进展期胃癌患者67例术后腹腔持续温热灌注联合静脉化疗的临床观察[J].中国实用医刊,2012,39(12):72-743.
2 吴尉,朱跃红,袁志军,等.吉西他滨或培美曲塞联合顺铂治疗晚期非小细胞肺癌的临床比较研究[J].临床和实验医学杂志,2010,9(8):576-577.
3 郑琳,黎海亮,郭晨阳,等.FOLFOX方案肝动脉化疗栓塞并留管灌注联合替吉奥治疗胃癌术后肝转移的临床疗效评价[J].疑难病杂志,2013,12(2):117-119.
4 Li TJ,Huang CC,Ruan PW,et al.In vivo anti-cancer efficacy of magnetite nanocrystal - based system using locoregional hyperthermia combined with 5-fluorouracil chemotherapy[J].Biomaterials,2013,34(32):7873-7883.
5 石书红,张辉.老年胃癌患者术后三维适形放射治疗同步XELOX方案化学治疗的疗效[J].中国医药导刊,2013,15(12):2006-2007.
6 闵娜,何本夫,张罗生,等.XELOX方案一线治疗晚期或复发胃癌的临床研究[J].南方医科大学学报,2010,30(3):599-601.
7 崔玉忠,王洪敏,王永涛.Xelox方案治疗晚期胃癌62例分析[J].实用癌症志,2011,26(6):658-659.
8 冯丹,张颖一,傅强,等.不同化疗方案一线治疗老年晚期胃癌近期疗效分析[J].医学研究杂志,2011,40(8):64-67.
9 詹宏杰,梁寒,王宝贵.60 例进展期胃癌术中腹腔热灌注化疗的临床观察[J].中国肿瘤临床,2010,37(4):229-231.
10 Clares B,Biedma-Ortiz RA,Sáez-Fernández E,et al.Nano-engineering of 5-fluorouracil-loaded magnetoliposomes for combined hyperthermia and chemotherapy against colon cancer[J]. Eur J Pharm Biopharm,2013,85(3 A):329-338.
11 张自森,薛长年,张剑,等.腹腔热灌注顺铂联合卡培他滨治疗晚期胃癌腹腔积液[J].实用医学杂志,2012,28(20):3447-3449.
12 白赛曦,崔书中,巴明臣,等.精确腹腔热灌注化疗治疗中晚期结直肠癌的临床疗效观察[J].实用医学杂志,2013,29(15):2488-2490.
13 林维凯.奥沙利铂联合腹腔热灌注治疗胃肠癌的效果观察[J].中国当代医药,2013,20(9):64-65.
14 Fujitani K.Overview of adjuvant and neoadjuvant therapy for resectable gastric cancer in the East[J]. Dig Surg,2013,30(2):119-129.
15 张晓飞,刘文超,喻召才,等.腹腔循环热灌注联合化疗治疗晚期胃癌的临床研究[J].现代肿瘤医学,2010,18(12):2415-2418.
Clinical efficacy of hyperthermic peritoneal perfusion chemotherapy combined with XELOX chemotherapy in treatment of gastric cancer after radical surgery
LULin,CUIXiujie,JIANGBei.DepartmentofOncology,theCentralHospitalofChaoyangCity,LiaoningProvince,Chaoyang122000,China
Objective To observe the clinical efficacy and safety of the gastric cancer radical postoperative intraperitoneal hyperthermic perfusion chemotherapy combined with oxaliplatin (OXA) + capecitabine (Xeloda) (XELOX regimen) adjuvant chemotherapy.Methods From 2011 January to 2012 March, 112 cases gastric cancer patients were enrolled, according to the method of postoperative treatment, they were divided into observation group (54 cases) and control group (58 cases). Patients in the observation group were given chemotherapy of intraperitoneal hyperthermic perfusion chemotherapy (cisplatin + fluorouracil) 2-3 times, 2 weeks later were given XELOX for 4 cycles of chemotherapy; after surgery, in the control group, patients only
XELOX for 4 cycles of chemotherapy. Compared chemotherapy drug toxicity of the 2 group, after 30 days of chemotherapy, blood samples were collected to detect tumor marker [carcinoembryonic antigen (CEA), carbohydrate antigen 199 (CA19-9)] level. All the patients were followed up to observe the recurrence rate, metastasis rate and 3 years survival rate.Results In the observation group after chemotherapy, after 30 days’ CEA levels was (4.2±2.0)μg/L, CA19-9 level was (19.7±6.5) U / ml. The control group were (7.1±3.1)μg/L, (37.4±15.1) U/ml respectively, all were significantly lower than before treatment (P<0.01), and observation group was significantly lower than that of the control group (U=5.923,U=8.153,P<0.01). Observation group’s specific toxicity mainly was peritoneal irritation symptoms with 40 cases (18.5%), which was significantly higher than that of control group’s 2 cases (3.4%) (χ2=6.639,P=0.010), the rest of the drug toxicity showed no statistical significance differences (P>0.05). Observation group’s rate of recurrence during the follow-up period was 13.5%, metastasis rate was 19.3%, which were lower than the control group’s 32.1% and 30.4%. The difference of the recurrence rate was statistically significant (χ2=5.267,P=0.022). The observation group’s 3 years survival rate was 77.8%, which was significantly higher than the control group’s 58.6% (χ2=4.705,P=0.030).Conclusion After radical gastrectomy for gastric cancer, combined with XELOX regimen adjuvant chemotherapy and intraperitoneal perfusion chemotherapy can further kill off cancer cells, reduce tumor recurrence and metastasis rate, prolong the long-term survival time, adverse reactions are mild and controllable.
Gastrectomy; Peritoneal perfusion chemotherapy; XELOX regimen; Tumor markers; Recurrence rate; Survival rate
122000 辽宁省朝阳市中心医院肿瘤内科
10.3969 / j.issn.1671-6450.2015.10.016
2015-06-30)
