HEK293F细胞瞬时表达PDGFR-β/Fc蛋白的条件优化*
2015-06-07袁凤媚黄嘉慧刘东晨谢秋玲
洪 坡,袁凤媚,黄嘉慧,刘东晨,张 途,谢秋玲
(暨南大学生命科学技术学院//广东省生物工程药物重点实验室//基因工程药物国家工程研究中心,广东广州510632)
过去10年中,瞬时基因表达系统快速生产复杂治疗性蛋白技术得到了广泛应用[1],瞬时基因表达 (Transient gene expression,TGE)是一种使用动物细胞悬浮培养技术快速生产毫克级至克级重组蛋白的方法,目前最常用的细胞株是CHO细胞和HEK 293细胞,这两种细胞可适应无血清悬浮培养[2]。HEK293细胞凭借其易转染、高表达、天然人糖基化修饰、允许蛋白正确折叠和相关翻译后修饰等优点使用最为广泛[3-4]。聚乙烯亚胺(PEI)是一种在小规模到大规模蛋白表达中广泛使用的转染试剂,它具有高效性和经济性等优点[2,4-5]。PEI是一种阳离子聚合物,可与 DNA 结合凝聚成带正电荷的纳米颗粒,颗粒与细胞表面硫酸乙酰肝素蛋白聚糖黏合,并通过胞吞作用进入细胞,从而促进细胞对DNA的摄取[6-7]。线型和支化的25000 PEI是使用最为广泛的聚合物,其中线型PEI转染效率更高、毒性更小,常被用于悬浮培养的 HEK293 细胞的转染[8-10]。
血小板源性生长因子 (platelet derived growth factor,PDGF)具有诱导肿瘤中淋巴管生成和促进肿瘤淋巴转移的功能,是潜在的治疗肿瘤分子靶标[11]。可溶性血小板源性生长因子受体 (sPDGFR)可与细胞膜表面的PDGFR竞争性结合 PDGF,从而阻断PDGF的生物学效应,有望用于肿瘤的治疗[12-13]。PDGFR主要包含两种结构相似的受体亚型PDGFR-α 和 PDGFR-β。PDGFR的 β 链膜外区与人IgG Fc片段的重组型可溶性融合蛋白sPDGFR-β/Fc受体作为一种新型的PDGF拮抗剂,具有很好的应用前景。
本实验用 PEI介导 PDGFR-β/Fc质粒转染HEK293F细胞,影响转染效率和蛋白表达的因素有活细胞接种密度、DNA浓度、PEI浓度、DNA与PEI聚合时间以及添加物[14],本实验对上述因素进行优化。
1 材料和方法
1.1 质粒和细胞株
HEK293F细胞由南开大学惠赠,pXLG-PDGFR-β/Fc为本实验室保存。
1.2 主要试剂及仪器
无内毒素质粒抽提试剂盒 (NucleoBond Xtro Maxi Plus)购自德国 MN公司;PEI购自 Polysciences公司;EX-CELL®293无血清培养基购自美国SIGMA公司;RPMI1640培养基购自美国Invitrogen公司;Goat anti-Human IgG(Fc)、Goat pAb to Hu IgG(AP)购自Abcam公司;蛋白胨购自Organotechnie公司;TubeSpin一次性生物反应器购自TPP公司;ACCU-CHEK®血糖仪购自Roche公司;酶标仪购自Thermo公司。
1.3 细胞培养
HEK293F细胞接种于含10 mL EX-CELL®293无血清培养基 (含6 mmol/L谷氨酰胺)的50 mL TubeSpin管中,置于37℃,φ=6%CO2,180 r/min恒温震荡培养箱中培养,培养密度控制在0.5×106cells/mL至4×106cells/mL范围内。在转染前1 d,将细胞离心 (1000 r/min,5 min),新鲜培养基重悬至2×106cells/mL。
1.4 质粒制备
用无内毒素质粒抽提试剂盒抽提质粒,经琼脂糖凝胶电泳验证。NanoDrop2000测定质粒DNA浓度和纯度,A260/280在1.8~1.9,A260/230应大于2.0。
1.5 转染
转染前用血球计数板对细胞计数,细胞活率需在95%以上。将实验所需细胞量的细胞悬液离心(1000 r/min,5 min),一定量RPMI1640培养基于50 mL TubeSpin管中重悬。同时,按实验组设置,将一定量的质粒DNA和PEI溶液混匀聚合。将DNA与PEI聚合溶液加入细胞悬液混匀,置于恒温震荡培养箱中培养。每隔24 h收样检测目的蛋白质量浓度。
1.6 葡萄糖质量浓度测定
采用ACCU-CHEK®血糖仪测定。
1.7 PDGFR-β/Fc蛋白质量浓度测定
采用ELISA方法测定。以羊抗人IgG-Fc包被96孔酶标板,4℃过夜。按一定梯度稀释IgG标准品和培养液上清样品,加入孔中37℃孵育1 h,扣干、洗板后加入w=0.5%BSA稀释的碱性磷酸酶标记的羊抗人IgG,37℃孵育1 h。加显色液孵育15 min,405 nm波长下酶标仪检测A值。通过标准曲线计算PDGFR-β蛋白质量浓度。每孔做3个重复。
2 结果与分析
2.1 HEK293F细胞瞬时转染基本条件的优化
PEI介导的瞬时转染方法中,影响瞬时转染条件的基本因素有细胞接种活细胞密度、质粒DNA浓度、PEI浓度、DNA与PEI的聚合时间。本实验中,细胞接种密度设定2×106cells/mL和4×106cells/mL两个水平,DNA浓度设定1.5 μg/106cells和 2.0 μg/106cells两个水平,DNA∶PEI设定为1∶2、1∶3、1∶4 三个水平,聚合时间设定为 5、10、15 min 3个水平。本实验根据表一进行单因素实验对上述条件进行优化,每组实验重复3次。

表1 HEK293F细胞瞬时转染基本条件的优化Table 1 The primary condition optimization of PDGFR-β/Fc expression for transient gene expression in HEK293F cells
结果显示 (表1),当细胞接种密度为2×106cells/mL时,DNA浓度增加,蛋白表达量略有增加,这是因为受到细胞密度的限制,细胞对质粒DNA的摄入已达到峰值。当细胞接种密度为4×106cells/mL时,增大DNA浓度,蛋白表达量明显增加。增大PEI与DNA的比例,蛋白表达量相对稍低,细胞计数结果显示,增大PEI的浓度,细胞毒性增加,细胞活率相对低。增加DNA与PEI聚合时间,蛋白表达量降低。经过组合优化,HEK293F细胞瞬时表达PDGFR-β融合蛋白最佳条件是细胞接种密度4×106cells/mL、DNA浓度2.0 μg/106cells、DNA/PEI比例1∶2、聚合时间 5 min,蛋白表达量可达15.6 mg/L。
2.2 HEK293细胞瞬时转染其它条件的优化
2.2.1 添加VPA浓度及添加时间的优化 在前述优化的基本条件下,本实验先对VPA添加浓度进行优化,VPA添加浓度为2、3、4、5 mmol/L,细胞转染后24 h添加。然后对VPA的添加时间进行优化,VPA添加时间为转染后0、24、48 h,探索添加时间的影响。每组实验重复3次。
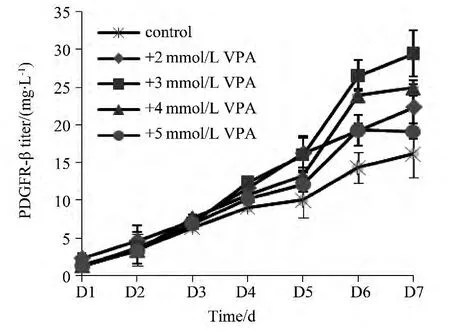
图1 添加不同浓度VPA对PDGFR-β表达的影响Fig.1 Optimization of VPA concentration

图2 不同时间添加VPA对PDGFR-β表达的影响Fig.2 Optimization of time for adding VPA
不同浓度的VPA对细胞表达PDGFR-β蛋白均有促进作用 (图1),在3~4 mmol/L的VPA的效果最好。在添加3 mmol/L VPA时,PDGFR-β蛋白表达量最高 (30 mg/L),约为对照组的2倍。细胞瞬时转染后,在48 h内的不同时间添加VPA,蛋白表达量相近 (约28 mg/L),表明转染后48 h内的不同时间添加VPA对蛋白表达影响不大 (图2)。
2.2.2 添加碳氮源对细胞表达PDGFR-β/Fc蛋白的影响
1)添加不同种类蛋白胨及其质量浓度的优化
本实验选取6种蛋白胨进行筛选,分别为Tryptone N1(胰蛋白胨,TN1)、Casein peptone E1(酪蛋白胨,CE1)、Meat peptone N1(肉蛋白胨,MN1)、Wheat peptone E1(小麦蛋白胨,WE1)、Soy peptone A3SC(大豆蛋白胨,SA3SC)、Soy peptone A2SC(大豆蛋白胨SA2SC)。在最优的基本条件下,HEK293F细胞转染后第3天添加葡萄糖和蛋白胨,葡萄糖终质量浓度为4 mg/L,蛋白胨终质量浓度为1 g/L。

图3 添加不同蛋白胨对PDGFR-β/Fc表达的影响Fig.3 The effect of adding different peptone

图4 不同质量浓度TN1对PDGFR-β/Fc表达的影响Fig.4 The effect of concentrations of TN1
添加不同种类蛋白胨,细胞蛋白表达量均有提高 (图3),其由高到低依次为TN1>MN1>SA2SC>ER2>WE1>SA3SC。添加 TNI蛋白表达量最高,约为35 mg/L,较对照组提高2倍以上。
添加不同质量浓度的蛋白胨 (TN1)对细胞蛋白表达有明显影响 (图4),在1 g/L到15 g/L质量浓度范围内,随着蛋白胨质量浓度的增加,蛋白表达量下降。添加1 g/L和5 g/L质量浓度时,均能促进蛋白表达量,当添加质量浓度超过10 g/L,蛋白表达量反而较对照组低,细胞计数显示细胞活率相对较低,可能高质量浓度蛋白胨的添加增大了培养液渗透压,不利于细胞生长。因此,添加的蛋白胨质量浓度需要有一个合适的范围,本实验当蛋白胨质量浓度为1 g/L时,蛋白表达量最高,达到35 mg/L。
2)添加葡萄糖和蛋白胨对细胞表达PDGFR-β/Fc蛋白的影响
HEK293F细胞转染后,第3天后葡萄糖低于2 mg/L(图5),故在第3天补充葡萄糖和蛋白胨,葡萄糖终质量浓度为4 mg/L,蛋白胨 (Tryptone N1)终质量浓度为1 g/L。

图5 HEK293F细胞转染后培养基中葡萄糖含量Fig.5 The concentration of glucose after transfection
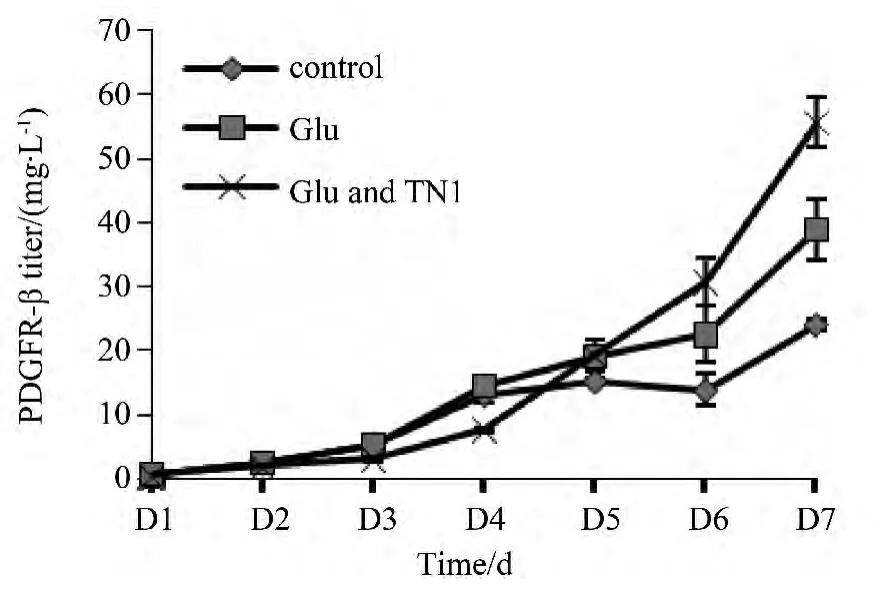
图6 添加葡萄糖和蛋白胨对PDGFR-β表达的影响Fig.6 The effect of adding glucose and peptone
图6结果表明,添加葡萄糖对细胞表达蛋白有促进作用,同时补加葡萄糖和蛋白胨,蛋白表达量明显增加,达到55 mg/L,是对照组的2倍以上。
综上所述,以细胞接种密度4×106cells/mL、DNA 浓度 2.0 μg/106cells、DNA/PEI比例 1∶2、聚合时间5 min条件转染后,48 h内补加3 mmol/L VPA、第3天添加1 g/L的TN1,当葡糖糖浓度低于2 mg/L时补至4 mg/L,可使PDGFR-β/Fc融合蛋白的表达量明显提高。
3 讨论
瞬时基因表达技术在重组药物蛋白研发中已得到广泛应用,不但用于快速生产蛋白进行成药性评价,还用于大规模生产重组蛋白。目前,PEI介导的瞬时转染表达单克隆抗体可以达到1 g/L以上的产量[15]。
细胞密度、DNA浓度和DNA∶PEI比例是影响细胞生长和蛋白表达的关键因素。一定范围内,增大细胞起始密度和DNA量可提高蛋白表达量。但是,细胞密度增加,细胞生长周期缩短;DNA量增加,PEI的量也相应增加,但是PEI对细胞有很大的毒性,导致细胞活率明显下降,所以寻找DNA密度、DNA量、PEI浓度3个因素的最适水平至关重要。本实验对3个因素水平进行优化,明显提高了蛋白表达量。
丙戊酸钠是临床上常用的抗癫痫药物,在有效治疗浓度时表现出很强的抑制组蛋白去乙酰化酶的活性[16]。VPA通过抑制组蛋白去乙酰基酶 (histone deacetylases,HDACs)活性或表达,可诱导HEK293F细胞发生G0/G1期阻滞,细胞处于G1期的特点是物质代谢活跃,迅速合成RNA和蛋白质,细胞体积显著增大。但是VPA抑制细胞增殖作用与添加浓度相关,适当的浓度能使全部细胞处于G1期,大量合成蛋白质;超量使细胞生长受到过度抑制,细胞死亡[17-18]。本实验结果表明,添加3 mmol/L VPA抑制细胞生长和提高蛋白表达量效果最好,48 h内不同时间添加VPA对提高细胞蛋白表达量没有显著差异。
近几年有文献表明,细胞转染后不同时间添加不同种类的蛋白胨对细胞蛋白表达有明显差异。细胞瞬时转染时,在细胞悬液中添加DNA与PEI后,立刻加入蛋白胨,细胞转染终止,转染效率下降,这与蛋白胨中某些成分阻止了DNA/PEI复合物接触细胞表面,或影响细胞对复合物的胞吞作用有关。细胞转染后,适当的时间添加一定量的蛋白胨除了为细胞补充氮源,还具有刺激细胞内基因表达蛋白的作用[19]。本实验对6种蛋白胨进行筛选,探索最佳添加浓度,取得了良好效果。
综上所述,本实验对活细胞接种密度、DNA浓度、PEI浓度、DNA与PEI聚合时间以及添加VPA、蛋白胨进行了优化,为大规模瞬时转染生产PDGFR-β/Fc蛋白奠定了基础,也对HEK293细胞瞬时转染方法具有一定的指导意义。
[1]GEISSE S,VOEDISCH B.Transient expression technologies:past,present,and future[M]//Therapeutic proteins.New York:Humana Press,2012:203-219.
[2]BALDI L,HACKER D L,ADAM M,et al.Recombinant protein production by large-scale transient gene expression in mammalian cells:state of the art and future perspectives[J].Biotechnology Letters,2007,29(5):677-684.
[3]VINK T,OUDSHOORN D M,ROZA M,et al.A simple,robust and highly efficient transient expression system for producing antibodies[J].Methods,2014,65(1):5-10.
[4]PHAM P L,KAMEN A,DUROCHER Y.Large-scale transfection of mammalian cells for the fast production of recombinant protein[J].Molecular Biotechnology,2006,34(2):225-237.
[5]GEISSE S.Reflections on more than 10 years of TGE approaches[J].Protein Expression and Purification,2009,64(2):99-107.
[6]PARIS S,BURLACU A,DUROCHER Y.Opposing roles of syndecan-1 and syndecan-2 in polyethyleneiminemediated gene delivery[J].Journal of Biological Chemistry,2008,283(12):7697-7704.
[7]KHALIL I A,KOGURE K,AKITA H,et al.Uptake pathways and subsequent intracellular trafficking in nonvi-ral gene delivery[J].Pharmacological Reviews,2006,58(1):32-45.
[8]DUROCHER Y,PERRET S,KAMEN A.High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells[J].Nucleic Acids Research,2002,30(2):e9.
[9]LIU C,DALBY B,CHEN W,et al.Transient transfection factors for high-level recombinant protein production in suspension cultured mammalian cells[J].Molecular Biotechnology,2008,39(2):141-153.
[10]SCHLAEGER E J,CHRISTENSEN K.Transient gene expression in mammalian cells grown in serum-free suspension culture[J].Cytotechnology,1999,30(1/2/3):71-83.
[11]YANG S Y,XU G M.Expression of PDGF and its receptor as well as their relationship to proliferating activity and apoptosis of meningiomas in human meningiomas[J].Journal of Clinical Neuroscience,2001,8(4):49-53.
[12]KURATSU J I,SETO H,KOCHI M,et al.Expression of PDGF,PDGF-receptor,EGF-receptor and sex hormone receptors on meningioma[J].Acta Neurochirurgica,1994,131(3/4):289-293.
[13]FIGARELLA-BRANGER D,VAGNER-CAPODANO A M,BOUILLOT P,et al.Platelet-derived growth factor(PDGF)and receptor(PDGFR)expression in human meningiomas:correlations with clinicopathological features and cytogenetic analysis[J].Neuropathology and Applied Neurobiology,1994,20(5):439-447.
[14]RAJENDRA Y,KISELJAK D,BALDI L,et al.A simple high-yielding process for transient gene expression in CHO cells[J].Journal of Biotechnology,2011,153(1):22-26.
[15]BALDI L,HACKER D L,MEERSCHMAN C,et al.Large-scale transfection of mammalian cells[M]//Protein expression in Mammalian cells.New York:Humana Press,2012:13-26.
[16]FIEGL H,ELMASRY K.Cancer diagnosis,risk assessment and prediction of therapeutic response by means of DNA methylation markers[J].Disease Markers,2007,23(1):89-96.
[17]PHIEL C J,ZHANG F,HUANG E Y,et al.Histone deacetylase is a direct target of valproic acid,a potent anticonvulsant,mood stabilizer,and teratogen[J].Journal of Biological Chemistry,2001,276(39):36734-36741.
[18]GOTTLICHER M,MINUCCI S,ZHU P,et al.Valproic acid defines a novel class of HDAC inhibitors inducing differentiation of transformed cells[J].The EMBO Journal,2001,20(24):6969-6978.
[19]PHAM P L,PERRET S,CASS B,et al.Transient gene expression in HEK293 cells:peptone addition posttransfection improves recombinant protein synthesis[J].Biotechnology and Bioengineering,2005,90(3):332-344.
