Fe3O4-SiO2载体制备和脂肪酶固定化条件优化
2015-06-05易笑生谷政伟黎继烈李昌珠
易笑生,胡 铁,冯 超,谷政伟,黎继烈,*,李昌珠
(1.经济林培育与保护省部共建教育部重点实验室(中南林业科技大学),湖南长沙 410004;2.广州航海学院,广东广州 510725;3.湖南省林业科学院,湖南长沙 410004)
Fe3O4-SiO2载体制备和脂肪酶固定化条件优化
易笑生1,胡 铁2,冯 超1,谷政伟1,黎继烈1,*,李昌珠3
(1.经济林培育与保护省部共建教育部重点实验室(中南林业科技大学),湖南长沙 410004;2.广州航海学院,广东广州 510725;3.湖南省林业科学院,湖南长沙 410004)
通过共沉淀法和溶胶-凝胶法制备了Fe3O4-SiO2磁性纳米粒子,将Fe3O4-SiO2磁性纳米粒子表面进行氨基化修饰得到磁性纳米复合载体,用扫描电子显微镜和傅里叶变换红外光谱对载体进行了表征。通过考察加酶量、戊二醛浓度,固定化时间和温度等因素对蛋白固载率和脂肪酶活力的影响,获得了脂肪酶固定化的最适条件。在0.02g/mL脂肪酶液加入量为8.30mL,戊二醛浓度为8.20%时,在温度24℃条件下,固定化4h,制备的固定化脂肪酶酶活3449U/g。
磁性纳米复合载体,脂肪酶,固定化
脂肪酶包括羧酸酯酶和真脂肪酶[1]。脂肪酶的天然底物是油脂,能水解油脂中脂肪酸和甘油相连接的酯键[2],能在油-水界面上催化酯水解、醇解、酯交换、酯合成、内酯合成、高聚物合成、多肽合成及立体异构体拆分等反应[3-4]。由于脂肪酶具备高度底物特异性、位置特异性和立体特异性,是食品与油脂加工良好的生物催化剂[5]。
由于在生产中使用游离酶存在难以分离和利用率低的缺点,酶固定化技术得到了迅速发展。目前用于固定化酶的载体种类很多,磁性载体用于脂肪酶的固定化,具有易于分离和在磁场中定位性好的特点而备受关注[6-8]。但是脂肪酶价格高且稳定性较低,其规模化应用仍然面临许多问题。磁性纳米Fe3O4-SiO2载体是一种价格相对低廉的树脂载体,能与酶分子表面的氨基(-NH2)、羟基(-OH)或巯基(-SH)形成共价结合使其固定化[9-10]。为了获得合适的磁性纳米Fe3O4-SiO2载体和固定化脂肪酶的最佳工艺条件,本文通过合成Fe3O4-SiO2载体和对其表面改性,探讨固定化脂肪酶的优化条件,旨在改善脂肪酶的催化性能和稳定性,降低脂肪使用成本。
1 材料与方法
1.1 材料与仪器
脂肪酶 实验室分离纯化制得,酶活力为1400U/g,配制成0.02g/mL脂肪酶液备用;正硅酸乙酯(TEOS),酒石酸,FeCl3·6H2O,FeSO4·7H2O,乙醇,氨水,γ-氨丙基三乙氧基硅烷(3-APTES),甲苯,丙酮,三羟甲基氨基甲烷(Tris,AR),戊二醛(25%),聚乙烯醇(PVA),95%乙醇等 均为国产分析纯。
JEOL-6380LV型扫描电子显微镜(scanning electron microscope,SEM) 日本电子公司;330FT-IR型傅里叶变换红外光谱(Fourier Transform Infrared Spectrometer,FTIR) 美国Nicolet Co。
1.2 载体制备
共沉淀法制备Fe3O4纳米粒子:在250mL三口烧瓶中分别加入100mL去离子水、0.01mol FeCl3·6H2O和0.005mol FeSO4·7H2O,在氮气保护下,升温至80℃,在转速500r/s条件下,加入10mL浓氨水溶液,继续搅拌反应30min后冷却至室温,用去离子水洗至中性。将得到的纳米粒子分散于50mL水中,加1mL酒石酸作为稳定剂,70℃下搅拌30min,得到Fe3O4纳米流体。
溶胶-凝胶法制备Fe3O4-SiO2磁性复合载体:取Fe3O4纳米流体10mL,加入含有10mL TEOS、10mL乙醇、10mL水、0.3mL氨水的混合物中,室温条件下控制转速500r/s,反应12h。
Fe3O4-SiO2磁性复合载体表面氨基化:在500mL圆底烧瓶中,加入100mL甲苯,3g干燥的磁性Fe3O4-SiO2纳米粒,超声处理10min后,加入10mL 3-APTES,在120℃油浴中连续磁力搅拌4h,甲苯和丙酮各洗涤3次,真空干燥,得到表面经氨基修饰后的磁性Fe3O4-SiO2纳米载体。
1.3 脂肪酶的固定化
在50mL锥形瓶中,加入0.05g氨基修饰的磁性Fe3O4-SiO2纳米载体,0.2mol/L pH7.5的磷酸盐缓冲溶液和一定浓度的戊二醛,放入100r/min转速的摇床,室温条件下反应12h,用去离子水充分洗涤,得到表面醛基化的磁性载体。在50mL锥形瓶中加入0.05g醛基化载体,10mL pH7.5磷酸盐缓冲溶液和0.02g/mL脂肪酶液10mL,在设定温度下,水浴摇床反应一定时间,离心后得固定化脂肪酶。
1.4 载体表征
1.4.1 载体粒径检测 用SEM检测载体的粒径,按文献[11]进行样品处理与测定。
1.4.2 载体表面氨基化程度检测 用FTIR检测载体表面氨基化程度,按文献[11]进行样品处理与测定。
1.5 蛋白固载率、酶活力及酶活回收率测定
蛋白固载率、酶活力及酶活回收率按文献[11]测定。
1.6 固定化酶的单因素实验
1.6.1 加酶量对固定化脂肪酶活力的影响 取浓度5%的戊二醛为交联剂,25℃下分别取0.02g/mL酶液2、4、6、8、10、12mL固定化4h。
1.6.2 戊二醛浓度对固定化脂肪酶活力的影响 取浓度分别为2%、4%、6%、8%、10%的戊二醛溶液10mL为交联剂,25℃下加10mL酶液固定化4h。
1.6.3 固定化时间对固定化脂肪酶活力的影响 取浓度为5%的戊二醛为交联剂,25℃下加入10mL酶液固定不同时间,分别为2、4、6、8、10h。
1.6.4 固定化温度对固定化脂肪酶活力的影响 取浓度为5%的戊二醛为交联剂,固定化温度分别为20、25、30、35、40、45℃时加入10mL酶液固定化4h。
1.7 固定化脂肪酶响应面实验
为了进一步提高固定化脂肪酶的效果以及对其重要影响因素在全局范围内进行优化,根据单因素实验结果选4h为最佳固定化时间,取其余三个因素作为Box-Benhnken 实验因素设计实验。
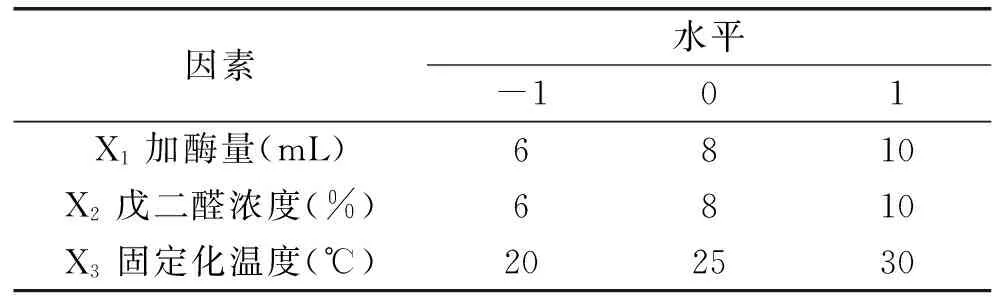
表1 Box-Benhnken 实验因素及其水平表Table 1 Factors and levels of the variables tested in Box-Benhnken design
2 结果与分析
2.1 载体粒径分析
通过扫描电镜观察Fe3O4-SiO2磁性复合载体的形态和大小。图1为Fe3O4-SiO2磁性复合载体的SEM照片,载体粒径较为均一,呈球状,各载体间分散性良好,载体平均粒径为300nm左右。

图1 磁性Fe3O4-SiO2复合载体SEM图Fig.1 SEM graph of compound magnetic Fe3O4-SiO2 carriers
2.2 载体表面氨基化程度分析
在FTIR下测定干燥的氨基化磁性复合Fe3O4-SiO2载体与未氨基化磁性复合Fe3O4-SiO2载体的各基团的特征吸收峰。对该图谱进行红外图谱[12]分析,可知-NH:1579cm-1,-NH弯曲振动;Si-O-R,1100cm-1,伸缩振动。所以说明SiO2已包覆到Fe3O4上,-NH键吸收峰说明氨基已加至载体表面,磁性复合载体表面氨基化良好。

图2 氨基化载体和未氨基化载体FTIR图Fig.2 Infrared spectrogram of silanized magnetic silica and magnetic silica
2.3 固定化酶的单因素实验
2.3.1 加酶量对固定化脂肪酶活力的影响 随加酶量增加,蛋白固载率也增加,但当加酶量达到10mL后,蛋白固载率维持不变。酶活回收率在加酶量达到8mL时达到最大值。说明虽然蛋白固载率增加,但酶活并没有随其明显增加。这是因为载体可固定的酶量是有限的。当加酶量浓度较低时,随着酶液浓度的增加,固定到载体上的酶量增加,活性也相应提高,但当酶液浓度过高时,酶分子相互聚集成团致使酶分子的活性中心互相遮盖,影响了酶与底物的结合,使酶活降低。

图3 加酶量对固定化脂肪酶活力的影响Fig.3 Effect of the amount of lipase enzyme on activity of immobilized lipase
2.3.2 戊二醛浓度对固定化脂肪酶活力的影响 戊二醛浓度升高蛋白固载率和酶活回收率均升高,在戊二醛浓度8%时蛋白固载率和酶活回收率均达到最大值,但随戊二醛浓度的进一步升高,蛋白固载率与酶活回收率均降低,说明过高浓度的戊二醛使部分酶蛋白失活。
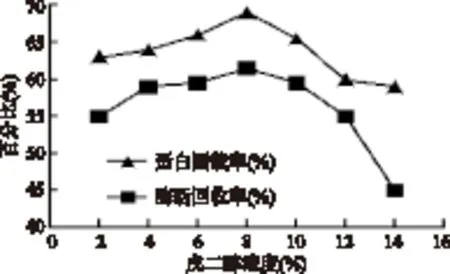
图4 戊二醛浓度对固定化脂肪酶活力的影响Fig.4 Effect of glutaraldehyde concentration on activity of immobilized lipase
2.3.3 固定化时间对固定化脂肪酶活力的影响 随固定化时间增加,蛋白固载率和酶活回收率都在4h后达到一个稳定值,继续延长固定化时间对增加酶活力影响不大,故后续实验中固定化时间取4h。
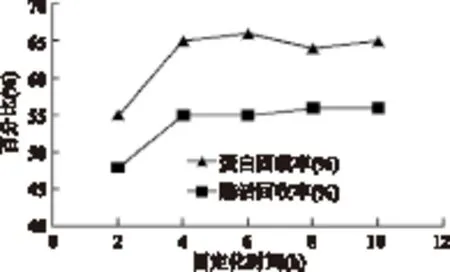
图5 固定化时间对固定化脂肪酶活力的影响Fig.5 Effect of the immobilized time on activity of immobilized lipase
2.3.4 固定化温度对固定化脂肪酶活力的影响 随固定化温度的升高,蛋白固载率与酶活回收率也升高,在25℃时,酶活回收率达到最大值,随温度升高,蛋白固载率在较小的范围内变动,但酶活回收率降低,说明该酶对温度比较敏感,虽然酶固定到了载体上,但有部分酶失活。
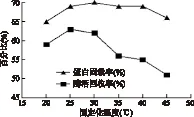
图6 固定化温度对固定化脂肪酶活力的影响Fig.6 Effect of the immobilized temperature on activity of immobilized lipase
2.4 固定化脂肪酶响应面实验
2.4.1 Box-Benhnken实验 Box-Benhnken实验设计及结果如表2所示。

表2 Box-Benhnken 实验设计及结果Table 2 Experimental design and results of Box-Benhnken design
2.4.2 方差分析及二次回归拟合 对表2的数据进行二次多项回归拟合,建立二次响应面回归模型,各因素经回归拟合后,解得回归方程为:
Y=3430.97+57.01X1+19.81X2-17.93X3+47.55X1X2+31.07X1X3-20.67X2X3-183.12X1X1-142.27X2X2-34.84X3X3
式中,Y为固定化酶活力,U/g;X1为加酶量,mL;X2为戊二醛浓度,%;X3为固定化温度,℃。
全模型的方差分析及显著性检验结果如表2所示,模型F值为13.23,整体模型的概率(Pr>F)值<0.01,表明该二次方程模型极显著,失拟项p=0.827>0.05,差异为不显著,说明模型拟合度好,实验误差较小,可以较好地预测固定化脂肪酶活力随各参数变化的规律。同时可以看出X1达到显著水平(Pr<0.05),X12和X22达到极显著水平(Pr<0.01)。通过方差分析结果可知,各因素影响固定化脂肪酶的酶活大小依次是加酶量(X1)>戊二醇浓度(X2)>固定化温度(X3)。

表3 全模型方差分析Table 3 ANOVA(Analysis of Variables)for master model
2.4.3 最佳条件的取得及实验验证 为了求得 X1、X2和X3的最佳取值,对所得的回归拟合方程分别对各自的变量求一阶偏导数,并令其为0,得到三元一次方程组,求解此方程组可以得出模型的极值点:X1=0.15,X2=0.10,X3=-0.22;即加酶量为8.30mL(酶量166mg)、戊二醛浓度为8.20%、固定化温度为24℃时,固定化脂肪酶的酶活达到最大值3440.64U/g。在确定的最优条件下进行重复的5次验证实验,固定脂肪酶的平均酶活为(3449±1.55)U/g,与模型预测值相差为0.28%,说明所建立的模型与实验结果相符,此时蛋白固载量为79.21%,酶活回收率为72.46%。
利用design-expert 8.0软件进行响应面分析,绘出各因素交互作用对酶活影响的响应面分析图和等高线如图7所示,每个响应面分析图分别代表着两个独立变量之间的相互作用,此时第三个变量保持在最佳水平。由响应面分析图可知响应变量Y有最大值,即X1、X2和X3存在极值点。
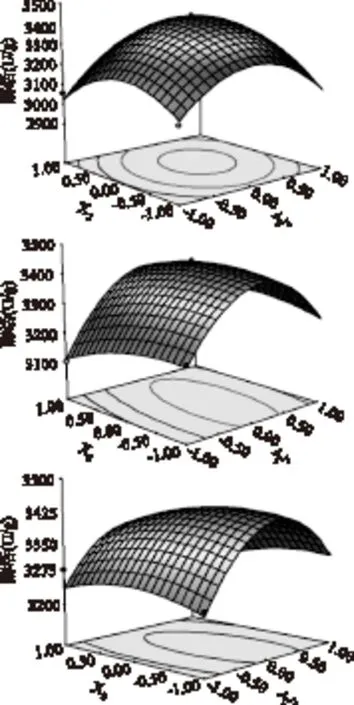
图7 各因素交互作用对酶活影响的 响应面分析图和等高线图Fig.7 Coutour map and reponse surface analysis graph about the influence of the interaction of various factors on enzyme activity
3 结论与讨论
制备的Fe3O4-SiO2磁性复合载体粒径较为均一,呈球状,分散性良好,载体平均粒径为300nm左右。
Fe3O4-SiO2载体固定化脂肪酶的最优条件:脂肪酶∶载体(g/g)=166∶50,戊二醛浓度8.20%,温度24℃条件下,固定化4h,固定化脂肪酶平均酶活3449U/g。
用磁性纳米Fe3O4-SiO2纳米粒子作为固定化脂肪酶的载体,有利于固定化脂肪酶从反应体系中分离和回收,操作简便;利用外部磁场可以控制磁性材料固定化酶的运动方式和方向,替代传统的机械搅拌方式,可减少酶活损失,从而提高固定化酶的使用效率。
[1]Ruiz C,Falcocchio S,Pastor F IJ,etal. Helicobacter pyloti EstV:Identification,cloning,and characterization of the first lipase isolated from anepsilonp rote bacterium[J]. Applied and Environmental Microbiology,2007,73(8):2423-2431.
[2]陈秀琳.脂肪酶固定化的研究概况[J].海峡药学,2007,19(12):114-116.
[3]Jascanu V,Stefoane D. Comparative effects ofinfluence of lipase,lipoxygenase and provaflor on the rheological characteristics of flour[J]. Acta Universitatis Cibiniensis Series E:Food Technology,2005,6(2):11-20.
[4]曹茜,冯凤琴.微生物脂肪酶的研究进展及其在食品中的应用[J].中国食品学报,2013(10):141-144.
[5]Hasan F,Shah AA,Hameed A. Industrial applications of microbial lipase[J]. Enzyme and Microbial Technology,2006,9:235-251.
[6]Deng Yonghui,Deng Chunhui,Deng Dawei,etal. Synthesis of Core/Shell Colloidal Magnetic ZeoliteMicrospheres for the Immobilization of Trypsin[J].Advanced Materials,2009,21:1337-1382.
[7]任广智,李振华,何炳林.磁性高分子微球用于固定化酶的研究进展[J].离子交换与吸附,2000,16(1):83-87.
[8]黄朋,向育君,周建红,等.磁性高分子微球合成及其固定化脂肪酶的研究[J].湖南科技大学学报:自然科学版,2008,23(4):94-98.
[9]王燕佳,蒋惠亮,方银军,等.磁性聚丙烯酰胺-丙烯酸共聚纳米粒子固定脂肪酶的研究[J].应用化工,2008,37(5):491-494.
[10]肖志红,吴红,李昌珠,等.磁性多孔微球固定化假丝酵母脂肪酶的研究[J].中国粮油学报,2013,28(12):68-73.
[11]冯超.磁性纳米载体的制备及其固定化脂肪酶催化性能研究[D].长沙:中南林业科技大学,2012.
[12]陈集,饶小桐,蒋晓慧.波谱分析[M].北京:电子科技大学出版社,2003,78.
Preparation for Fe3O4-SiO2carrier and optimization of the conditions for lipase immobilized
YI Xiao-sheng1,HU Tie2,FENG chao1,GU zheng-wei1,LI Ji-lie1,*,LI Chang-zhu3
(1.Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees(Central South University of Forestry and Technology),Ministry of Education,Changsha 410004,China;2.Guangzhou Maritime Institute,Guangzhou 510725,China;3.Hunan Academy of Forestry,Changsha 410004,China)
Through co-precipitation and sol-gel method,the Fe3O4-SiO2nanoparticles was prepared. The surface of Fe3O4-SiO2magnetic nanoparticles was modified with amino. Finally,the magnetic nano-composite carrier was obtained. The surface features of the carrier by Scanning electron microscope and Fourier Transform Infrared Spectrometer was described. Through the investigation of the effect of amount of enzyme,concentration of glutaraldehyde,immobilization time and temperature on protein solid load rate and lipase activity,the optimum conditions of lipase immobilization was obtained. Under the condition of the amount of lipase solution(0.02g/mL)was 8.30mL,the concentration of glutaraldehyde was 8.20%,the temperature was 24℃ and the immobilization time was 4h,the obtained immobilized lipase enzyme activity was 3449U/g.
magnetic nanometer composite carrier;Lipase;immobilization
2014-04-02
易笑生(1991-),男,硕士研究生,研究方向:农产品生物加工。
*通讯作者:黎继烈(1959-),女,博士,教授,研究方向:农产品生物加工。
国家科技支撑计划项目(2011BAD22B04)。
TS201.1
B
1002-0306(2015)01-0235-05
10.13386/j.issn1002-0306.2015.01.040
