五倍子单宁脂质体的制备及质量评价
2015-06-05吴晓霞李建科
吴晓霞,李建科
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
五倍子单宁脂质体的制备及质量评价
吴晓霞,李建科*
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
以超声波辅助溶剂提取法提取五倍子单宁,逆相蒸发法制备五倍子单宁脂质体,研究制备脂质体最佳工艺,并对在优化条件下制备的脂质体进行理化性质评价。结果表明优化条件为:卵磷脂与胆固醇的质量比(SPC/CH)为2∶1、有机相与水相体积比(O/A)为6∶1、缓冲液pH6.5。在此条件下质量浓度为1mg/mL的五倍子单宁溶液制备的五倍子单宁脂质体包封率为72.26%。结构描述:有效粒径为(79.39±11.62)nm,Zeta电位为-44.7mV,稳定性:4℃条件下储存稳定性良好。逆相蒸发法制备脂质体工艺简单可行,包封率高,粒度均匀,稳定性好,可用于五倍子单宁脂质体的制备。
五倍子单宁,脂质体,逆相蒸发法,质量评价
五倍子(GallaChinensis),又称文蛤、百虫仓、木附子,是由五倍子蚜虫寄生在漆树科植物盐肤木、青麸杨或红麸杨叶上形成的虫瘿[1],又称棓子。在我国,主产区集中在贵州、四川、湖北、湖南、陕西、云南等六省,这些省份的五倍子产量约占全国总产量的90 %以上[2]。五倍子单宁是五倍子的主要功能成分和含量最多的成分,五倍子单宁含量可达70%以上[3]。按照单宁的化学结构特征,单宁可分为如下:可水解单宁,缩合单宁和复合单宁[4],实验所用单宁为水解单宁,是由没食子酸、双倍酸与葡萄糖结合以甙或酯的形式形成的复杂混合物[5]。五倍子单宁不仅具有抗突变、抗肿瘤、抗菌、抗病毒、抗氧化等作用,还具有不同程度的抗过敏、降血脂、降血糖、抗炎、抗血栓、调节免疫等多种生物活性[3]。
脂质体是磷脂分散在水中自然形成多层囊泡,每层均为双分子层,囊泡中央和各层之间被水相隔开[6]。脂质体是由磷脂为膜材料及附加剂组成[7]。脂质体具有类似细胞膜的结构,内部含着一定体积的水溶液。脂质体的制备方法有很多种,主要有薄膜法、逆相蒸发法、注入法、冻融法、服乳法、pH梯度法和冷冻干燥法等[8]。逆相蒸发法适合包裹水溶性药物、大分子生物活性物质如各种抗生素、胰岛素、免疫球蛋白、碱性磷脂酶和核酸等。
用脂质体包裹药物可使药物选择性地分布于人体内某些组织和器官,避免药物氧化、降解和破坏,可增加药物通过细胞膜的能力,起到增强疗效的作用[9]。目前,关于多酚类物质制备脂质体的研究有石榴皮多酚脂质体[10]、茶多酚脂质体[10]等的研究,但没有关于五倍子单宁脂质体的研究,而五倍子在临床上有很重要的功效。因此,对五倍子单宁脂质体的研究具有重要的现实意义。
1 材料与方法
1.1 材料与仪器
五倍子单宁纯化物 实验室制备;五倍子单宁标品、大豆卵磷脂(SPC,soybean phospholipids)、胆固醇(CH,cholesterol) 西安市晶博生物技术有限公司;氯仿及其余试剂 为国产分析纯。
光学显微镜、紫外可见分光光度计(TU-1 810) 北京普析通用仪器有限责任公司;超高速低温离心机(3k30) 美国Sigma公司;精密微量移液器(100~1000μL) 德国Eppendorf;旋转蒸发器(RE-52AA) 上海亚荣生化仪器厂;激光粒度和Zeta电位仪(NANO-ZS) 英国Malvern公司;精密pH计(PHS-3C):上海精密科学仪器有限公司;漩涡混合器(XW-80A) 海门市其林贝尔仪器有限责任公司。
1.2 实验方法
1.2.1 五倍子单宁的提取及纯化 为陕西师范大学食品工程与营养科学学院营养与卫生实验室制备[11-12]。
1.2.2 五倍子单宁脂质体的制备 参考文献[13-15]。
1.2.2.1 五倍子单宁磷酸盐缓冲溶液的配制 称取100mg的五倍子单宁纯化物,用pH6.5磷酸缓冲液定容至100mL的棕色容量瓶中,即得质量浓度为1mg/mL的五倍子单宁磷酸盐缓冲溶液[10]。
1.2.2.2 五倍子单宁脂质体的制备工艺 采用逆相蒸发法制备五倍子单宁脂质体,研究在大豆卵磷脂和胆固醇的质量比为1∶1、2∶1、3∶1、4∶1、5∶1;有机相和水相的体积比1∶1、2∶1、3∶1、4∶1、5∶1;磷酸盐缓冲液的pH4.5、5.5、6.5、7.5、8.5时,以五倍子单宁脂质体的包封率为考察指标确定最佳制备工艺。
1.2.3 五倍子单宁脂质体包封率测定方法
1.2.3.1 标准曲线的建立 精密配制浓度分别为0、10、20、30、40、50μg/mL系列五倍子单宁溶液;以双蒸水为空白对照,在最佳波长处用紫外可见分光光度计测定吸光度值。以五倍子单宁浓度为横坐标,吸光度A值为纵坐标,绘制标准曲线,并进行回归分析。
1.2.3.2 五倍子单宁脂质体包封率的测定方法 参考文献[16-17],采用高速冷冻离心法测定包封率:取五倍子单宁脂质体及空白脂质体溶液各3mL于离心管中,分别加入乙酸乙酯3mL破乳,旋涡3min;于15000r/min转速、4℃温度条件下离心30min,取上清液1mL至25mL的容量瓶中,加入蒸馏水定容;空白脂质体作为对照,在最佳波长下测定吸光度;代入回归方程,得到总量Ct。
取五倍子单宁脂质体及空白脂质体溶液各3mL于离心管中,直接在15000r/min转速、4℃温度条件下离心30min,取上清液1mL至25mL的容量瓶中,空白脂质体作为对照,在最佳波长下测定吸光度。代入回归方程,得到未被包入即游离的脂质体量Cf。
得到总量和游离脂质体量,包封率便可求出:
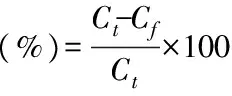
1.2.4 脂质体的质量评价 鉴于脂质体在各个领域的应用原理,一般采用3个参数来评价脂质体的性质:脂质体的大小、包封率和脂质体的稳定性[6]。
脂质体的大小:采用扫描电镜、激光散射法或激光扫描法测定。
包封率(%)=(脂质体中包封的药物/脂质体中药物总量)×100。
脂质体稳定性:也是衡量脂质体特性的主要指标之一。它反映了脂质体溶液包封率随时间变化的情况。主要用渗漏率表示,渗漏率(%)=(放置前介质中药物量-放置后介质中的药量)/制剂中药量×100。
1.2.4.1 五倍子单宁脂质体外观检验 光学显微镜下观察:将五倍子单宁脂质体溶液稀释100倍后,滴1滴于载玻片上,在光学显微镜下观察脂质体外观形态并拍照记录。
1.2.4.2 五倍子单宁脂质体粒度测定及Zeta电位测定 将五倍子单宁脂质体用双蒸水稀释100倍,再用水系0.45μm滤膜过滤,用激光粒度和Zeta电位仪测定脂质体的粒径大小、粒径分布及电势大小。
1.2.4.3 五倍子单宁稳定性研究 脂质体属于胶体分散体系,是热力学不稳定体系。它在存放过程中会发生物理、化学、生物等方面的变化,从而影响其稳定性能。本实验在 4℃与常温条件下分别将五倍子单宁脂质体放置0、10、20、30、40、50和60d,按1.2.2.3方法测定包封率(Y)的变化。
1.2.5 数据处理 采用DPS3.01数据处理软件处理数据。
2 结果与分析
2.1 五倍子单宁脂质体包封率测定
2.1.1 五倍子单宁溶液及空白脂质体波长扫描 对空白脂质体和五倍子单宁溶液分别在190~600nm处进行全波长扫描。波长扫描结果如图所示:
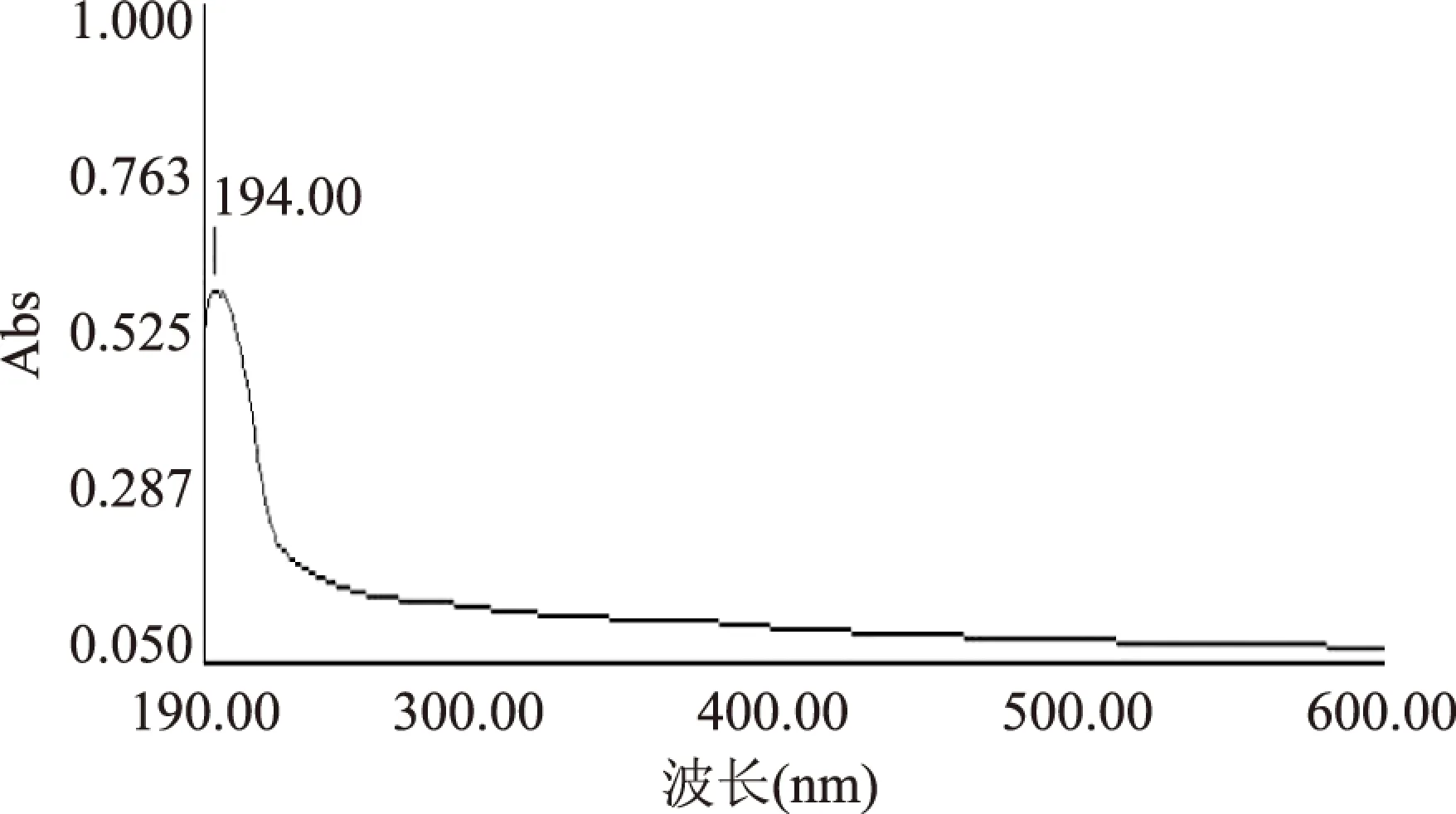
图1 空白脂质体波长扫描结果Fig.1 Scanning spectra of blank liposome
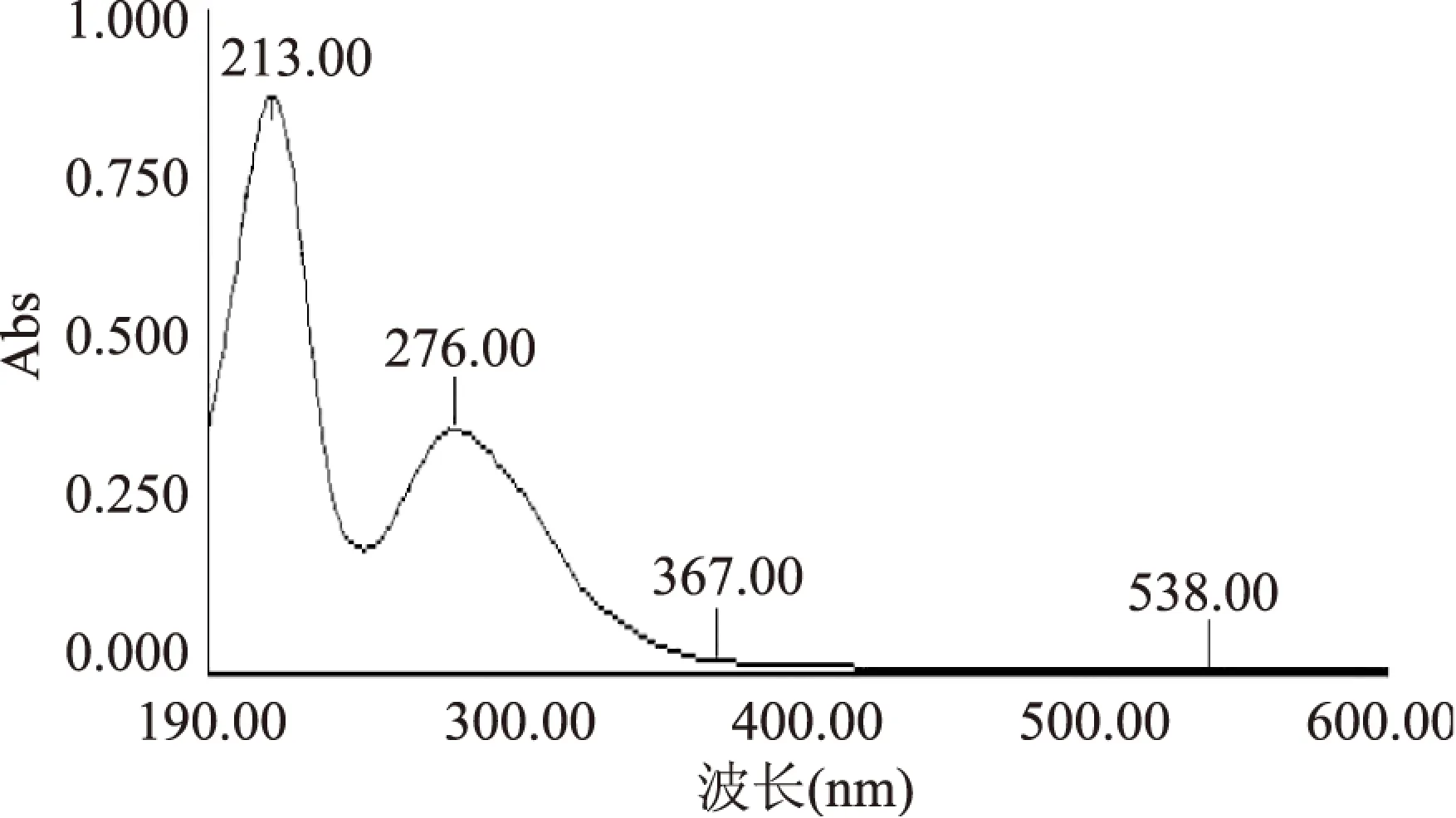
图2 五倍子单宁溶液波长扫描结果Fig.2 Scanning spectra of gallnut tannins
由图1、图2可知,空白脂质体在194nm左右有吸收峰,而五倍子单宁有两个大的吸收峰,分别是213nm和276nm。考虑到空白脂质体在213nm处也有较大吸收值,而在276nm处基本无吸收值,因此选择276nm为测量五倍子单宁含量的最佳波长。
2.1.2 五倍子单宁溶液标准曲线的建立 五倍子单宁溶液标准曲线如图3所示,以五倍子单宁溶液的质量浓度C(μg/mL)为横坐标,吸光度值A为纵坐标,得到线性回归方程为y=0.0291x-0.001,相关系数R2=0.9993,五倍子单宁溶液质量浓度在0~50μg/mL范围内与吸光值有良好的线性关系。
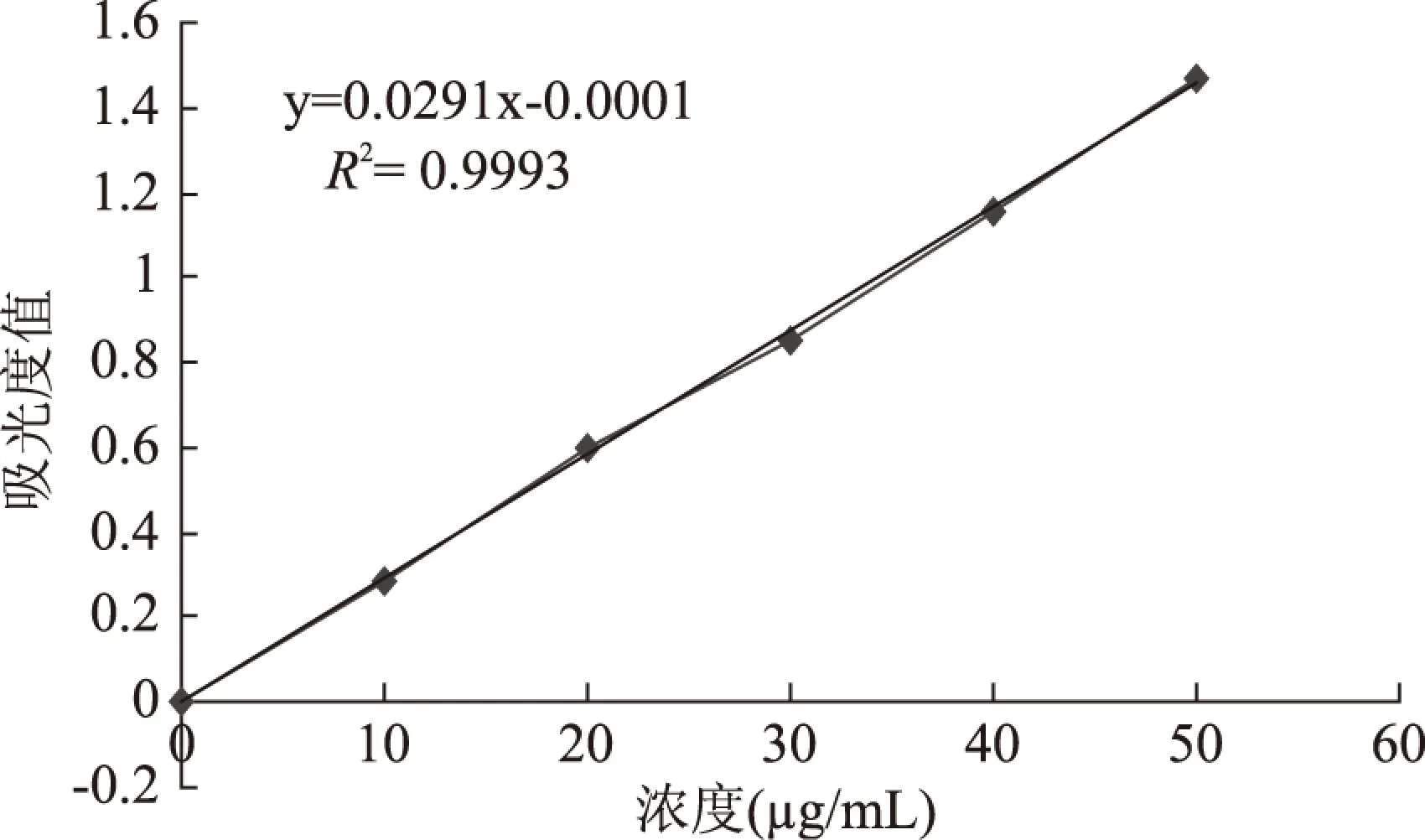
图3 五倍子单宁标准曲线Fig.3 Standard curve of gallnut tannins
2.2 五倍子单宁脂质体制备的单因素实验结果
2.2.1 大豆卵磷脂和胆固醇的质量比对五倍子单宁脂质体包封率的影响 有机相和水相的体积比5∶1、磷酸盐缓冲液的pH6.5,考察大豆卵磷脂和胆固醇的不同质量比对五倍子单宁脂质体包封率的影响情况。

图4 大豆卵磷脂与胆固醇的质量比 对脂质体包封率的影响Fig.4 Effect of the ratio of soybean phospholipids to choleste on encapsulation
由图4可见,大豆卵磷脂和胆固醇的质量比对包封率有显著的影响。随着卵磷脂比例的增大,包封率也随着增大,这是因为作为类脂膜重要组成部分的胆固醇,它具有调节膜流动性和稳定磷脂双分子层的作用,当比例过大时,包封率也随之降低,这是因为组成脂质体的胆固醇量太少,膜难以形成且不牢固。所以,在大豆卵磷脂和胆固醇的质量比为2∶1时,它们之间有良好的协同作用,包封率达到最大68.94%。
2.2.2 有机相和水相的体积比对五倍子单宁脂质体包封率的影响 磷酸盐缓冲液的pH6.5和大豆卵磷脂与胆固醇的质量比2∶1,考察有机相/水相不同体积比对五倍子单宁脂质体包封率的影响情况。
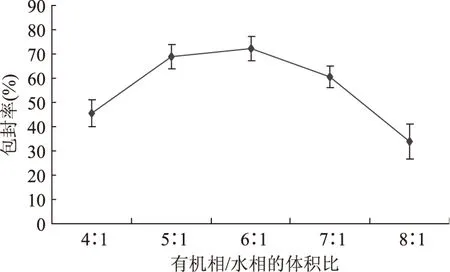
图5 有机相/水相的体积比对脂质体包封率的影响Fig.5 Effect of the ratio of oil phase to aqueous phase on encapsulation
由图5可见,五倍子单宁脂质体的包封率随着有机相/水相的体积比增加,包封率呈现增加的趋势。当有机相/水相的体积比值增加到6∶1时,包封率达到最大72.26%。
2.2.3 磷酸缓冲液pH对五倍子单宁脂质体包封率的影响 大豆卵磷脂与胆固醇的质量比2∶1与有机相/水相的体积比6∶1,考察不同pH条件下对五倍子单宁脂质体包封率的影响情况。
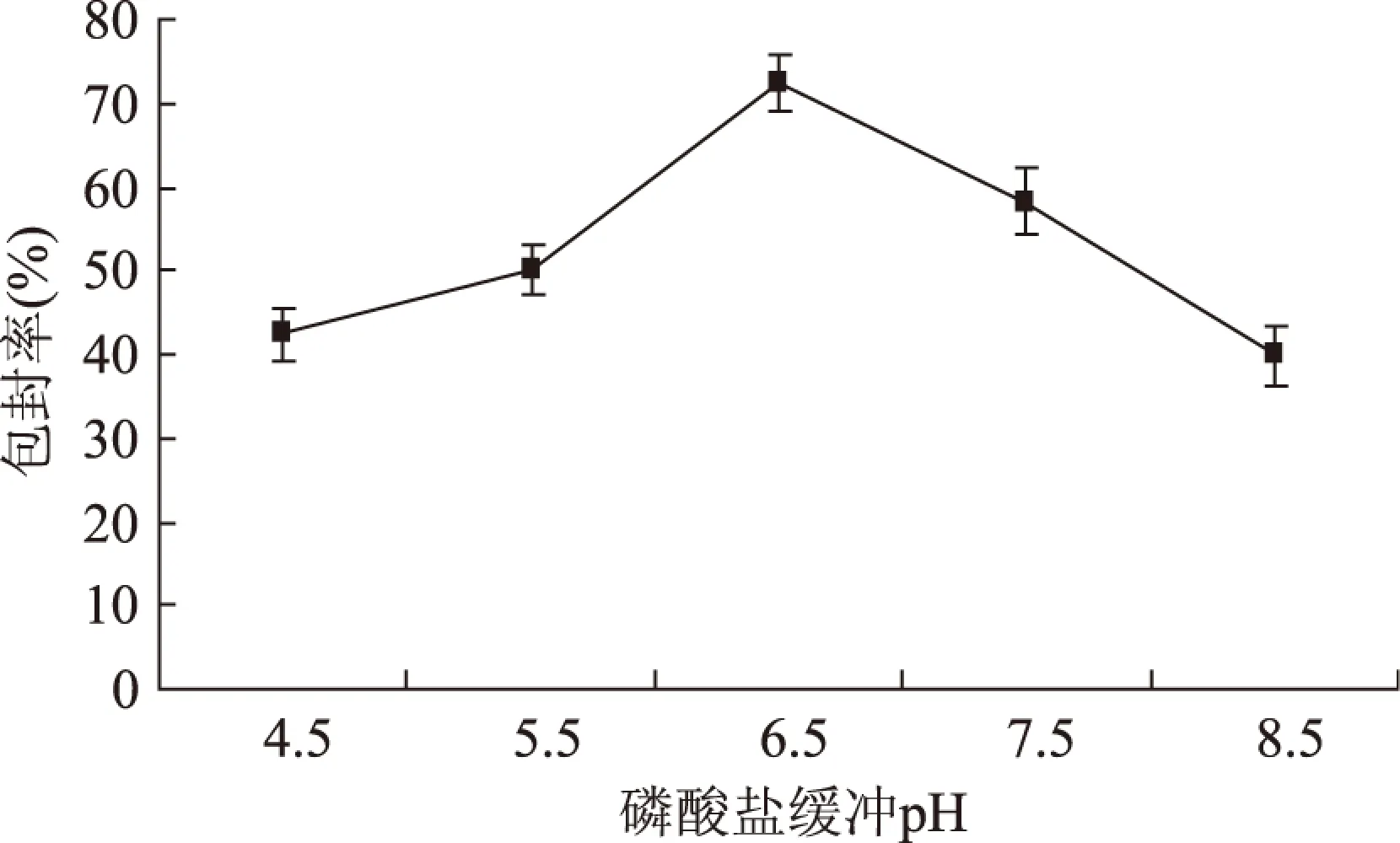
图6 磷酸盐缓冲液的pH对脂质体包封率的影响Fig.6 Effect of the pH of phosphate buffer solution on encapsulation
由图6可见,五倍子单宁脂质体的包封率随着磷酸盐缓冲液pH的增加而增加,当pH增加到6.5时,达到最大,之后随着磷酸盐缓冲液pH的增加包封率反而变小。因此,本实验中磷酸盐缓冲液最佳的pH为6.5。
制备五倍子单宁脂质体的最佳条件为:大豆卵磷脂与胆固醇的质量比为2∶1,有机相/水相的体积为6∶1,磷酸盐缓冲液的pH为6.5。在此条件下制备的五倍子单宁脂质体的包封率达72.26%。
2.3 五倍子单宁脂质体质量评价
肉眼观察下五倍子单宁纯化物呈淡黄色粉状,五倍子单宁磷酸盐缓冲液为淡黄色,脂质体溶液为乳白色乳浊液。
2.3.1 五倍子单宁脂质体的显微形态结构 图7为五倍子单宁脂质体的光学显微镜照片。从图7中可知,脂质体呈椭球形和圆球状,分布均匀。
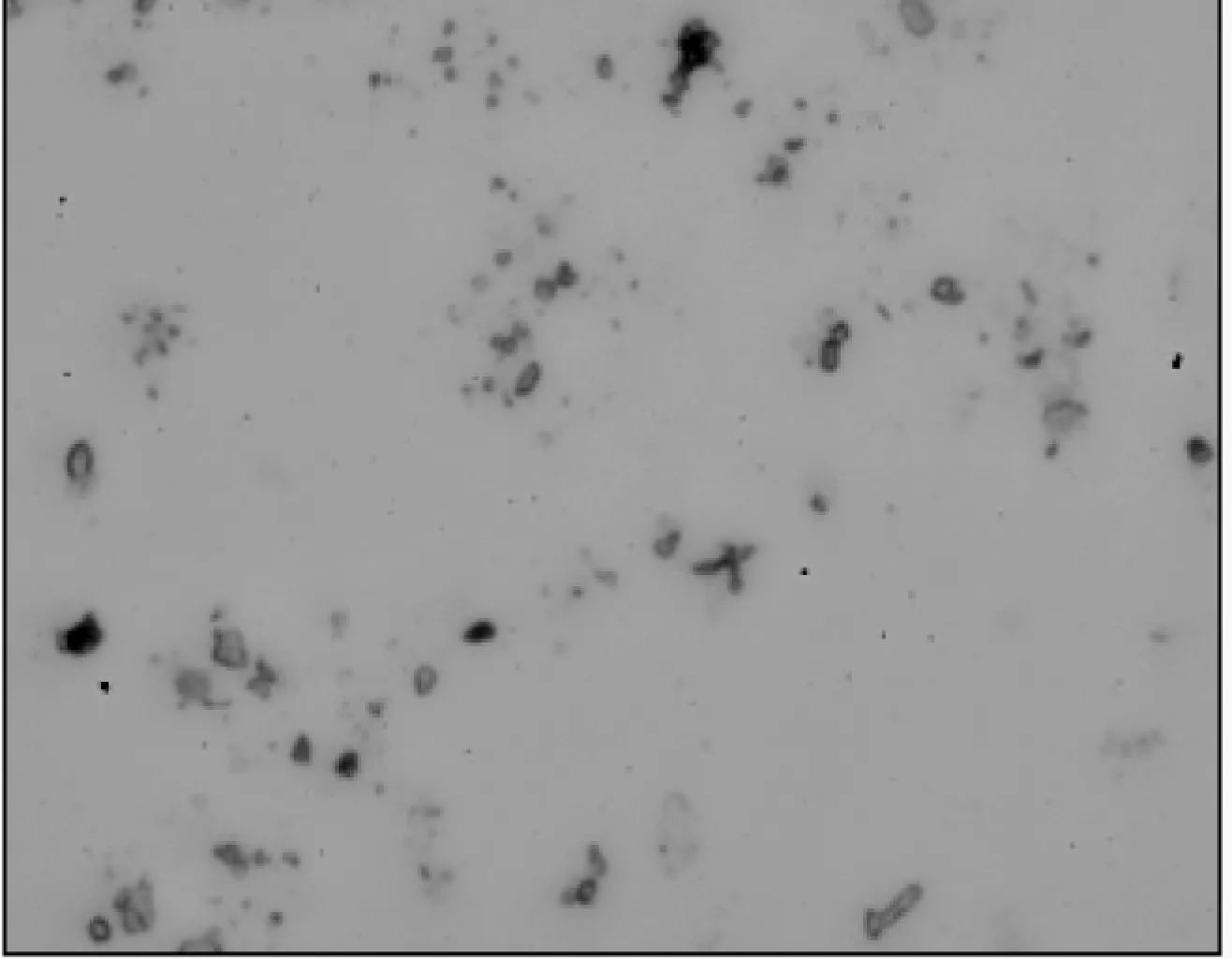
图7 光学显微镜下五倍子单宁脂质体图片(×40)Fig.7 Optical microscope picture of gallnut tannins liposome(×40)
2.3.2 五倍子单宁脂质体粒度测定及Zeta电位测定 五倍子单宁脂质体经激光粒度和Zeta电位仪测定后,粒径大小、分布及电荷性质分别见图8和图9。
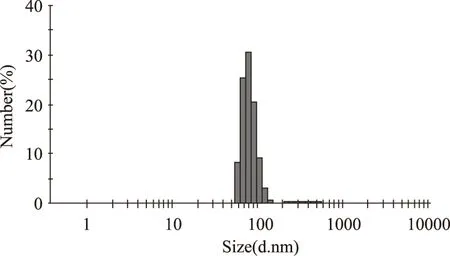
图8 五倍子单宁脂质体粒径分布Fig.8 Particle size distribution of gallnut tannins liposome
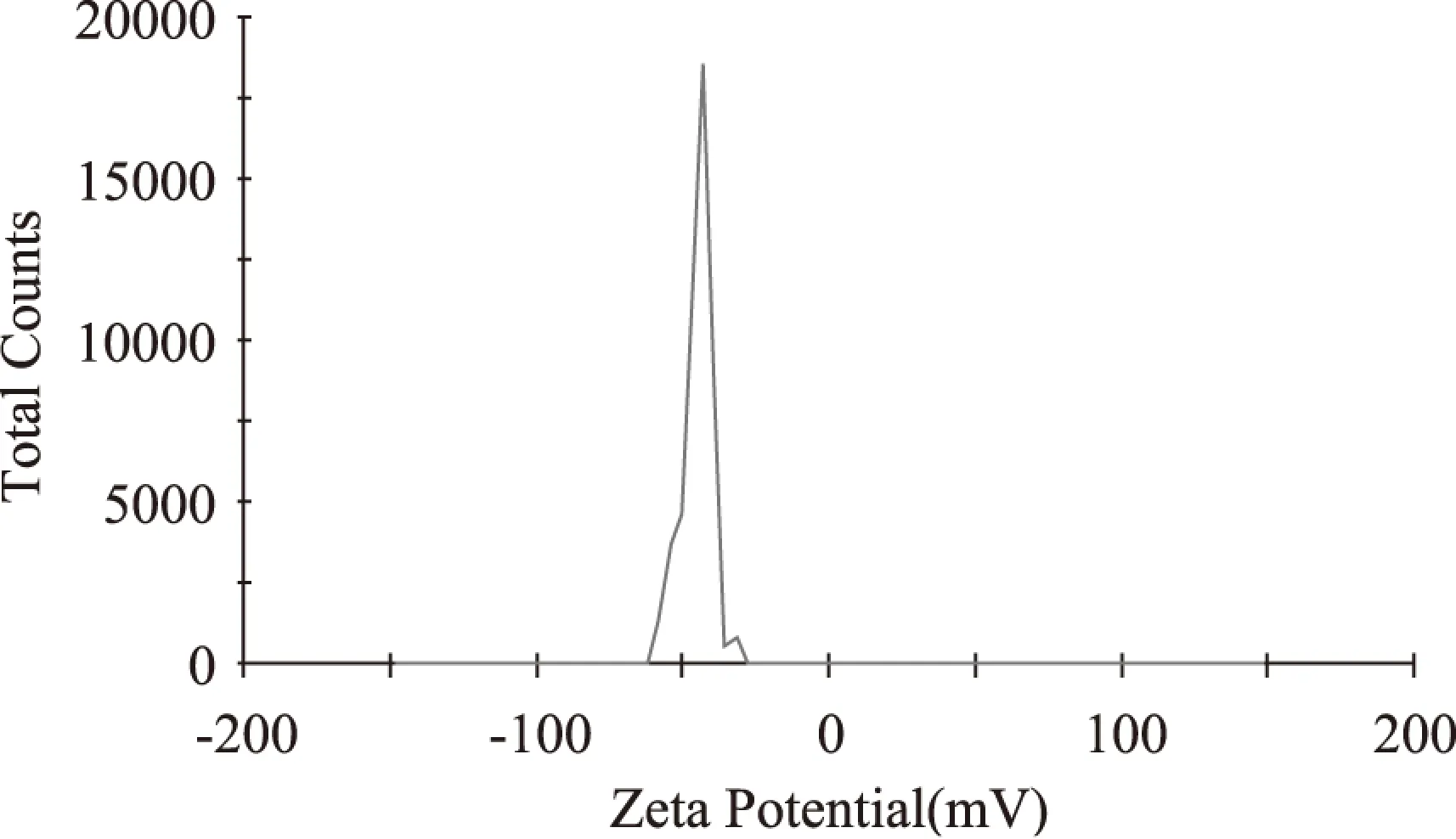
图9 五倍子单宁脂质体Zeta 电位Fig.9 Zeta potential of gallnut tannins liposome
由图8可知,五倍子单宁脂质体的粒径呈正态分布,有效粒径为(79.39±11.62)nm,分散系数(Pdi)为0.407,说明粒径分布较均匀。
由图9可知,五倍子单宁脂质体电位为-44.7mv,此电位处于-30~-50mv范围内,说明该脂质体表面带负电荷,且体系比较稳定。
2.3.3 五倍子单宁脂质体稳定性 以时间为横坐标,包封率为纵坐标,绘图得五倍子单宁脂质体稳定性随时间的变化结果(图10)。
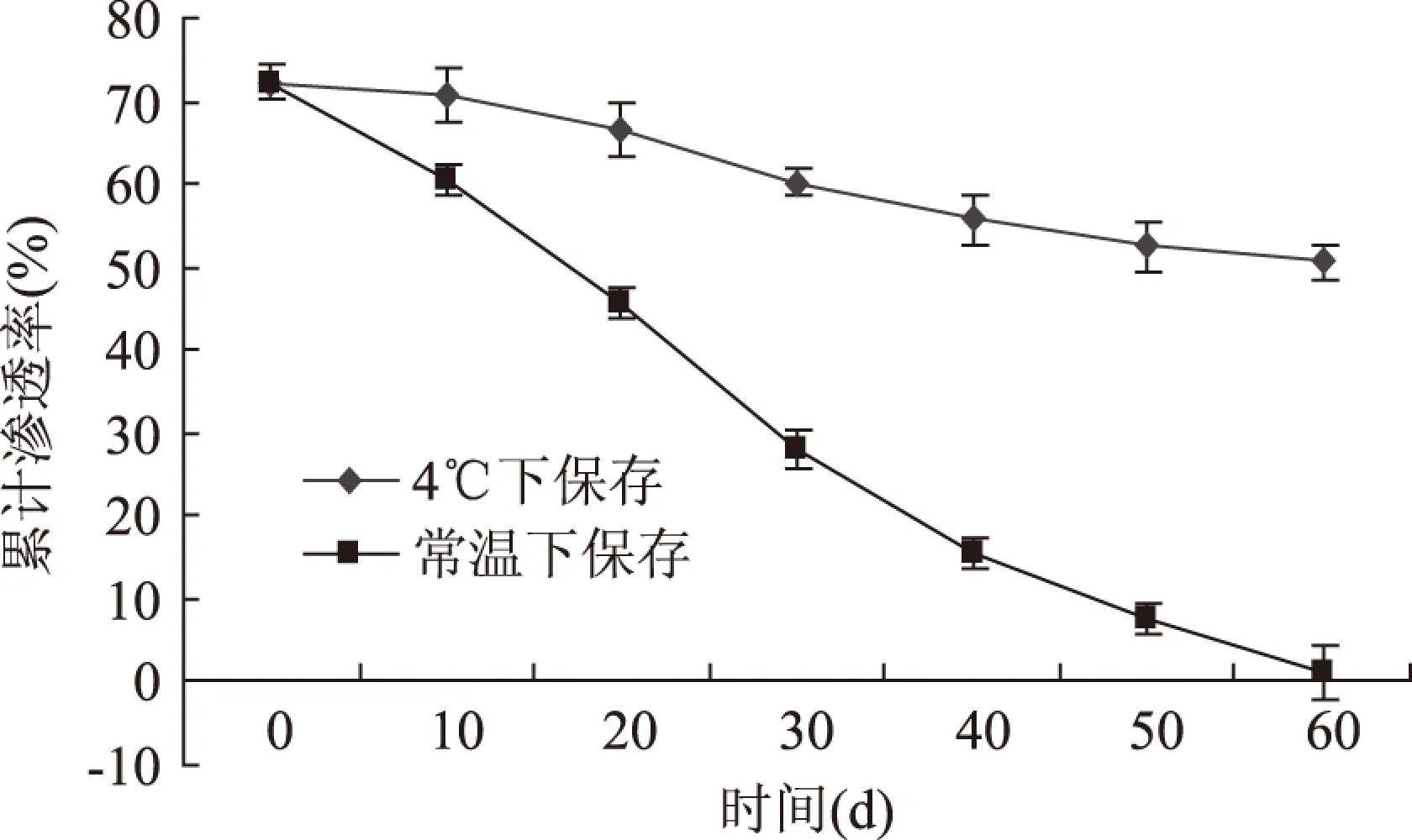
图10 五倍子单宁脂质体稳定性曲线Fig.10 Leakage rate curve of gallnut tannins and its liposome
由图10可知,五倍子单宁脂质体在4 ℃条件下储存稳定性良好,前20d包封率基本没有变化,也就是说,脂质体中的五倍子单宁在储存的过程中基本没有渗漏,随着时间的延长,包封率呈缓慢下降趋势,60d之内,包封率共下降20.05%,而外观上脂质体溶液也基本无絮凝和沉淀现象。但在常温下放置的脂质体包封率逐渐下降,并出现了不同程度的絮凝和沉淀,而且略有发霉现象,60d后被包裹的五倍子单宁已基本完全渗漏,因此五倍子单宁脂质体宜在4℃条件下储存。
3 结论
逆相蒸发法制备五倍子单宁脂质体简单可行,最佳工艺配方为:SPC/CH为2∶1,O/A值为6∶1,缓冲液pH为6.5。在此条件下质量浓度为1mg/mL的五倍子单宁溶液制备的五倍子单宁脂质体包封率为72.26%。
肉眼观察下五倍子单宁呈淡黄色粉状;五倍子单宁磷酸盐缓冲液为淡黄色;脂质体溶液呈乳白色。从五倍子单宁脂质体的光学显微电镜可知,脂质体呈椭球形和圆球状,分布均匀。五倍子单宁脂质体的粒径呈正态分布,有效粒径为(79.39±11.62)nm,分散系数(Pdi)为0.407,粒径分布较均匀。五倍子单宁脂质体电位为-44.7mv,表面带负电荷,体系比较稳定。五倍子单宁脂质体适宜的保存温度为4℃。
[1]姜创,吴相,刘军海.超声辅助法提取五倍子单宁酸的工艺研究[J].食品与发酵科技,2009,45(2):11-13.
[2]郑止善. 五倍子[M].上海:正中书局,1948:29-30.
[3]江凯. 五倍子单宁提取纯化和抗突变作用研究[D].西安:陕西师范大学,2011.
[4]何兰,姜志宏.天然产物资源化学[M].北京:科学出版社,2008:465-495.
[5]乔彩云,李建科.五倍子及五倍子单宁的研究进展[J].食品工业科技,2010,32(7):458-462.
[6]高晶,黄少烈.脂质体的制备方法及其比较[J].中国油脂,2009(10):52-54.
[7]陈婷婷,曹光群.维生素C脂质体的研究[D]. 无锡:江南大学,2008.
[8]王汝兴,张宇丽.脂质体的研究进展及其制备方法[J].承德医学院学报,2008,25(2):183-185.
[9]王志龙,赵云英,李富桂.脂质体应用的研究进展[J].黑龙江畜牧兽医科技版,2011,5:26-27.
[10]李鹏.石榴皮多酚脂质体的制备及质量评价[D].西安:陕西师范大学,2010.
[11]陈大全,王昌利,王剑波,等.正交实验优选元宝枫果壳中鞣质的提取工艺研究[J].中草药,2006,37(12):1816-1817.
[12]黄秋森.有机溶剂提取萃取法生产茶多酚工业实验[J].
现代化工,2006,26(9):48-51.
[13]任文霞,李建科.茶多酚脂质体的制备[J].食品工业科技,2008(11):187-191.
[14]Yechezkel B.Liposome application:problems and prospects[J].Current Opinion in Colloid & Interface Science,2001,6(1):66-77.
[15]Fang Tian,Bo Li,Baoping Ji,etal. Identification and structure-activity relationship of gallotannins separated from Galla chinensis[J]. LWT-Food Science and Technology,2009,42(7):1289-1295.
[16]任文霞,李建科.冻干茶多酚脂质体的制备及其质量[J].中国生物制品学杂志,2009(6):609-612.
[17]任文霞,李建科.逆相蒸发法制备茶多酚脂质体及质量评价[J].生物加工过程,2009,7:2:68-73.
Preparation of gallnut tannins liposome and its quality evaluation
WU Xiao-xia,LI Jian-ke*
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710062,China)
Ultrasonic solvent extraction was used to eatarct the tannins in gallnut,and reverse-phase evaluation was used to prepare liposomes of gallnut tannins.The best technology was obtained and its physical and chemical properties were evaluated. The results showed that when the SPC/CH was 2∶1,the O/A was 6∶1,and the pH was 6.5,the entrapment efficiency of liposomes prepared by gallnut tannins was 72.26%,the effective diameter was(79.39±11.62)nm and the zeta potential was-44.7 mV,the favorable storage temperature was 4℃. Preparation process of liposome using reverse-phase evaporation was simple and feasible,high encapsulation efficiency,particle size uniformity,stability and can be used for preparation of gallnut tannins liposome.
gallnut tannins;liposomes;reverse-phase evaporation;quality evaluation
2014-03-21
吴晓霞(1982-),女,在读博士,实验师,研究方向:食品营养与安全。
*通讯作者:李建科(1960-),男,博士,教授,研究方向:食品安全与天然产物分离鉴定。
国家自然科学基金(31301598);陕西省自然科学基金(2012JQ3014);陕西师范大学中央高校基本科研项目(GK 201304007)。
TS201.1
A
1002-0306(2015)03-0074-05
10.13386/j.issn1002-0306.2015.03.006
