静电纺丝构建胶原-透明质酸钠-硫酸软骨素组织工程关节软骨支架的工艺探索*
2015-06-01杨泽龙陈竹冯刚
杨泽龙 陈竹 冯刚*
静电纺丝构建胶原-透明质酸钠-硫酸软骨素组织工程关节软骨支架的工艺探索*
杨泽龙 陈竹 冯刚*
目的 探索以胶原、透明质酸钠和硫酸软骨素三种细胞外基质为原料,利用静电纺丝技术构建组织工程关节软骨支架的工艺。方法 固定静电纺丝的参数,通过改变溶剂的种类,浓度和三种原料之间的比例,探索胶原-透明质酸钠-硫酸软骨素复合支架的纺丝条件。结果 胶原-透明质酸钠-硫酸软骨素复合支架纺丝的最佳溶剂是3-氟乙醇和水的混合溶剂 (v:v,1:1),最佳纺丝浓度范围为80~120mg/mL,三种原料支架的最佳比例范围为6~8:1:1~2。支架纤维的直径和孔隙率则由原料的浓度和比例共同决定;支架降解性能良好,降解速度主要由胶原含量决定。结论 研究者成功的利用静电纺丝技术构建了胶原-透明质酸钠-硫酸软骨素复合组织工程软骨支架。这种支架在成分和形态上都可以较好的模拟关节软骨细胞外环境,是一种具有良好应用前景的组织工程关节软骨支架。
胶原;透明质酸钠;硫酸软骨素;静电纺丝;组织工程关节软骨支架
组织工程软骨是一种有望从根本上解决关节软骨损伤的治疗方法,而实现这一目标的关键技术之一在于如何构建出具有良好生物学和力学性能的支架。胶原 (Collagen,COL )、透明质酸钠(Hyaluronicacid,HA)和硫酸软骨素(Chondroitin sulfate,CS)三种天然生物材料均是软骨细胞外基质,具有优异的生物相容性和低抗原性。近年来,这类材料被研究者广泛地应用于构建组织工程支架[1,2]。目前,利用这三种原料构建组织工程支架主要是通过低温冷冻干燥法[3,4],利用静电纺丝工艺构建组织工程支架的研究较少报道。本文拟对静电纺丝构建胶原-透明质酸钠-硫酸软骨素复合组织工程支架的工艺进行探索。
1 材料与方法
1.1 材料与仪器
Ⅰ型胶原 (Mw=250KDa,四川铭让)、透明质酸钠 (鸡冠,阿拉丁)、硫酸软骨素(鲨鱼,Sigma)。其他各种试剂均为市售分析纯试剂。高压电源(DW-P503-1AC,天津东文)、恒流注射泵(LSP01-1A,保定兰格)、扫描电子显微镜(QUANTA 2000型,荷兰FEI)。
1.2 实验方法
1.2.1 支架材料的制备
静电纺丝采用铜板接收,纺丝电压为15Kv,接收速度为15mL/h,接收距离为15cm。
(1)胶原静电纺丝支架的制备:选择N,N-二甲基甲酰胺、6-氟异丙醇和3-氟乙醇三种有机溶剂分别作为胶原静电纺丝的溶剂。称取一定量的胶原分别溶解在三种有机溶剂中配制不同浓度的溶液,室温下磁力搅拌均匀后进行静电纺丝。
(2)胶原-透明质酸钠静电纺丝支架的制备:去离子水与N,N-二甲基甲酰胺、6-氟异丙醇和3-氟乙醇三种有机溶剂均按照体积比1:1的比例配制混合溶剂。称取一定量的胶原、透明质酸钠同时溶解在混合溶剂中,室温下磁力搅拌均匀配制不同浓度的电纺液,进行静电纺丝,考察不同浓度电纺液对支架性能的影响;同时改变胶原、透明质酸钠的质量比,考察胶原、透明质酸钠不同质量比对静电纺丝制备的支架性能的影响。
(3)胶原-透明质酸钠-硫酸软骨素静电纺丝支架的制备:去离子水和3-氟乙醇按照体积比1:1配制混合溶剂,分别称取一定质量的胶原、透明质酸钠和硫酸软骨素同时溶解在混合溶剂中,室温下磁力搅拌均匀配制不同浓度的电纺液,进行静电纺丝,考察不同浓度的电纺液对支架的性能的影响;同时改变三者之间的质量比,考察三者之间不同比例对静电纺丝制备的支架材料的影响。
1.2.2 支架材料的表征
(1)支架的形貌:纺丝时,用载玻片接收部分纤维,置于光镜下,观察纤维的形貌;纤维薄膜于真空干燥箱,真空度-0.1MPa,室温干燥3天后,收集纤维膜扫描电镜观察支架的形貌。
(2)支架的直径:每组样品随机选取10个标本,每个标本在扫描电镜10000倍镜头下分别选取2个不同部位拍照,利用Image-Pro Plus 6.0专业图像分析软件,随机测定每个图片内20根纤维直径,再用SPSS 18软件计算出纤维的平均直径及标准差。
(3)支架孔隙率:以无水乙醇为介质,用密度法测定样品的孔隙率,测试过程如下:a得多孔支架的干态质量 (m1)以及表观体积 (V);b将密度瓶装满无水乙醇,测量其质量(m2);c将支架放入密度瓶中,擦干溢出的乙醇,并放置至表面剩余乙醇挥发,测量其质量(m3);支架密度按照公式计算:

(4)支架材料的降解性能:取电纺液浓度为10%的三种不同成分比例的样品称重后(W1),浸于PBS后置于37℃培养箱中,在不同时间点取出 (3、7、14、21、30、45天),每个时间点3个样本,真空干燥至恒重后称重得W2,按以下
公式计算降解率:降解率=(W1-W2)/W1×100%。得出材料在PBS中的降解率。
1.3 统计学分析
实验所有计量资料均采用SPSS13.0统计软件进行分析,实验结果以均数±标准差±s)表示。
2 结果
2.1 胶原纺丝结果
研究者利用单纯的胶原纺丝,分别考察了不同溶剂和不同胶原浓度对纺丝结果的影响。从表1中可以看出,研究所涉及的三种可溶解胶原的有机溶剂均可纺丝。胶原浓度是胶原纺丝的关键,如表1所示,当胶原浓度低于40mg/mL时,溶液浓度过低,液体呈喷雾状,无法纺丝;最佳纺丝浓度为80~100mg/mL,此时胶原纺丝所得纤维形貌良好,直径均匀;当胶原浓度高于100mg/mL时,溶液浓度过大,堵塞针头,无法纺丝。
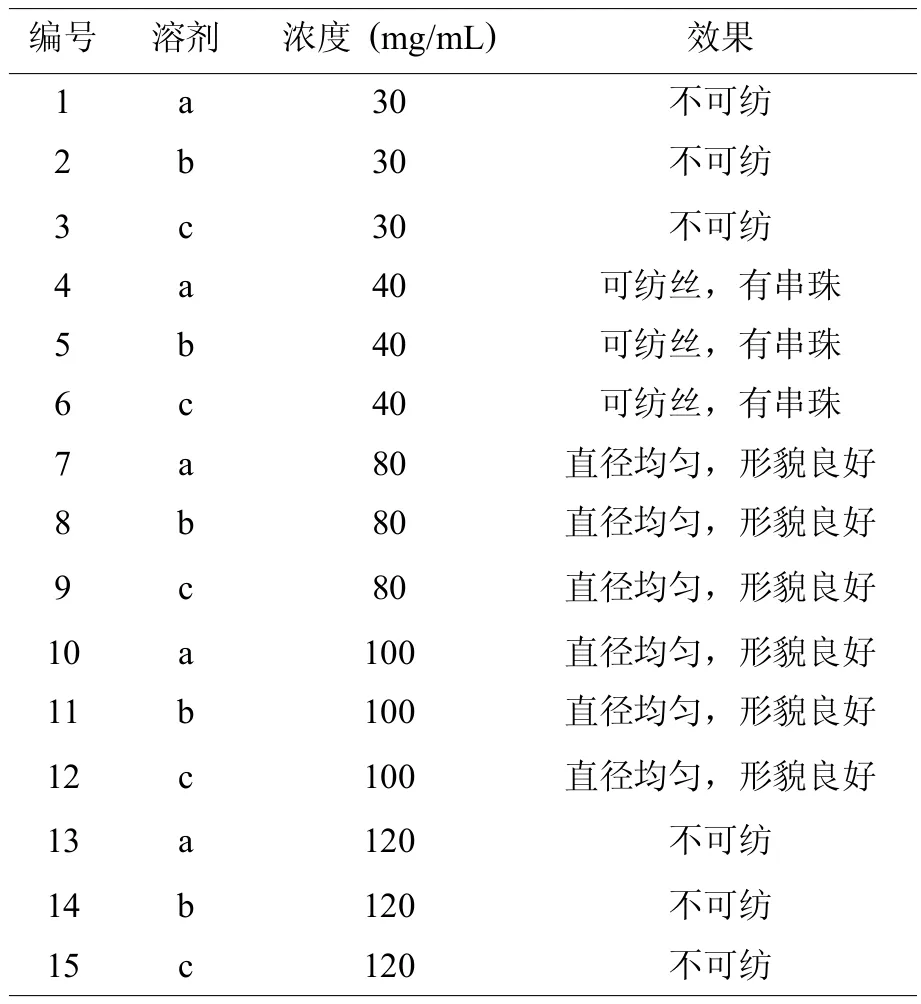
表1 ColⅠ纺丝条件探索
2.2 胶原-透明质酸钠纺丝结果
当胶原和透明质酸钠混合纺丝时,需要考虑两种不同成分的溶解性能。由于透明质酸钠不溶于绝大部分有机溶剂,因此研究者选择将水与有机溶剂混合,制备可同时溶解胶原和透明质酸钠的混合溶剂。如表2所示,研究选择的三种溶剂分别是N,N-二甲基甲酰胺:水 (1:1,v:v)、6-氟异丙醇:水 (1:1,v:v)和3-氟乙醇:水 (1:1,v:v)。从表2中可见,三种溶剂中仅溶剂3-氟乙醇:水 (1:1,v:v)可纺丝,纺丝浓度范围为80~120mg/mL,COL与HA比例范围为4~8:1。
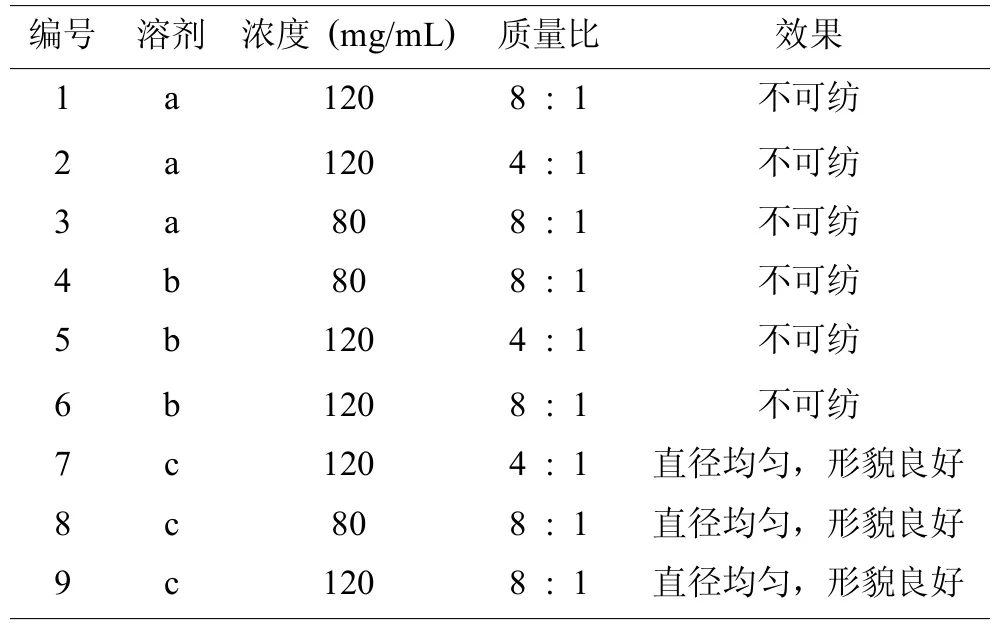
表2 ColⅠ-HA纺丝条件探索
2.3 胶原-透明质酸钠-硫酸软骨素纺丝结果
当胶原-透明质酸钠纺丝可获得形貌良好,直径均一的纤维时,研究者在原料中添加硫酸软骨素,制备三种原料的复合支架材料(图1)。从表3中可以看出,纺丝的最佳浓度范围为80~120mg/mL。超出了单纯的胶原纺丝时的最高浓度100mg/mL,研究者分析,单纯胶原纺丝时使用的溶剂为单纯的有机溶剂,而此时为3-氟乙醇和水的混合溶剂,水的加入改变了溶剂的导电性和溶解性能,从而导致的纺丝浓度范围的变化[5,6]。同时表3可见,三种原料支架的最佳比例为6~8:1:1~2。

图1 胶原-透明质酸钠-硫酸软骨素复合支架形貌图。1光镜下的纤维形貌(400×);2扫描电镜下纤维的形貌(5000×);A浓度:80mg/mL;COL:HA:CS 8:1:2;B浓度:80mg/mL;COL:HA:CS 6:1:1;C浓度:80mg/mL;COL:HA:CS 6:1:2;D浓度:100mg/mL;COL: HA:CS 8:1:2;E浓度:120mg/mL;COL:HA:CS 8:1:2
支架纤维的直径和孔隙率由原料的浓度和比例所决定。溶液浓度增加,纤维支架的直径增加,孔隙率下降;当胶原浓度固定时,透明质酸钠和硫酸软骨素的浓度增加,则纤维的直径增加,孔隙率下降;当透明质酸钠和硫酸软骨素浓度固定时,胶原的浓度增加,则纤维直径下降,孔隙率增加(图2)。
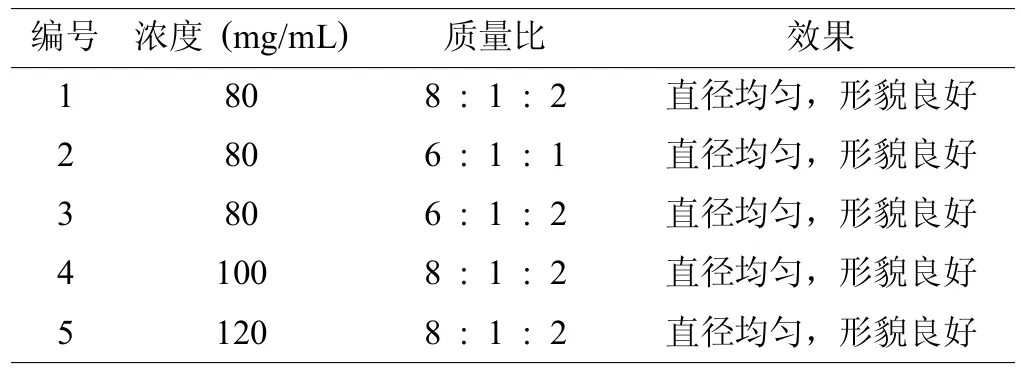
表3 ColⅠ-HA-CS纺丝条件探索
注:溶剂3-氟乙醇:水1:1(v:v)。

图2 纤维支架的直径和孔隙率。A浓度:80mg/mL;COL:HA:CS 8 :1:2;B浓度:80mg/mL;COL:HA:CS 6:1:1;C浓度:80mg/mL;COL:HA:CS 6:1:2;D浓度:100mg/mL;COL:HA:CS 8:1:2;E浓度:120mg/mL;COL:HA:CS 8:1:2
支架材料在PBS中降解速度较慢,30天时降解达到稳定状态 (图3)。在 PBS中降解时,胶原含量越大,降解速度越慢。研究者认为这是因为胶原在40℃以下时不溶于水,从而延缓了支架。而透明质酸钠和硫酸软骨素的含量对支架的降解速度没有明显的影响。

图3 材料降解率
3 讨论
关节软骨为关节表面的薄层透明软骨,表面光滑,附有滑液,是一种具有高度有序的组织。关节软骨由软骨细胞、胶原、蛋白多糖和水组成,其中细胞体积密度仅为5%,水占关节软骨重量的80%,胶原和蛋白多糖聚合物两者含量之比约1:1,占关节软骨湿重的15%[7,8]。
胶原、透明质酸钠和硫酸软骨素属于软骨细胞外基质,同时也是一种优异的生物材料,具有良好的组织相容性。同时利用这三种原料构建组织工程软骨支架,一方面这样的支架包含软骨细胞表面受体的特异识别位点,可以很好的保存软骨细胞而不流失,且抗原性较弱,不易引起排斥反应,具有良好的组织相容性;另一方面这些基质构建的支架可以较好地模拟软骨细胞生长的微环境,有利于细胞在支架上的粘附、生长和分裂增殖,还能进一步将合成的天然细胞外基质作为支架使细胞聚集而构建组织,控制组织结构并调控细胞表型[9]。
静电纺丝技术(Electrospinning)近年来被广泛的应用于生物医用材料领域,如药物控制释放的载体材料、组织工程的支架材料[10-12]。与传统的冷冻干燥法制备的材料相比,静电纺丝制备的软骨支架可以更好地模拟软骨细胞外基质胶原的纤维结构,支架的孔隙率、形貌具有可控性,更容易加工成型,从而更好地模拟软骨的形貌[13-15]。
本文对静电纺丝构建胶原-透明质酸钠-硫酸软骨素复合材料的工艺进行了探索。在前期的实验中,研究者发现,无论是单纯的胶原纺丝,或者是胶原-透明质酸钠,胶原-透明质酸钠-硫酸软骨素纺丝,静电纺丝的物理参数对其能否成功纺丝没有决定性的影响。因此,研究者固定静电纺丝的物理参数,通过改变溶剂的种类、浓度和原料之间的比例来探讨纺丝的工艺参数。单纯的胶原本身具有一定的纤维结构,纺丝效果较好,目前已有相关的文献报道[16]。本研究的难点在于,透明质酸钠和硫酸软骨素不溶于大部分有机溶剂,而去离子水无法作为静电纺丝的溶剂,因此溶剂的选择是本研究的关键。研究者选择了三种不同溶剂,最终确定3-氟乙醇和水的混合溶剂,可以同时溶解这三种原料,并成功地进行纺丝。
静电方式纤维的直径和孔隙率是支架的重要参数。在该研究中,溶液浓度增加,纤维支架的直径增加,孔隙率下降(图1,2)。这与目前静电纺丝浓度对支架直径孔隙率的影响的研究结果一致[17]。在该实验中,三种原料之间的比例也是影响支架直径和孔隙率重要参数。在保证纺丝成功的基础上,在三种原料比例应尽可能的接近生理条件下软骨细胞外基质的成分比例,从而更好地模拟关节软骨的生理环境。需要注意的是,透明质酸钠的粘度较大,在同等浓度下,透明质酸钠溶液的粘度远大于胶原溶液的粘度。较大的粘度会增加溶液在高压静电场下牵拉成丝的难度,纤维的直径也随之增加。因此,纤维直径随透明质酸钠和硫酸软骨素浓度增加而增加,孔隙率则随之下降(图2)。结合试验结果,我们认为纺丝的最佳浓度范围为80~120mg/mL,三种原料支架的最佳比例为6~8:1:1~2,支架纤维的直径和孔隙率则由原料的浓度和比例共同决定。
支架材料的降解率是否合适是决定支架材料能否用于组织工程组织重建的关键因素之一。材料降解过快,将影响种子细胞的三维立体生长,直接影响到种子细胞的增殖能力及重建组织的外观形状;而降解过慢,对组织工程重建组织的细胞外基质塑形及细胞生长也存在一定影响,甚至支架本身对细胞生长就具有一定的抑制或毒性作用[18,19]。该实验所制备的支架由于透明质酸钠和硫酸软骨素溶于水,而胶原在40℃以下不溶于水,因此其降解性能主要由胶原的含量所决定。图3所示,不同比例的支架在30天时降解均趋于稳定,但三种原料比例为8:1:1时,支架的降解速度明显低于其他两种支架,在45天时,支架失重率为30%,而其他两种支架失重率达65%。据文献报道[20],构建具有一定生物学和力学性能的组织工程软骨,细胞生长的周期一般在8~12周,因此三种原料比例为8:1:1所构建的支架更符合构建组织工程软骨的需要。
一种理想的软骨组织工程支架应该具备易于消毒灭菌、良好的可塑性、优异的生物相容性、与组织生长相匹配的降解速度以及与组织相似的力学性能[21]。如前所述,本研究选择软骨细胞外基质胶原、透明质酸、硫酸软骨素作为原料,通过静电纺丝的技术制备出具有良好孔隙率、形貌可控的组织工程软骨支架。从理论上来说,支架应该具有良好的生物相容性,但制备过程中有机溶剂的残留是否对支架的生物相容性产生影响仍有待进一步的实验证实。由于本研究仅是对支架制备工艺的初步探索,支架的生物相容性、力学性能等将在将来的实验中进行更加深入的研究。
综上所述,研究者成功利用静电纺丝技术获得了胶原-透明质酸钠-硫酸软骨素复合组织工程软骨支架。这种支架以软骨细胞外基质为原料,成分上较为接近关节软骨,静电纺丝技术赋予其良好的结构特征,可以较好地模拟关节软骨的结构,是一种具有良好应用前景的组织工程关节软骨支架。支架的生物相容性和力学性能将在下一步的实验里进行更深入的探索。
[1] Yan J H,Liu R,Li X M,et al.A Potential Use Of Collagen-Hyaluronan-Chondroitin Sulfate Tri-Copolymer Scaffold For Cartilage Tissue Engineering.Chinese Journal Of Reparative And Reconstructive Surgery,2006,20(2):130-133.
[2] 阎继红,刘玲蓉,李学敏,等.胶原-透明质酸-硫酸软骨素复合三维支架体外构建组织工程软骨的实验研究.中国修复重建外科杂志,2006,20(2):130-133.
[3] Wang W H,Zhang M,Xu X L,et al.Fabrication Of Collagen-Chondroitin Sulfate-Hyaluronic Acid Scaffold And Its Biolocal Characteristics For Cornea Stroma Tissue Engineering.J Tissue Eng And Recon Surgery,2009,5(1):12-15.
[4] 王伟红,张米,许小林,等.胶原-硫酸软骨素-透明质酸真皮支架材料修复兔角膜基质缺损.组织工程与重建外科杂志,2009,5(1): 12-15.
[5] 陈旭,李国英.胶原/透明质酸共混体系的相容性及相互作用研究.功能材料,2013,44(8):1136-1141.
[6] 王伟红,陆伟,余春艳,等.天然聚合物胶原、硫酸软骨素、透明质酸在组织工程真皮支架材料中的研究进展.第四军医大学学报,2008,9(22):2108-2110.
[7] Ko C S,Huang J P,Huang C W,et al.Type II collagen-chondroitin sulfate-hyaluronan scaffold cross-linked by genipin for cartilage tissue engineering.J Biosci Bioeng,2009,107(2):177-182.
[8] Valizadeh AL,Mussa Farkhani S.Electrospinningandelectrospun nanofibres.IET Nanobiotechnol,2014,8(2):83-92.
[9] Ghasemi-Mobarakeh L,Prabhakaran MP,Morshed M,et al.Application of conductive polymers,scaffolds and electrical stimulation for nerve tissue engineering.J Tissue Eng Regen Med,2011, 5(4):17-35.
[10]Broom ND,Oloyede A.The importance of physicochemical swelling in cartilage illustrated with a model hydrogel system.Biomaterials,1998,19(13):1179-1188.
[11]Chiara G,Ranieri C.Cartilage and Bone Extracellular Matrix.Current Pharmaceutical Design,2009,15(12):1334-1348.
[12]Hynes R O.The extracellular matrix:not just pretty fibrils.Science,2009,326(5957):1216-1219.
[13]Cui W,Zhu X,Yang Y,et al.Evaluation of electrospun fibrous scaffolds of poly(dl-lactide)and poly(ethylene glycol)for skin tissue engineering.Mater Sci Eng C,2009,29(6):1869-1876.
[14]ShabafroozV,MozafariM,VashaeeD,etal.Evaluationofelectrospun fibrous scaffolds ofpoly(dl-lactide)and poly(ethyleneglycol)for skin tissue engineering.J Nanosci Nanotechnol,2014,14(1):522-534.
[15]Joshi M,Butola B S,Saha K.Advances in topical drug delivery system:micro to nanofibrous structures.J Nanosci Nanotechnol, 2014,14(1):853-867.
[16]Sell S,Barnes C,Smith M,et al.Extracellular matrix regenerated: tissue engineering via electrospun biomimetic nanofibers.Polymer International,2007,56(11):1349-1360.
[17]Yang Z L,Chen Z,Liu K,et al.Experimental Study On Tissue Engineered Cartilage Complex Three-Dimensional Nanoscaffold With Collagen Type Ii And Hyaluronic Acid In Vitro.Chinese Journal Of Reparative And Reconstructive Surgery,2013,27(10):1240-1245.
[18]杨泽龙,陈竹,刘康,等.Ⅱ型胶原-透明质酸构建组织工程软骨复合三维纳米支架的体外实验研究.中国修复重建外科杂志,2013,27(10):1240-1245.
[19]Zhang JF,Yang DZ,Nie J.Preparation of three-dimensional structure controllable nanofibers by electrospinning.Polym Adv Tech, 2008,19(9):1150-1153.
[20]Kazuhiko Takaku,Takemitsu Ocawa,Takashi Kuriyama,et al. Fracture behaviorandmorphologyofspuncollagen fibers.Journal of Applied Polymer Science,1996,59(5):887-896.
[21]祁军,陈安民,郭风劲.软骨组织工程支架材料的研究进展.生物骨科材料与临床研究,2007,4(1):27-31.
Process research on constructing tissue-engineered articular cartilage scaffold with collagen,hyaluronic acid and chondroitin sulfate by electrospun
Obejective To explore the process of constructing tissue-engineered articular cartilage scaffold with extracellular matrix-collagen,hyaluronic acid and chondroitin sulfate by electrospun.MethodsElectrospun parameters fixed, the solvent,concentration and the ratio among the materials were changed to explore the conditions of constructing scaffold.Results The best solvent of electrospinning was 3-Trifluoroethanol mixed with water(v:v,1:1);the optimum concentration range was 80 to 120mg/mL and the optimum ratio range among the materials was 6 to 8:1:1 to 2.Fiber diameter and porosity were decided by the concentration and the ratio of the materials.The degradation of the scaffold wasgood,which was mainly decided by the content of the collagen.Conclusion The collagen-hyaluronic acid-chondroitin sulfate scaffold was built by electrospun for tissue-engineered articular cartilage.This scaffold can simulate the composition and the morphology of articular cartilage,which has a good prospect on tissue-engineered articular cartilage.
Collagen;Hyaluronic acid;Chondroitin sulfate;Electrospinning;Tissue-Engineered articular cartilage
R318.08
A
10.3969/j.issn.1672-5972.2015.03.002
swgk2015-01-0020
杨泽龙(1982-)男,硕士,主治医师。研究方向:骨外科。
*[通讯作者]冯刚(1969-)男,研究员。研究方向:组织工程、生物材料。
2015-01-29)
国家自然科学基金(NO:81171472、81201407);四川省教育厅创新团队资助项目(NO.13TD0030);四川教育厅科研项目(13ZB0235);四川省卫生厅科研项目(120286)
南充市中心医院,川北医学院第二临床医学院组织工程与干细胞研究所,四川南充 637000
