长期自主转轮跑运动对小鼠脾淋巴细胞钙稳态,IL-2分泌及钙调基因表达的影响
2015-06-01刘仁仪罗新建
刘仁仪,罗新建
●博士(生)论坛 Doctor Forum
长期自主转轮跑运动对小鼠脾淋巴细胞钙稳态,IL-2分泌及钙调基因表达的影响
刘仁仪,罗新建
目的:通过构建动物模型,研究运动对淋巴细胞钙稳态、IL-2分泌及钙调基因表达影响,以探讨长期适量强度运动调控免疫机能的分子机制。方法:相互匹配雄性小白鼠随机被分成控制组和实验组,实验组执行长期自主转轮跑运动6个月,淋巴细胞分离自小鼠脾脏,胞内钙离子浓度通过荧光稳态/瞬态分析系统测量荧光探针负载细胞悬液而确定,ELISA法检测Con A体外刺激对淋巴细胞分泌IL-2水平的影响,实时荧光定量PCR法检测细胞相关钙调基因表达。结果:不管在含钙缓冲液还是在不含钙PBS溶液中,实验组OKT-3诱导淋巴细胞内钙离子浓度变化幅度显著高于控制组(P<0.05,n=5);实验组Con A体外刺激诱导培养细胞IL-2分泌水平显著高于控制组(P<0.05,n=6);实验组淋巴细胞内钙调节基因STIM1和ORAI1核酸表达水平显著低于控制组(P<0.05,n=5)。结论:长期自主转轮跑运动可促进小鼠脾淋巴细胞钙离子信号转导敏感性,提高体外刺激诱发淋巴细胞分泌IL-2水平,推测胞内钙稳态调控基因表达下调可能是一种负反馈机制,以防止运动诱发的胞内钙稳态失衡,当然这仍需进一步的实验深入研究运动的调控机理。
自主转轮跑;淋巴细胞;钙稳态;IL-2;钙调基因
1 材料与方法
1.1 实验动物
本研究对象为白色雄性CD1瑞士小鼠,实验分组前鼠龄12周,体重(27.0±2.80)g。动物饲养房光照周期被控制为12 h/12 h明暗循环(07:00亮灯),小鼠被饲养在标准笼内。标准条件下,饮食任意可用,室温(21±1)°C,实验动物使用获得相关的动物管理及使用委员会的批准。参照C.P.AVULA等[7]描述构建长期自主转轮跑运动动物模型,相互匹配的雄性小白鼠随机被分成控制组(CG)和自主跑轮运动组(EG),运动组小鼠采取一笼一鼠的饲养方式。自主跑轮是由动物自发运动驱动跑轮转动的装置,它由不受任何限制转轮(直径:11 mm)组件,笼体和转动感应器(磁计数器,Sigma 500)构成。通过磁计数器自动记录动物跑的圈数和总行程等信息,实验操作人员7天/次登记记录数据,并将磁计数器重设回位,实验动物饲养超过6个月。动物处死时间定在上午8:00~9:00,异氟醚麻醉情况下断颈处死动物。统计显示,运动组小鼠每周平均自主转轮跑距离为(53.39±4.847)km。实验数据表明,运动组成功构建了长期自主转轮跑动物模型。
1.2 淋巴细胞分离
密度梯度离心法分离淋巴细胞,利用淋巴细胞分层液(Biocoll)作密度梯度离心,具体的操作流程如下:准备1个90 mm培养皿,将2个细胞滤网(孔径:100 μm)放置其中,且在培养皿中加1 mL PBS溶液;处死实验动物,从其体内取出脾脏;将脾脏置人细胞滤网上,一次性注射器柱塞端轻轻地研磨脾脏;1 mL PBS溶液清洗滤网和培养皿;准备一个15 mL锥形试管,在其中加3 mL分离液(密度:1.077 g/mL);非常小心地将细胞悬液加到分离液上;2 000 rpm离心20 min;将淋巴细胞层移出分离液;加8 ml PBS溶液清洗细胞2次;1 500 rpm离心10 min;弃细胞上清液,重悬细胞人1 mL PBS溶液。整个过程在无菌条件下操作完成。胎盘兰检测细胞的活性在98%以上,流式细胞仪前向-侧向散射模式确定淋巴细胞纯度在99%以上。全自动血细胞分析仪计数淋巴细胞。
1.3 药剂和溶液
Fura-2AM(Molecular Probes Inc.,Eugene,OR)溶解在二甲亚砜(Dimethyl sulfoxide,DMSO),储备液浓度为1 mM/mL,-80°C保存。洋地黄皂苷(Digitonin)购自Sigma-Aldrich公司(美国),乙二醇双(2-氨基乙醚)四乙酸(Ethylene glycol bis(β-aminoethyl)-ether N,N,N',N'tetraacetic acid,EGTA),二甲基亚砜(DMSO)购自Carl Roth公司(德国),鼠单克隆抗体CD3(Muromonab-CD3,OKT3)(1mg/ml)购自Janssen-Cilag公司(德国),达尔伯克改良伊格尔培养基(Dulbecco's Modification of eagle's Medium,DMEM),胎牛血清(Fetal Bovine serum,FBS)细胞培养公司PAA(奥地利)。
1.4 细胞内钙离子浓度的检测
(1)细胞孵育。1 mL含9×106个淋巴细胞的含钙缓冲液(缓冲液组成包括:140 mM氯化钠,3 mM氯化钾,0.4 mM磷酸氢二钠,10 mM羟乙基哌嗪乙磺酸,5 mM葡萄糖,1 mM氯化镁,0.8 mM氯化钙,pH=7.4)与5 μL Fura-2AM(Fura-2AM稀释在DMSO中,储备浓度1 mM)在室温下孵育30 min,过量染剂通过3次离心法(1 500 rpm×10 min)移除,然后将细胞重悬在不含钙PBS溶液中,细胞在冰箱冷藏条件(4~8°C)下保存。(2)荧光扫描。通过应用荧光稳态/瞬态分析系统(Deltascan;PTI,加拿大)测定细胞悬液Fura-2荧光强度,测试系统激发狭缝与发射狭缝宽度均设为10 nm,测定温度设为(37±1)°C,每次负载Fura-2/ AM的淋巴细胞悬液(包含2.7×106个细胞),加人到荧光比色杯中,激发光波长设为340~380 nm,发射光波长设为510 nm。双波长交替扫描,比色皿和溶液等自体荧光在实验前检测,将自动减除,在2 h内完成荧光指示剂负载细胞内钙离子浓度测量实验。(3)刺激检测。为测定在含钙缓冲液中细胞内钙离子浓度,在静息状态下扫描比色杯荧光信号100 s以后,使用OKT3(应用浓度10 μg/ml)刺激细胞650 s。为测定在不含钙缓冲液中细胞内钙离子浓度,在无钙PBS溶液(加0.1 mM EGTA)中测量细胞内钙离子浓度,在最初100 s测量以后,OKT3加人测试介质中分析系统扫描比色杯的荧光250 s,然后将CaCl2溶液加人比色杯中(终浓度0.8 mM)系统扫描荧光350 s。(4)浓度计算。加破膜剂10 mM Digitonin,使Fura-2和Ca2+结合达饱和,测得F340/ F380为Rmax;加人高浓度Ca2+螯合剂EGTA(终浓度为5 mM,pH=8.5),以充分螯合Ca2+,使Fura-2游离,测得的F340/F380为Rmin。根据G.GRYNKIEWICZ等[8]方程式进行计算:

式中:Kd为钙离子特异性荧光探针,Fura-2与Ca2+反应的解离常数,生理条件下,其值是220 nmol·L-1;R为各测定点F340/F380荧光强度比值;Rmax和Rmin分别为上述测定的最大和最小荧光比值;Fmin和Fmax分别代表Ca2+为零及饱和时,在380 nm激发光下测得的Fura-2荧光强度(F380)。
1.5 酶联免疫法检测
运动组和控制组小鼠脾脏CD3+淋巴细胞在非刺激条件下或者Con A刺激条件下(应用浓度:10 μg/mL)进行培养,2 mL DMEM培养基(包括抗体100 μg/mL青霉素,100 μg/mL链霉素和10%v/v胎牛血清FBS,包含2×106个淋巴细胞),在37°C条件下,5%CO2培养箱培育细胞72 h。流式细胞仪的前向和测向散射模式监控淋巴细胞活性。应用Abcam公司IL-2(Interleukin-2)小鼠ELISA试剂盒通过全自动酶标仪检测运动组和控制组细胞在培养基中IL-2的表达量。
1.6 实时荧光定量PCR检测
1.6.1 总RNA抽提 应用试剂盒RNeasy Mini Kit(Qiagen),按照生产商提供的产品使用说明,抽提分离冰冻裂解的CD3+淋巴细胞总RNA。另外,可能的DNA污染通过RNA分离试剂盒提供的RNase-Free DNase Set消化移除。抽提的RNA被重新溶解于RNase free water,储存-80°C冰箱,直至使用。分离的总RNA定量及其完整性通过微量分光光度计NanoDrop ND-1 000 UVVis spectrophotometer(Nano-Drop Technologies)进行分析。
1.6.2 逆转录 使用高容量cDNA反转录试剂盒(the high-capacity cDNA reverse transcription kit,Applied Biosystems),据产品使用说明,以0.5~1 μg总RNA为模板,加0.8 μL(25×,100 mM each)dNTP mixtures,1 μL(50 U/μL)MultiScribe™Reverse Transcriptase,2 μL(10×)RT Random Primers,2 μL(10×)RT Buffer和无菌蒸馏水至20µL,合成第一链cDNA。
1.6.3 实时定量荧光PCR mRNA表达利用实时荧光定量PCR仪iCycler(Bio-Rad)通过高灵敏DNA荧光染料iQ SYBR Green Supermix进行定量分析。反应条件为:1个循环95°C预变性3 min;42个循环95°C变性15 s;61°C退火30 s;72°C延伸30 s,自动采集荧光信号,绘制溶解曲线。所有的引物是跨内含子设计的,检测最佳的退火温,各个引物序列小结见表1,样本双倍检测。通过基因β-actin恒定的表达标准化测试目标基因cDNA水平,通过溶解曲线判断基因表达的特异性。样本扩增通过循环阈值(Ct)表示,计算目标基因的循环阈值(Cttarget)与看家基因(Ctβ-aCtin)循环阈值之间的差值(ΔCt),运动组和控制组特定基因表达的变化使用如下公式计算:2-Δ(ΔCt),Δ(ΔCt)=(ΔCtexercise,target-ΔCtcontrol,target)或(ΔCtexerciseII,target-ΔCtexerciseI,target)。
1.7 统计分析
分别以平均数±标准误(M±SD)表示各定量指标的平均值和离散程度,采用SPSS统计软件进行分析,样本均数比较采用成组设计多个样本均数单因素方差分析,P<0.05为差异具有显著统计学意义,P<0.01为差异具有非常显著统计学意义。
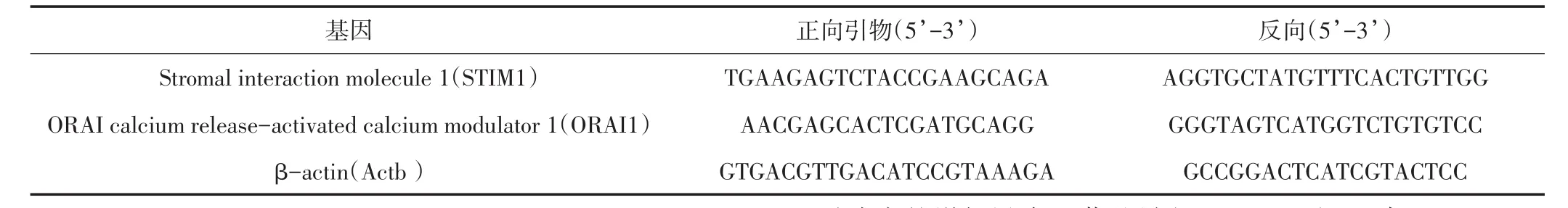
表1 实时荧光定量PCR引物列表Table1 List of primers for real time PCR
2 结果
2.1 当以含钙缓冲液为测试介质时,不同剂量OKT3诱导小鼠脾淋巴细胞胞内钙离子浓度变化
在第100 s,加OKT3刺激比色杯中淋巴细胞,淋巴细胞内钙离子浓度迅速增加(见图1A);以3个剂量5,10和20 μg/mL OKT3分别刺激淋巴细胞650 s后,在控制组,细胞内钙离子浓度分别达到(103.1±26.6)nM,(104.4±15.3)nM和(135.1±17.2)nM,而在运动组分别达到(166.3±32.6)nM,(181.1±34.5)nM和(196.1±32.4)nM(见图1B)。相同剂量OKT3刺激作用下,运动组和控制组细胞内钙离子浓度没有显著差异(P>0.05,n=5)。与刺激前细胞内钙离子浓度比较,以上3个剂量OKT3引起淋巴细胞内钙离子浓度的增幅(加OKT3刺激后细胞内钙离子浓度-刺激前细胞内钙离子浓度),控制组分别为(50.5±9.8)nM,(63.8±6.7)nM和(76.7±4.4)nM,运动组分别为(75.3±13.8)nM,(80.9±15.5)nM和(92.8±5.3)nM。当分别以5和10 μg/mL 2个剂量OKT3刺激细胞时,比较运动组和控制组淋巴细胞内钙离子浓度的增幅没有显著差异(P>0.05,n=5),而当以20 μg/mL OKT-3刺激淋巴细胞时,运动组和控制组之间存在显著差异(P<0.05,n=5)。
2.2 当以无钙PBS溶液为测试介质时,OKT3诱导小鼠脾淋巴细胞胞内钙离子浓度变化
在100 s时,在含有0.1 mmol/L EGTA无钙PBS溶液中加人刺激剂OKT3(应用浓度:10 μg/mL)时,淋巴细胞内钙离子浓度增幅非常少(见图1A和1B)。为了评估细胞外溶液Ca2+内流对胞内钙离子浓度增加的贡献度,在第350 s时,加人CaCl2溶液,细胞内钙离子浓度迅速增加,这意味着胞外大量Ca2+可通过胞膜涌人细胞内。在控制组和运动组,OKT3诱导淋巴细胞内钙离子浓度分别达到(178.0±30.4)nM和(366.0±68.9)nM,2组差异具有统计学意义(P<0.05,n=5)(见图2B)。在控制组和运动组,OKT3诱导细胞内钙离子浓度增幅分别达到(150.3±24.8)nM和(340.7±66.5)nM,差异具有统计学意义(P<0.05,n=5)(见图2C)。
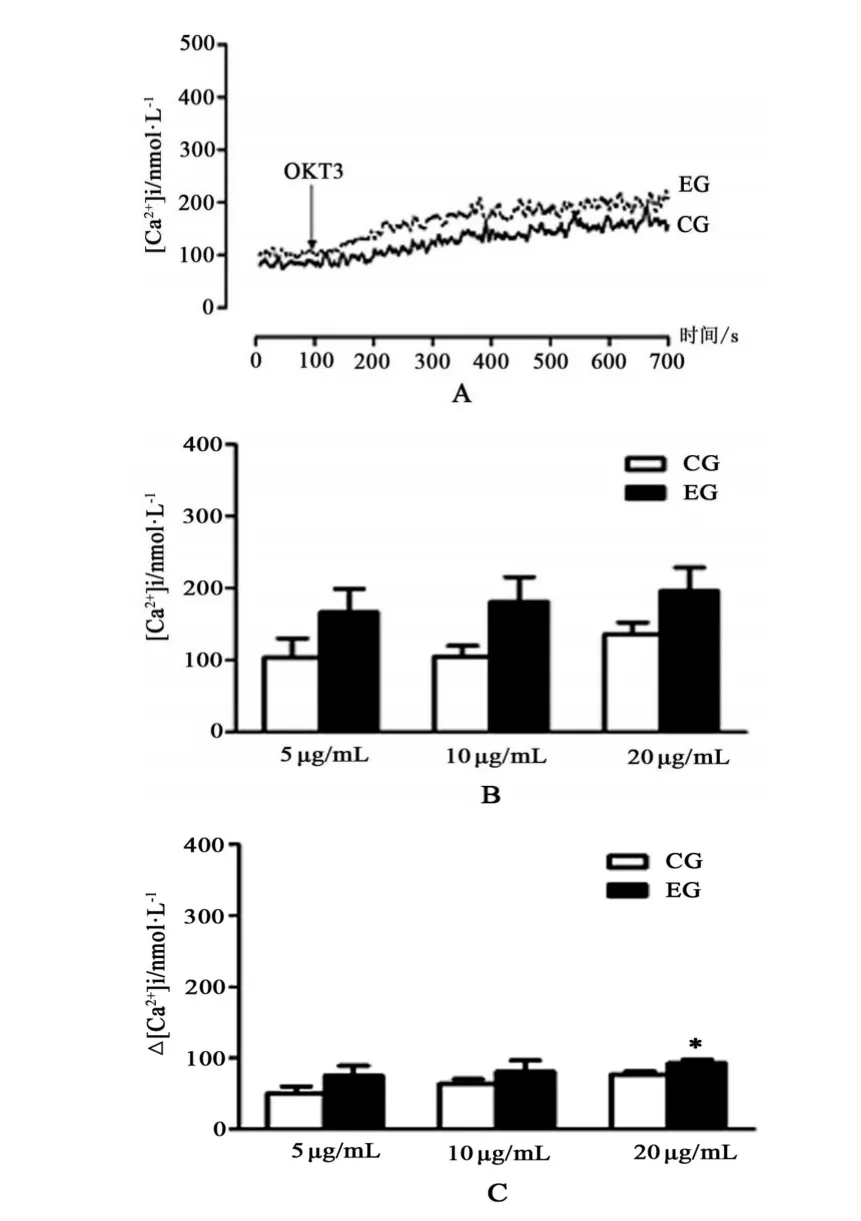
图1 在含钙缓冲液中,OKT3诱导小鼠脾淋巴细胞内钙离子浓度变化Figure1 The change of OKT3-induced Ca2+concentration in Ca2+buffer in lymphocytes of mouse spleens.
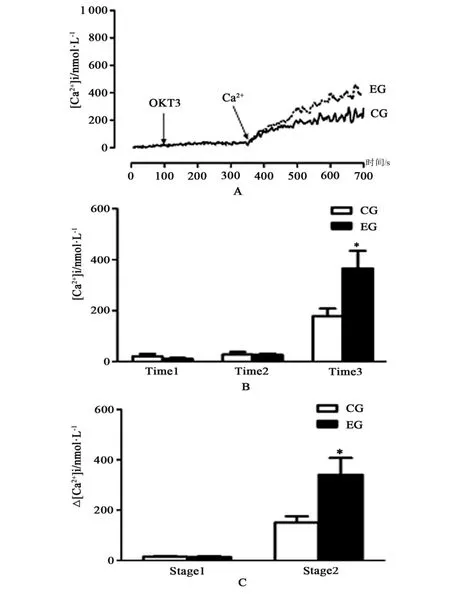
图2 在无钙缓冲液中,OKT3诱导小鼠脾淋巴细胞内钙离子浓度变化Figure2 The change of OKT3-induced Ca2+concentration in Ca2+-free buffer in lymphocytes of mouse spleens.
2.3 在丝裂原Con A刺激作用下,淋巴细胞体外培养细胞IL-2分泌量的变化
根据IL-2标准品浓度15.6,31.25,62.5,125和250 pg/mL分别对应的OD值(吸光度)绘制标准曲线(见图3A)。R2接近1,表示Y=0.005X标准曲线拟合效果非常好,可靠性非常高。Con A体外刺激对小鼠脾淋巴细胞,在运动组与控制组比较均具有诱生IL-2分泌的作用,2组IL-2分泌水平分别为(265.4±49.16)pg/mL和(140.8±27.42)pg/mL,差异具有显著性(P<0.05,n=6)(见图3B)。
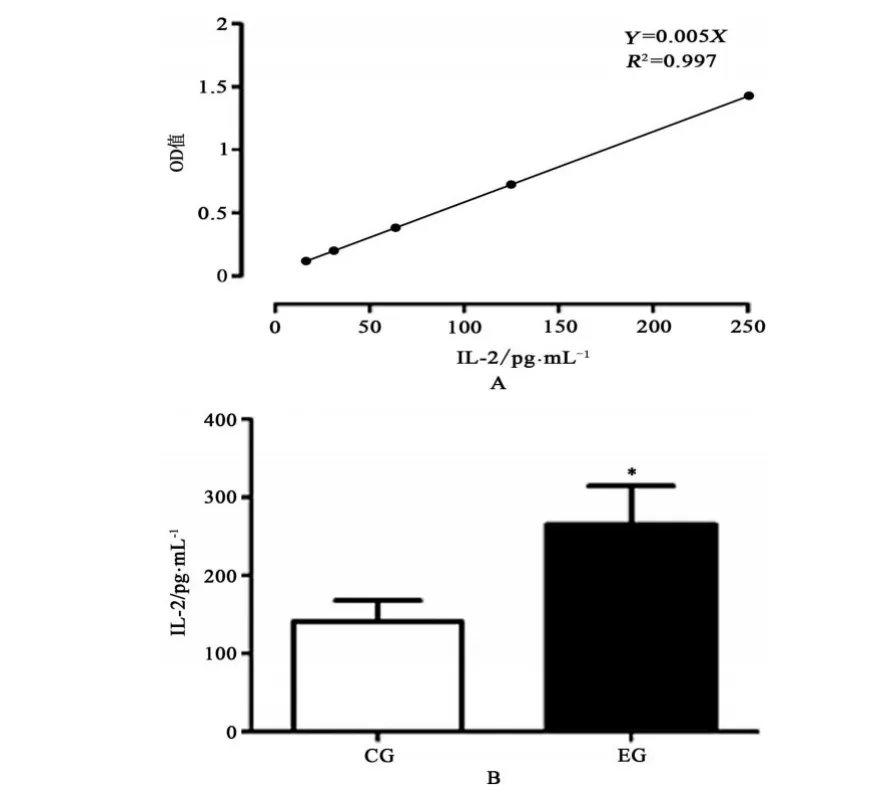
图3 Con A体外刺激对小鼠脾脏淋巴细胞IL-2分泌的影响Figure3 The effect of Con A as a stimulant in vitro culture on the secretion of IL-2 in lymphocytes of mouse spleens
2.4 长期自主跑轮运动对小鼠脾脏淋巴细胞CRAC通道表达的影响
应用实时荧光定量PCR的相对定量法分析,与控制组相比较,在运动组STIM1基因表达显著下调(45.6%±8.4%)(P<0.01,n=5),同样,ORAI基因表达显著下调(42.6%±10.8%)(P<0.05,n=5)(见图4)。
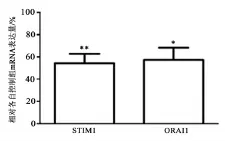
图4 长期自主转轮运动对小鼠脾脏淋巴细胞钙离子稳态调控基因的影响Figure4 The effects of long duration willing wheel-running on expression of Ca2+homeostasis-regulated genes in lymphocytes of mouse spleens
3 讨论与分析
细胞内游离钙离子浓度是胞内钙离子浓度上调、下调和缓冲机制三者平衡的结果。在静息状态下,胞外钙离子浓度通常比胞内钙离子水平高10 000倍[9],这种高浓度差的维持是由于胞膜对钙离子的不通透性,内质网对钙离子的螯合作用,胞膜的排泄作用以及胞内钙离子绑定蛋白的缓冲效应而造成的[10],主要调控细胞内钙离子瞬态的构件以下几种。(1)细胞膜上的钙离子通道,它们负责将胞外Ca2+转运至细胞内空间,这类通道又分成4类。第1类,钙池操纵钙离子通道(Store-operated Ca2+channels)。它是一类由胞内内质网储存钙耗竭而激活的钙离子内流通道,如钙释放激活钙通道(Calcium release-activated calcium channels,CRAC通道),它由胞膜Orai分子组成,并被内质网膜上STIM(Stormal interaction molecule)分子所激活,STIM分子能感受内质网腔内钙离子浓度变化,并激活Orai分子,最后开放CRAC通道,在免疫细胞中,由Orail和STIM1组成的CRAC通道是钙离子内流的主要途径。第2类,电压门控钙离子通道(Voltage-gated Ca2+channels)。它是由于细胞膜的去极化引起钙离子内流。第3类,受体门控钙离子通道(Receptoroperated Ca2+channels)。它是由配体/受体介导钙离子的人胞作用,包括一些TRP(Transient receptor potential)家族成员,1,4,5-三磷酸肌醇受体(InsP3R),P2X受体等。第4类,牵张激活钙离子通道,它是由一些物理参数影响钙离子人胞作用的。(2)细胞膜上的钾离子通道,包括电压门控和钙离激活钾离子通道,这类通道提供钙离子进人细胞内空间的电驱动力。(3)细胞膜上非选择性阳离子通道。(4)细胞内钙池上的钙离子通道,包括三磷酸肌醇受体(InsP3Rs)和Ryanodine受体(RyRs),它们负责钙池内钙离子的释放。(5)细胞膜上钠离子通道,包括TRPM4等。(6)内质网 SERCA钙泵(sarco/endoplasmic reticulum Ca2+-ATPase)和细胞膜PMCA钙泵(plasma membrane Ca2+ATPase),它们能分别将钙离子泵人胞内钙池和胞外空间。(7)细胞内钙池,包括内质网/肌浆网,线粒体,溶酶体,高尔基体,细胞核等。(8)细胞内Ca2+结合蛋白。
静息时,淋巴细胞膜上钙离子通道功能性关闭,但当用激动剂有丝分裂原(如Con A)、抗CD3单克隆抗体(如OKT3)或毒胡萝卜素(Thapsigargin)刺激时,它们将迅速开放。这些刺激剂引起的细胞反应,首先是胞内钙离子释放,沿电化学梯度跨膜从钙通道流人接着跨膜钙离子流驱动一个持续或者振动式胞内钙离子浓度增加。抗CD3单克隆抗体(OKT3)或有丝分裂原(Con A)通过绑定T淋巴细胞/CD3复合物或细胞表面大量的糖蛋白,激活相关的信号分子,生成二酯酰甘油(DAG)和肌醇1,4,5-三磷酸(InsP3)。这2个产物都可充当第二信使,InsP3可促进胞内钙池释放钙离子和持续的跨膜钙离子流。通过胞膜上钙离子通道进人胞内的钙离子流,是改变胞内钙离子瞬态的关键机制。
已知,Fura-2AM是最常用的高效检测胞内钙离子浓度的双波长荧光探针之一,可灵敏地测试微摩尔级钙离子浓度。高级荧光瞬态/稳态测量系统具有测量可靠、灵敏度高、使用方便和配制灵活等优点,在稳态光谱测量中,它提供最高的微弱信号检出能力,可对荧光物质进行定量分析。在本研究中,当使用无钙含有0.1 mM EGTA的PBS溶液作为测试介质,测量淋巴细胞悬液Fura-2AM负载的荧光时,以OKT3作刺激剂,仅能观察到一个微不足道的刺激剂诱导的胞内钙离子浓度增加现象(见图2A和2B)。这可能意味着,在OKT3刺激作用下,胞内钙池释放钙离子进人细胞质,在胞内钙离子浓度增加过程中不占有绝对的比例,胞内钙离子浓度增加可能源于细胞外空间,持续的跨细胞膜钙离子流是引起胞内钙离子浓度增加最主要的因素。因为,当在测试介质中加人钙离子时,观察到一个非常强的跨膜钙离子流促使胞内钙离子浓度迅速增加(见图2A和2B)。
在本研究中,参照相关的文献,采取一笼一鼠的方式构建长期自主转轮跑动物模型,这有利于长期跟踪记录动物运动参与的情况。这种一笼一鼠自主转轮跑方式不会像动物长期应激一样产生消极的适应[11-12],笼体环境符合单个啮齿动物饲养标准。而有关长期运动对激动剂诱导的淋巴细胞内钙瞬态的影响,尚未查到相关的文献,但可参照以前有关长期应激刺激对激动剂诱导淋巴细胞内钙瞬态影响的报道。Y.P.CSERMEL[13]调查长期过度拥挤对植物凝血素刺激小鼠脾T淋巴细胞内钙离子瞬态影响,研究显示,T淋巴细胞不足的钙离子代谢适应可能是老年人在长期应激中免疫反应削弱的主因。D.M.SILBERMAN等[14]研究长期温和的应激刺激对有丝分裂原诱导T细胞内代谢反应途径的影响,发现长期暴露在温和应激环境中的小鼠,其T淋巴细胞在有丝分裂原作用下导致细胞内钙离子浓度增幅减少。Y.SEI等[15]报道长期的束缚应激(2 h/天,持续21天),在第3天和第7天,导致一个显著的丝裂原刺激的CD4+T淋巴细胞钙离子浓度增幅抑制,但第21天则不然;CD8+T细胞不受长期应激的影响;长期应激(7天)对丝裂原诱导的B淋巴细胞内钙离子反应有一个适度的抑制效应,此研究显示,应激对淋巴细胞钙离子动员的抑制效应可能是应激致免疫抑制早期的反应。综上所述,长期的应激刺激可导致激动剂诱导淋巴细胞内钙离子增幅的抑制效应。而本研究显示,长期自主运动能导致OKT3诱导的细胞内钙离子反应增强,这可能暗示长期自主运动与其他长期应激刺激对机体免疫功能的影响有着不同的生理机制。
胞内钙池操控的胞外钙离子进人,开始于细胞内钙池的耗竭,其激活不依赖于InsP3生成。根据实验推导,从OKT3细胞膜表面受体结合到细胞内钙池钙离子释放,继而引起跨膜钙离子流爆发,细胞钙信号转导分子InsP3的作用,可能是在长期自主转轮运动诱导小鼠脾淋巴细胞钙反应增强的关键。增强的钙信号敏感性可能是细胞内钙池释放增加和跨膜钙流增强的主原因之一,因为增强的细胞内钙信号转导伴随着低的钙通道基因表达,可能意味着长期自主转轮运动可促使小鼠脾淋巴细胞钙信号转导敏感性增强。这可能是长期自主转轮运动诱导机体免疫适应的结果。本研究显示,长期自主运动促进体外细胞培养Con A诱导的小鼠脾淋巴细胞IL-2分泌的功能,这就可能意味着,长期自主运动增强机体免疫细胞功能。在本文的实验中,RT-PCR技术检测却发现,长期自主运动诱导小鼠脾CD3+淋巴细胞钙通道基因表达下调。综上所述,增强的淋巴细胞内钙信号反应却伴随着降低的钙通道基因表达,而且促进淋巴细胞分泌IL-2的机能。据此推测,长期运动诱导的脾淋巴细胞钙通道基因表达下调对细胞功能来说它可能是一种正向的效应,这是不是可防止运动诱导的淋巴细胞内钙超载?因为,有研究表明,过量的跨膜钙流可能意味着胞内钙超载,而这可能导致细胞功能削弱甚至细胞凋亡[16]。先前有研究表明,钙超载是细胞死亡最后共同的通路[17]。推测,为了维持淋巴细胞内钙离子稳态,控制胞内钙离子在一个适度的水平,需要有一个负反馈机制平衡长期运动诱导的渐增的细胞内钙信号反应。负反馈是一种稳态维持机制,通过机体自我调控过程,胞膜钙通道在调控跨膜钙流过程中起重要作用,减少其表达,因而可能减少钙信号反应强度,使其回归一个正常的范畴。但长期运动通过何种机制诱导钙调基因表达尚不知道,是否与神经内分泌调节,钙信号转导通路可能是神经内分泌调节免疫机能的目标,氧化应激的作用,骨骼肌与免疫组织间的对话等因素有关。
5 小 结
本研究显示,长期自主转轮跑运动促进小鼠脾淋巴细胞钙离子信号转导敏感性,提高体外刺激诱发淋巴细胞分泌IL-2水平,推测胞内钙稳态调控基因表达下调可能是一种负反馈机制,以防止运动诱发的胞内钙稳态失衡,当然这仍需进一步的实验深人研究运动的调控机理。
[1]NEGULESCU P A,SHASTRI N,CAHALAN M D.Intracellular calcium dependence of gene expression in single T lymphocytes[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(7):2873-2877.
[2]FESKE S,GILTNANE J,DOLMETSCH R,et al.Gene regulation mediated by calcium signals in T lymphocytes[J].Nature immunology,2001,2(4):316-324.
[3]DOLMETSCH R E,LEWIS R S,GOODNOW C C,et al.Differential activation of transcription factors induced by Ca2+response amplitude and duration[J].Nature,1997,386(6627):855-858.
[4]CASTILHO R F,KOWALTOWSKI A J,MEINICKE A R,et al.Permeabilization of the inner mitochondrial membrane by Ca2+ions is stimulated by t-butyl hydroperoxide and mediated by reactive oxygen species generated by mitochondria[J].Free radical biology&medicine,1995,18(3):479-486.
[5]CHOUDHRY M A,AHMAD S,THOMPSON K D,et al.T-lymphocyte Ca2+signalling and proliferative responses during sepsis[J].Shock,1994,1(6):466-471.
[6]KHAIDUKOV S V,LITVINOV I S.Calcium homeostasis change in CD4+T lymphocytes from human peripheral blood during differentiation in vivo[J].Biochemistry.Biokhimiia,2005,70(6):692-702.
[7]AVULA C P,MUTHUKUMAR A R,ZAMAN K,et al.Inhibitory effects of voluntary wheel exercise on apoptosis in splenic lymphocyte subsets of C57BL/6mice[J].Journalofappliedphysiology,2001,91(6):2546-2552.
[8]GRYNKIEWICZ G,POENIE M,TSIEN R Y.A new generation of Ca2+indicators with greatly improved fluorescence properties[J].The Journal of biological chemistry,1985,260(6):3440-3450.
[9]CLAPHAM D E.Calcium signaling[J].Cell,1995,80(2):259-268.
[10]CARAFOLI E.Intracellular calcium homeostasis[J].Annual review of biochemistry,1987,56:395-433.
[11]MORASKA A,DEAK T,SPENCER R L,et al.Treadmill running produces both positive and negative physiological adaptations in Sprague-Dawley rats[J].Am J Physiol Regul Integr Comp Physiol,2000,279(4):R1321-1329.
[12]MORASKA A,FLESHNER M.Voluntary physical activity prevents stress-inducedbehavioraldepressionandanti-KLHantibodysuppression [J].Am J Physiol Regul Integr Comp Physiol,2001,281(2):R484-489.
[13]CSERMELY P,PENZES I,TOTH S.Chronic overcrowding decreases cytoplasmic free calcium levels in T lymphocytes of aged CBA/CA mice [J].Experientia,1995,51(9-10):976-979.
[14]SILBERMAN D M,ZORRILLA-ZUBILETE M,CREMASCHI G A,et al.Protein kinase C-dependent NF-kappa B activation is altered in T cells by chronic stress[J].Cellular and molecular life sciences:CMLS,2005,62(15):1744-1754.
[15]SEI Y,MCINTYRE T,SKOLNICK P,et al.Stress modulates calcium mobilization in immune cells[J].Life sciences,1991,49(9):671-676.
[16]ROY S S,HAJNOCZKY G.Calcium,mitochondria and apoptosis studied by fluorescence measurements[J].Methods,2008,46(3):213-223.
[17]DONG Z,SAIKUMAR P,WEINBERG J M,et al.Calcium in cell injury and death[J].Annual review of pathology,2006,1:405-434.
Effects of Long-duration Willing Running-on-wheels on Intracellular Ca2+Homeostasis,IL-2 Secretion and Ca2+-regulating Genes Expression of Lymphocytes in Mouse Spleens
LIU Renyi,LUO Xinjian
(Dept.of PE,China University of Geosciences(Wuhan),Wuhan 430074,China)
By using animal models,the purpose of this study is to examine the effect of long-duration willing wheel-running on intracellular Ca2+homeostasis,expression of Ca2+-regulating genes and mitogen-induced secretion of IL-2 in lymphocytes of mouse spleens and to explore the molecular mechanism that how the long-duration and regular physical activities regulates the immune function.The male mice were divided to the two groups,the experimental group and the control group at random.The mice in the experimental group performed long-duration willing wheel-running for 6 months. Lymphocytes were separated from mouse spleens.Intracellular Ca2+was decided by using a spectrometer to measure fluorescent probe-loaded lymphocytes suspension.The effect of Con A as a stimulant in vitro culture on the secretion of IL-2 in lymphocyte was determined by using ELISA. The expressions of Ca2+-regulating genes were decided by real-time PCR analysis.Either in Ca2+-containing buffer or in Ca2+-free PBS solution,OKT3-induced change of intracellular Ca2+concentration was significantly higher in the experimental group than in the control group(P<0.05,n=5). The secretion of IL-2 is higher in the experimental group than in the control group by using Con A as a stimulant in vitro culture(P<0.05,n=6). However,the expression of mRNA,such as,Ca2+-regulating genes,STIM1,ORAI1,were down-regulated,significantly in the experimental group(P<0.05 or 0.01,n=5).This research suggested that long-duration willing running on wheels promotes the sensibility of intracellular Ca2+signals,and IL-2 secretion of in lymphocytes of mouse spleens.And we speculate that down-regulation of the Ca2+regulating genes expression might serve as a reverse feedback mechanism to protect cells from the unbalanced intracellular Ca2+homeostasis.Certainly it needs further experiments to investigate the mechanism that physical activities regulate intracellular Ca2+homeostasis of lymphocytes.
willing running on wheels;lymphocytes;Ca2+homeostasis;IL-2;Ca2+-regulating genes
G 804.2
:A
:1005-0000(2015)06-520-06
2015-07-04;
2015-11-11;录用日期:2015-11-12
中央高校基本科研业务费专项资金“杰出人才培育基金”项目(项目编号:CGU150607)
刘仁仪(1977-),男,湖南耒阳人,博士,副教授,研究方向为运动与免疫。
中国地质大学(武汉)体育部,湖北武汉430074。机制,而淋巴细胞钙信号转导可能成为运动调控免疫机能研究的一个突破口,因为细胞钙信号转导是一重大的运动医学前沿的课题,细胞钙信号网络涉及到超过2万种相关蛋白质。细胞内Ca2+是一种高效低廉,作用非常广泛的阳离子,它是细胞内重要的,普遍存在的第二信使物质之一,是细胞信号转导网络中的一个焦点。细胞内钙离子浓度,即[Ca2+]i,其增减可成为众多细胞生化反应“启”和“闭”的开关,它广泛参与细胞功能反应过程,如基因表达[1-2]、转录因子激活[3]、自由基代谢[4]、细胞增殖[5]和细胞分化[6]等。然而,据所掌握的文献,目前尚无研究系统探讨长期适宜强度运动对机体淋巴细胞内钙稳态影响及其调控机理。文献显示:(1)脾脏是机体重要的免疫器官,它含有大量的T淋巴细胞,鼠单克隆抗体CD3(Muromonab-CD3,OKT3)和刀豆球蛋白A(Concanavalin A,Con A)可引起淋巴细胞内Ca2+浓度变化,它们常用作研究淋巴细胞功能便捷的药物工具,ConA具有强力促淋巴细胞有丝分裂和细胞转化的作用,通过使用Con A来刺激淋巴细胞这一途径,它也可用来评估淋巴细胞功能;(2)细胞因子是由活化的免疫细胞分泌的低分子量可溶性蛋白质,是免疫系统重要的信息分子,IL-2是在机体免疫调节中起重要作用的细胞因子之一,主要由活化T淋巴细胞产生,通过检测IL-2分泌水平,可以反映机体的免疫功能高低,尤其是细胞免疫功能;(3)细胞膜上钙离子通道调控胞内钙离子稳态,在免疫细胞,胞外Ca2+内流主要由胞膜上CRAC(Ca2+release-activated Ca2+)通道完成,而它由胞膜Orai分子(包括3个亚型:Orai1,Orai2和Orai3,而Orai1是最重要的)组成,并被内质网膜上STIM(Stormal interaction molecule)分子(包括STIM1和STIM2 2个亚型,而STIM1是最重要的)所激活,STIM分子能感受内质网腔内钙离子浓度变化,并激活Orai分子,最后开放CRAC通道。因此,本研究试图通过研究长期自主转轮跑运动对小鼠脾淋巴细胞内钙稳态,相关的钙调基因STIM1和Orai1表达,以及刀豆球蛋白A体外诱导淋巴细胞IL-2分泌的影响,揭示长期自适宜强度运动调控机体免疫功能可能的分子机制。
10.13297/j.cnki.issn1005-0000.2015.06.010
机体免疫系统执行免疫应答及免疫功能反应过程,运动是提高机体免疫功能的重要手段。一般来说,长期适宜强度的运动促进机体免疫功能,而过度负荷运动则抑制(或削弱)免疫机能。国内外有许多研究试图阐明运动影响机体免疫功能的分子
