DEK表达下调通过抑制胃癌SGC-7901细胞中NF-κB信号途径诱导细胞凋亡*
2015-05-16张彩凤董良鹏夏永华郭晓鹤张利利周慧聪张兰芳李贞娟新乡医学院第一附属医院消化内科普通外科皮肤科河南卫辉4500
张彩凤,董良鹏,夏永华,郭晓鹤,张利利,周慧聪,张兰芳,李贞娟,韩 宇(新乡医学院第一附属医院消化内科,普通外科,皮肤科,河南卫辉4500)
DEK表达下调通过抑制胃癌SGC-7901细胞中NF-κB信号途径诱导细胞凋亡*
张彩凤1△,董良鹏2,夏永华3,郭晓鹤1,张利利1,周慧聪1,张兰芳1,李贞娟1,韩宇1
(新乡医学院第一附属医院1消化内科,2普通外科,3皮肤科,河南卫辉453100)
[摘要]目的:研究DEK表达下调对胃癌SGC-7901细胞凋亡的影响,并分析其与NF-κB信号途径及凋亡相关蛋白表达的关系。方法:将DEK siRNA和对照siRNA转染胃癌SGC-7901细胞,并将SGC-7901细胞分为未处理组、对照siRNA组及DEK siRNA组。采用实时荧光定量PCR和Western blot检测3组胃癌SGC-7901细胞中DEK mRNA和蛋白的表达;流式细胞术检测3组SGC-7901细胞凋亡的变化; Caspase-Glo-3/9试剂盒检测3组SGC-7901细胞中caspase-3和caspase-9的活性; Western blot技术检测3组SGC-7901细胞中NF-κB信号途径关键调控蛋白p65及凋亡相关蛋白Bcl-2和Bax的表达。结果:与未处理组和对照siRNA组相比,DEK siRNA组SGC-7901细胞中DEK的mRNA和蛋白表达水平显著下调( P<0.05)。DEK siRNA组SGC-7901细胞的早期凋亡率和总凋亡率均显著高于未处理组和对照siRNA组( P<0.05)。最为显著的是,DEK siRNA转染细胞后,p65和Bcl-2蛋白表达下调,Bax蛋白表达上调,并伴随caspase-3和caspase-9活性上升。结论: DEK表达下调介导的SGC-7901细胞凋亡可能与NF-κB信号途径密切相关。
[关键词]胃癌; DEK;细胞凋亡; NF-κB信号途径
胃癌发病率在全球范围内居第4位,其死亡率为恶性肿瘤死亡率的第2位[1-3]。尽管胃癌的手术及化疗方案有很大的改善[4-5],胃癌仍保持较高的致死率和较低的存活率[6]。目前,肿瘤分子靶向治疗可能成为继手术、放疗和化疗之后的新的替代手段,因此,寻找新的分子靶点治疗胃癌具有十分重要的意义。
DEK基因定位于染色体6p,最初在急性髓系白血病染色体转位t( 6; 9) ( p23; q34)中的靶点被发现[7]。随着分子肿瘤学的快速发展,对于DEK功能的阐明也逐渐明晰,研究显示,DEK作为染色质构建蛋白,在mRNA的剪接、转录控制、DNA损伤修复、分化、细胞存活、细胞凋亡、信号转导以及化疗抗性中发挥极其重要的作用[8-11]。进一步研究表明,DEK在多种不同的肿瘤中呈现过表达,其与肿瘤的发生发展及预后关系密切[12-16]。此外,DEK在胃癌组织中的表达水平也显著高于胃黏膜异型增生组织和正常组织[17],提示DEK可能在胃癌的发生发展中发挥癌基因的作用,但其分子机制尚需探讨。本研究中,我们利用DEK特异性的siRNA下调胃癌SGC-7901细胞中DEK mRNA和蛋白的表达,研究DEK表达下调对胃癌细胞凋亡的影响,并分析其对NF-κB信号途径关键调控蛋白p65的表达、凋亡相关蛋白caspase-3和caspase-9的活性以及Bcl-2和Bax蛋白表达的影响,初步探讨其介导凋亡可能的分子机制,该研究有望为以DEK为分子靶点的胃癌基因治疗提供新的实验证据。
材料和方法
1细胞株和实验材料
胃癌SGC-7901细胞株购自中科院上海细胞研究所。RPMI-1640培养基、胰蛋白酶和胎牛血清均购自Gibco;脂质体2000购自Invitrogen; TRIzol购自Invitrogen;一步法实时荧光定量PCR试剂盒购自天根生化科技有限公司;蛋白裂解液购自TaKaRa;凋亡检测试剂盒Annexin V-FITC Kit购自BD; Caspase-Glo-3/9试剂盒购自Promega; DEK、p65、Bcl-2、Bax 和β-actin抗体以及DEK siRNA和对照siRNA( control siRNA)均购自Santa Cruz。
2方法
2.1细胞培养和siRNA转染将胃癌SGC-7901细胞株从液氮中取出,置于含10%的胎牛血清的RPMI-1640培养液中复苏,传3代后,当细胞融合度达90%左右时,按照脂质体2000的说明书将DEK siRNA和对照siRNA转染胃癌SGC-7901细胞。在后续实验中将细胞分为未处理组(培养的SGC-7901细胞不进行任何处理),对照siRNA组(将对照siRNA转染SGC-7901细胞)和DEK siRNA组(将DEK siRNA转染SGC-7901细胞)。
2.2流式细胞术检测不同组别的SGC-7901细胞凋亡将DEK siRNA转染后于48 h收获细胞,采用预冷PBS缓冲液漂洗,按1×109/L密度重悬细胞,接着取100 μL细胞置于流式管中,加入Annexin VFITC和PI各5 μL,于避光下孵育15 min后采用流式细胞术检测10 000个细胞,最后采用Cell Quest软件分析细胞凋亡的结果。
2.3不同组别的SGC-7901细胞中caspase-3和caspase-9的活性分析按照Caspase-Glo-3/9试剂盒说明书检测caspase-3和caspase-9的活性,其步骤如下: DEK siRNA和对照siRNA转染后于48 h收获细胞,并置于缓冲液( 25 mmol/L Hepes,pH 7.5,5 mmol/L MgCl2,1 mmol/L EGTA,1 mmol/L Pefabloc和胃酶抑素、亮肽素和抑肽酶各1 mg/L),充分悬浮后,于4℃13 000 r/min离心15 min。将澄清的提取液中的蛋白浓度预先调整为1 g/L,-80℃下冻存。为了测定caspase活性,将稀释后的提取液( 10 mg/ L)与Caspase-Glo检测试剂等体积混合,置于96孔白壁培养板中。室温孵育1 h,然后使用读板的发光检测仪读数。
2.4实时荧光定量PCR检测不同组别的SGC-7901细胞中DEK mRNA的表达收集转染后48 h的3组胃癌SGC-7901细胞,采用TRIzol试剂分别提取各组不同处理的SGC-7901细胞的总RNA,设计DEK的上游引物为5’-CCAGGCACTGTGTCCTCATT-3’,下游引物为5’-GGCAATGGTTTGCCAGAAGG-3’,产物大小为233 bp;内参照β-actin的上游引物为5’-GTCACCAACTGGGACGACAT-3’,下游引物为5’-TAGCAACGTACATGGCTGGG-3’,产物大小为181 bp。然后按一步法实时荧光定量PCR试剂盒的操作说明配制反应体系,于ABI 7300仪器上进行PCR反应,反应程序为反转录反应50℃30 min。PCR条件: 94℃2 min; 94℃30 s,56℃30 s,65℃延伸30s,35个循环。实验中每个样品重复3次,基因的相对表达分析采用2-ΔΔCt方法进行计算[18]。
2.5Western blot检测蛋白表达收集转染后48 h 的3组不同处理的胃癌SGC-7901细胞,提取总蛋白并行SDS-PAGE,接着取下凝胶并电转移至NC膜上。然后采用含5%脱脂奶粉的TBST液封闭NC膜2 h,加入Ⅰ抗( DEK、p65、Bcl-2、Bax和β-actin,1∶200),于4℃摇床中过夜孵育。次日加入Ⅱ抗于室温孵育2 h。将NC膜置于增强化学发光试剂中反应1~3 min,于暗室中采用X射线曝光,常规方法进行显影、定影,显示特异的蛋白信号。蛋白表达的灰度值利用Image-Pro Plus 5.0软件分析,蛋白相对表达水平为目的基因的灰度值与内参照基因的灰度值的比值,其中β-actin作为内参照。
3统计学处理
采用SPSS 17.0软件对上述实验结果进行统计分析,数据以均数±标准差( mean±SD)表示,3组之间比较采用单因素方差分析( one-way ANOVA),以P<0. 05为差异有统计学意义。
结果
1 DEK siRNA显著下调胃癌SGC7901细胞中DEK mRNA的表达
将DEK siRNA转染SGC-7901细胞后48 h,与未处理组和对照siRNA组相比,DEK siRNA组中DEK mRNA的表达显著下调,且差异有统计学意义( P<0.05),而未处理组和对照siRNA组中DEK mRNA的表达无差异,见图1。
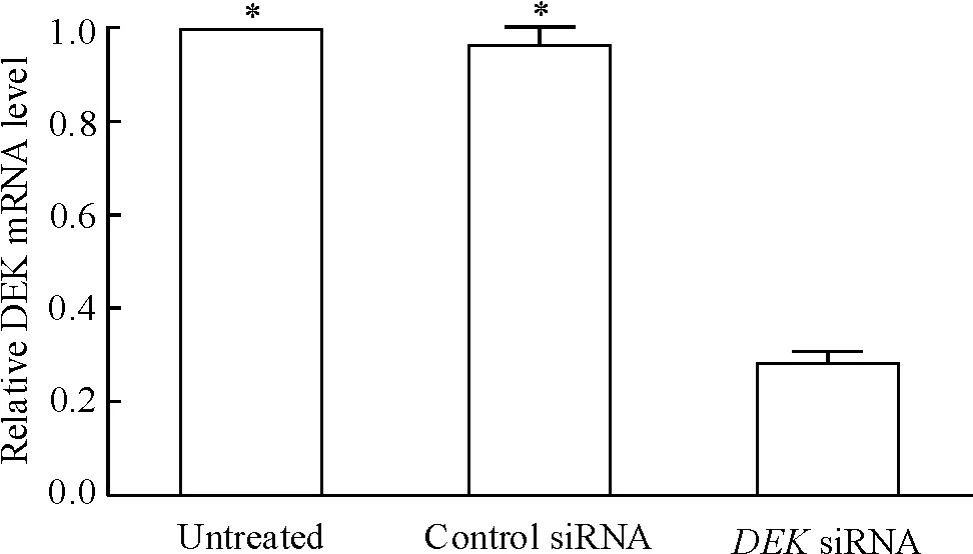
Figure 1.DEK siRNA inhibited the mRNA expression of DEK in gastric carcinoma SGC-7901 cells.Mean±SD.n =3.*P<0. 05 vs DEK siRNA group.图1 DEK siRNA抑制胃癌SGC-7901细胞中DEK mRNA的表达
2 DEK siRNA显著下调胃癌SGC-7901细胞中DEK蛋白的表达
将DEK siRNA转染SGC-7901细胞后48 h,与未处理组和对照siRNA组相比,DEK siRNA组中DEK蛋白的表达显著下调( P<0.05),而未处理组和对照siRNA组中DEK蛋白的表达无统计学差异,见图2。
3 DEK表达下调对胃癌SGC-7901细胞凋亡的影响
与未处理组和对照siRNA组相比,DEK siRNA组中胃癌SGC-7901细胞的早期凋亡率和总凋亡率均显著上升( P<0.05),而未处理组和对照siRNA组中SGC-7901细胞的凋亡率无统计学差异,见图3。
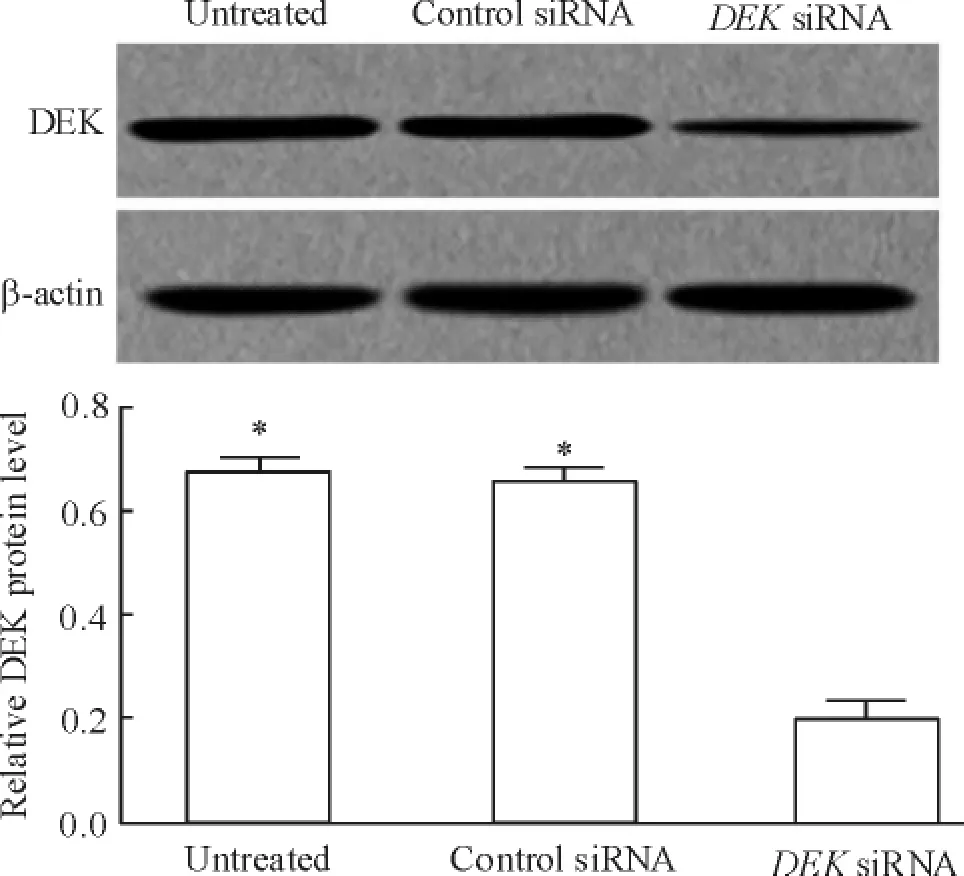
Figure 2.DEK siRNA inhibited the protein expression of DEK in gastric carcinoma SGC-7901 cells.Mean±SD.n =3.*P<0. 05 vs DEK siRNA group.图2 DEK siRNA抑制胃癌SGC-7901细胞中DEK蛋白的表达
4 DEK表达下调抑制胃癌SGC-7901细胞中p65的表达
为了进一步探讨DEK表达下调诱导细胞凋亡的分子机制,用Western blot检测转染前后NF-κB信号途径中的关键蛋白p65的表达。结果表明,与未处理组和对照siRNA组相比,DEK siRNA组中SGC-7901细胞中p65蛋白的表达显著下调( P<0. 05),而未处理组和对照siRNA组之间p65蛋白的表达无统计学差异,见图4,这些结果表明DEK表达下调能显著抑制胃癌细胞中NF-κB信号途径。
5 3组胃癌SGC-7901细胞中caspase-3和caspase-9的活性分析
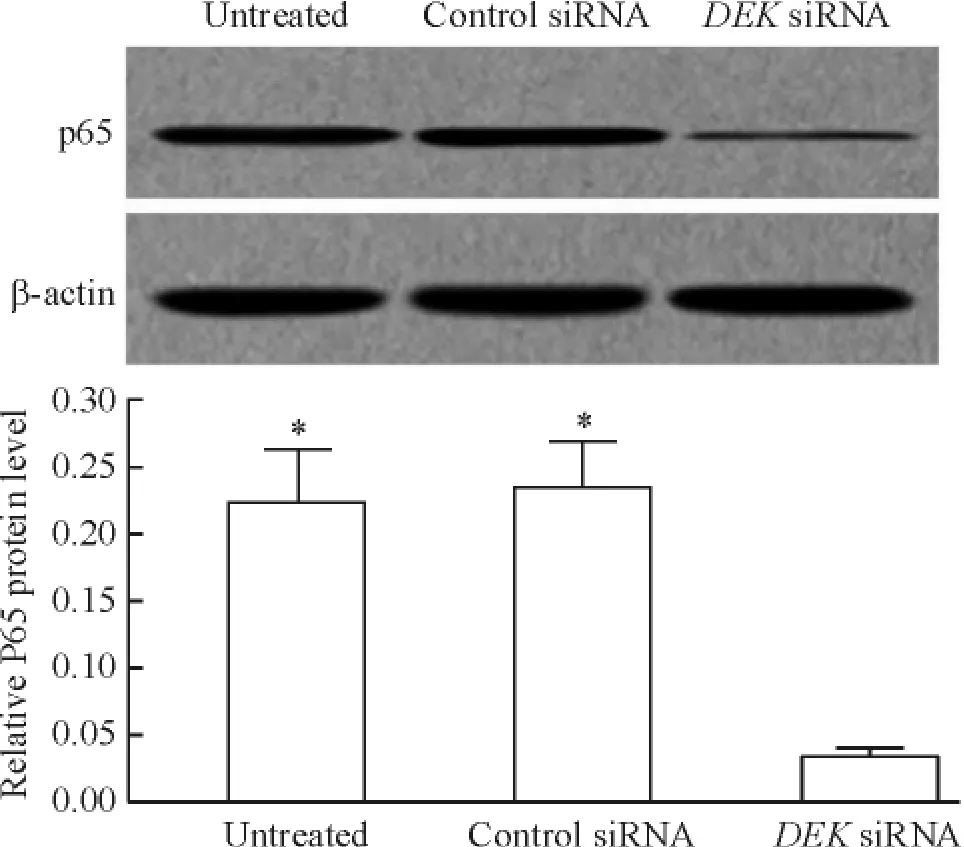
Figure 4.The effect of DEK downregulation on NF-κB signaling pathway in gastric carcinoma SGC-7901 cells.Mean± SD.n =3.*P<0. 05 vs DEK siRNA group.图4 DEK表达下调对胃癌SGC-7901细胞中NF-κB信号途径的影响
6 DEK表达下调对胃癌SGC-7901细胞中Bcl-2和Bax蛋白表达的影响
为了进一步分析DEK表达下调诱导细胞凋亡的可能的分子机制,我们又采用Westernblot分析转染前后细胞凋亡关键蛋白Bcl-2和Bax蛋白的表达。结果显示,与未处理组和对照siRNA组相比,DEK siRNA组中SGC-7901细胞中Bcl-2蛋白表达显著下调,而Bax蛋白的表达显著上调( P<0.05),而未处理组和对照siRNA组之间Bcl-2和Bax蛋白的表达无显著差异,见图5。

表1 3组胃癌SGC-7901细胞的caspase-3和caspase-9活性分析Table 1.The activities of caspase-3 and caspase-9 in the SGC-7901 cells with different treatments ( Mean±SD.n = 3)
讨论
DEK作为高度保守的核基因,优先表达在增殖活跃的细胞和恶性肿瘤中,其在每个核中大概有4~5百万个拷贝[19]。DEK已经被证实能促进多种不同类型的肿瘤发生,这可能是由于其能抑制细胞的分化、衰老和凋亡[11],因而抑制DEK的表达有望成为肿瘤治疗的潜在分子靶点。为了分析DEK在胃癌中的功能,我们首先将DEK siRNA转染胃癌SGC-7901细胞,采用实时荧光定量PCR和Western blot检测转染前后DEK mRNA和蛋白的表达,我们发现DEK siRNA转染后的48 h,胃癌SGC-7901细胞中DEK mRNA和蛋白的表达明显低于未处理组和对照siRNA组,提示DEK siRNA能显著下调胃癌细胞中DEK mRNA和蛋白的表达,这一结果为后续进一步阐明DEK的功能提供了极其理想的研究平台。
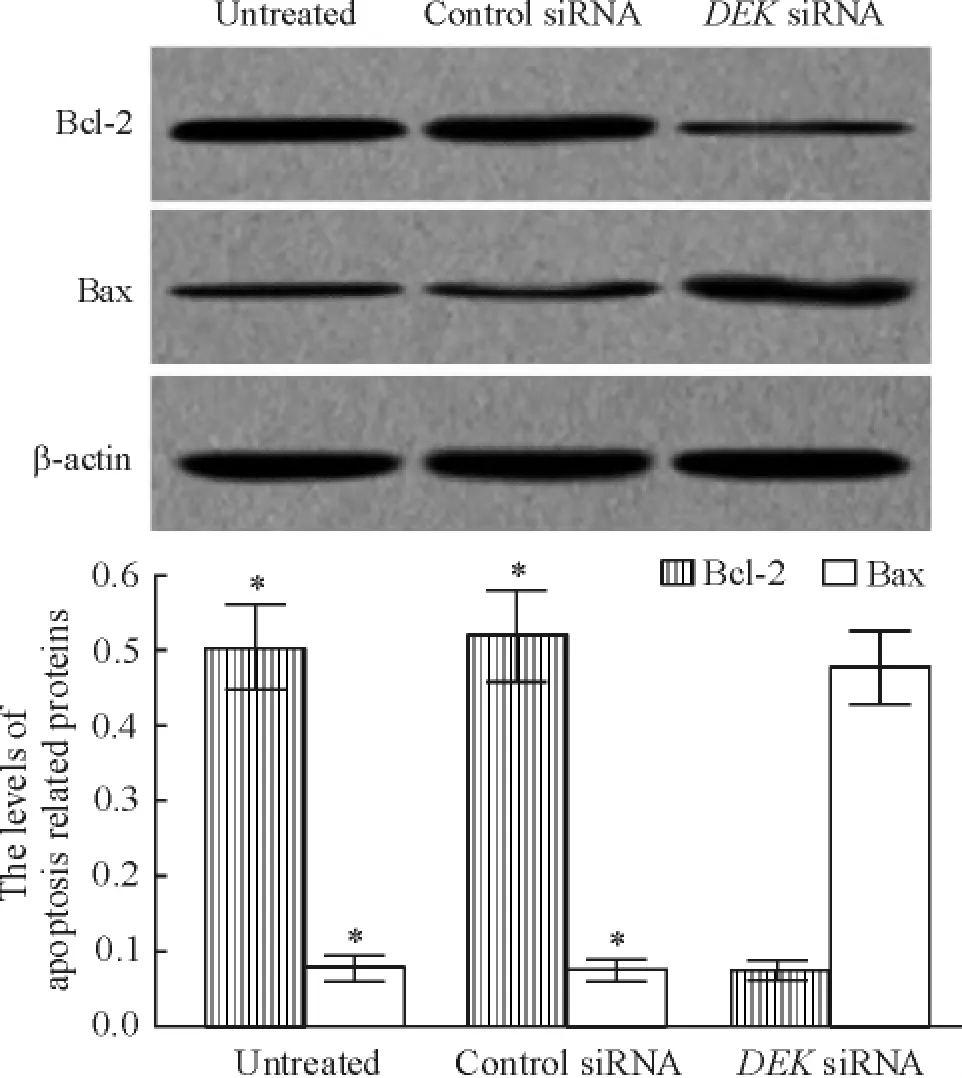
Figure 5.The effect of DEK downregulation on the protein expression of Bcl-2 and Bax in gastric carcinoma SGC-7901 cells.Mean±SD.n = 3.*P<0. 05 vs DEK siRNA group.图5 DEK表达下调对胃癌SGC-7901细胞中Bcl-2和Bax蛋白表达的影响
肿瘤细胞最为显著的特征之一是逃避细胞凋亡[20],因而诱导细胞凋亡可能成为肿瘤治疗的新的策略和手段。研究表明,在宫颈癌HeLa细胞中敲除DEK能诱导细胞凋亡,这可能至少部分通过肿瘤抑制基因p53的诱导实现[21]。此外,DEK新的凋亡功能在转录控制的抗凋亡蛋白MCL-1中被鉴定[8]。Liu等[22]研究表明,沉默DEK的表达能诱导宫颈癌CaSki细胞的凋亡和衰老,这可能主要通过抑制NF-κB信号途径实现。最为重要的是,Kim等[23]利用质谱分析DEK的作用靶点时,发现DEK能调控58个下游靶蛋白,其中包括41个上调基因和17个下调基因,最后对58个蛋白进行鉴定,发现16%的蛋白与凋亡相关。这些研究表明DEK可能在调控肿瘤细胞凋亡中发挥极其关键的作用,在本研究中,为了阐明是否DEK表达下调能引起胃癌细胞发生凋亡,我们采用流式细胞术分析不同处理的胃癌细胞凋亡的变化,结果发现,DEK siRNA组中胃癌SGC-7901细胞的早期凋亡率和总凋亡率均显著高于未处理组和对照siRNA组,提示DEK表达下调能明显诱导胃癌细胞发生凋亡。
研究表明,调控NF-κB信号途径可以诱导SGC-7901细胞的凋亡[24],因而可能成为潜在的分子治疗靶点[25]。激活的NF-κB信号途径在胃癌SGC-7901细胞中主要表现为抗凋亡作用,其分子机制是通过直接调控下游靶基因的表达,如通过调节Bcl-2家族蛋白来发挥抗凋亡作用[26]。此外,caspases的活化是细胞程序性死亡的终末期,该过程能被Bcl-2家族成员所抑制[27],可以通过激活caspases的活性切割作用而诱导SGC-7901细胞发生凋亡现象[28]。研究显示,抑制DEK的表达能通过抑制NF-κB信号途径来诱导细胞凋亡[22]。为了进一步分析DEK表达下调诱导凋亡的分子机制,我们采用Western blot技术检测不同处理的胃癌SGC-7901细胞中NF-κB信号途径的关键组分p65蛋白以及凋亡相关蛋白Bcl-2 和Bax的表达,并分析caspase-3和caspase-9的活性,我们发现,DEK表达下调能显著降低胃癌细胞中p65蛋白的表达,提示DEK表达下调能抑制胃癌细胞中NF-κB信号途径。进一步的研究显示,DEK表达下调能显著增加caspase-3和caspase-9的活性,提高Bax的表达和降低Bcl-2的表达。这些结果提示DEK表达下调介导的胃癌细胞凋亡与NF-κB信号途径的抑制或失活密切相关,并与凋亡相关蛋白的活性或表达变化密切相关。
总之,我们的结果显示,DEK siRNA能显著下调胃癌细胞中DEK mRNA和蛋白的表达,其表达下调能诱导胃癌细胞凋亡,这与NF-κB信号途径的抑制密切相关,并使得caspase-3和caspase-9的活性以及Bax的表达升高和Bcl-2的表达降低,从而导致胃癌细胞凋亡的发生,因此,DEK可能成为新的胃癌治疗的分子靶点。
[参考文献]
[1]Brenner H,Rothenbacher D,Arndt V.Epidemiology of stomach cancer[J].Methods Mol Biol,2009,472: 467-477.
[2]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61( 2) : 69-90.
[3]Bray F,Ren JS,Masuyer E,et al.Global estimates of cancer prevalence for 27 sites in the adult population in 2008[J].Int J Cancer,2013,132( 5) : 1133-1145.
[4]Lee JH,Kim KM,Cheong JH,et al.Current management and future strategies of gastric cancer[J].Yonsei Med J,2012,53( 2) : 248-257.
[5]Hohenberger P,Gretschel S.Gastric cancer[J].Lancet,2003,362( 9380) : 305-315.
[6]Jackson C,Cunningham D,Oliveira J.Gastric cancer: ESMO clinical recommendations for diagnosis,treatment and follow-up[J].Ann Oncol,2009,20( Suppl 4) : 34-36.
[7]von Lindern M,Fornerod M,van Baal S,et al.The translocation ( 6; 9),associated with a specific subtype of acute myeloid leukemia,results in the fusion of two genes,dek and can,and the expression of a chimeric,leukemia-specific dek-can mRNA[J].Mol Cell Biol,1992,12( 4) : 1687-1697.
[8]Khodadoust MS,Verhaegen M,Kappes F,et al.Melanoma proliferation and chemoresistance controlled by the DEK oncogene[J].Cancer Res,2009,69( 16) : 6405-6413.
[9]Gamble MJ,Fisher RP.SET and PARP1 remove DEK from chromatin to permit access by the transcription machinery[J].Nat Struct Mol Biol,2007,14( 6) : 548-555.
[10]Shibata T,Kokubu A,Miyamoto M,et al.DEK oncoprotein regulates transcriptional modifiers and sustains tumor initiation activity in high-grade neuroendocrine carcinoma of the lung[J].Oncogene,2010,29( 33) : 4671-4681.
[11]Riveiro-Falkenbach E,Soengas MS.Control of tumorigenesis and chemoresistance by the DEK oncogene[J].Clin Cancer Res,2010,16( 11) : 2932-2938.
[12]Wang X,Lin L,Ren X,et al.High expression of oncoprotein DEK predicts poor prognosis of small cell lung cancer[J].Int J Clin Exp Pathol,2014,7( 8) : 5016-5023.
[13]Privette Vinnedge LM,Benight NM,Wagh PK,et al.The DEK oncogene promotes cellular proliferation through paracrine Wnt signaling in Ron receptor-positive breast cancers[J].Oncogene,2015,34( 18) : 2325-2336.
[14]Adams AK,Hallenbeck GE,Casper KA,et al.DEK promotes HPV-positive and -negative head and neck cancer cell proliferation[J].Oncogene,2015,34( 7) : 868-877.
[15]Lin LJ,Chen LT.The role of DEK protein in hepatocellular carcinoma for progression and prognosis[J].Pak J Med Sci,2013,29( 3) : 778-782.
[16]Lin L,Piao J,Gao W,et al.DEK over expression as an independent biomarker for poor prognosis in colorectal cancer[J].BMC Cancer,2013,13: 366.
[17]Piao J,Shang Y,Liu S,et al.High expression of DEK predicts poor prognosis of gastric adenocarcinoma[J].Diagn Pathol,2014,9: 67.
[18]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25( 4) : 402-408.
[19]Kappes F,Burger K,Baack M,et al.Subcellular localization of the human proto-oncogene protein DEK[J].J Biol Chem,2001,276( 28) : 26317-26323.
[20]Hanahan D,Weinberg RA.Hallmarks of cancer: the next generation[J].Cell,2011,144( 5) : 646-674.
[21]Wise-Draper TM,Allen HV,Jones EE,et al.Apoptosis inhibition by the human DEK oncoprotein involves interference with p53 functions[J].Mol Cell Biol,2006,26 ( 20) : 7506-7519.
[22]Liu K,Feng T,Liu J,et al.Silencing of the DEK gene induces apoptosis and senescence in CaSki cervical carcinoma cells via the up-regulation of NF-kappaB p65[J].Biosci Rep,2012,32( 3) : 323-332.
[23]Kim DW,Chae JI,Kim JY,et al.Proteomic analysis of apoptosis related proteins regulated by proto-oncogene protein DEK[J].J Cell Biochem,2009,106 ( 6) : 1048-1059.
[24]费洪荣,陈洪蕾,辛晓明,等.Akt抑制剂perifosine抑制胃癌细胞增殖并诱导凋亡的实验研究[J].中国病理生理杂志,2011,27( 6) : 1084-1089.
[25]Lee CH,Jeon YT,Kim SH,et al.NF-kappaB as a potential molecular target for cancer therapy[J].Biofactors,2007,29( 1) : 19-35.
[26]张彩凤,夏永华,李贞娟,等.Stathmin siRNA抑制人胃癌SGC-7901细胞裸鼠移植瘤的生长并诱导细胞凋亡[J].中国病理生理杂志,2012,28( 7) : 1253-1257.
[27]Gross A,McDonnell JM,Korsmeyer SJ.BCL-2 family members and the mitochondria in apoptosis[J].Genes Dev,1999,13( 15) : 1899-1911.
[28]费洪荣,赵莹,王桂玲,等.PI3K/mTOR双重抑制剂PF-04691502诱导人胃癌SGC-7901细胞凋亡[J].中国病理生理学杂志,2013,29( 11) : 1962-1965.
Downregulation of DEK induces cell apoptosis via inhibition of NF-κB signaling pathway in gastric carcinoma SGC-7901 cells
ZHANG Cai-feng1,DONG Liang-peng2,XIA Yong-hua3,GUO Xiao-he1,ZHANG Li-li1,ZHOU Hui-cong1,ZHANG Lan-fang1,LI Zhen-juan1,HAN Yu1
(1Department of Gastroenterology,2Department of General Surgery,3Department of Dermatology,The First Affiliated Hospital of Xinxiang Medical University,Weihui 453100,China.E-mail: zhangcaifeng666@163.com)
[ABSTRACT]AIM: To investigate the effect of DEK downregulation on the apoptosis of gastric carcinoma SGC-7901 cells,and to explore its associations with NF-κB signaling pathway and apoptosis related proteins.METHODS: SGC-7901 cells with different treatments were divided into 3 groups including untreated group,control siRNA group and DEK siRNA group.The expression of DEK at mRNA and protein levels in the SGC-7901 cells was detected by real-time PCR and Western blot.The cell apoptosis was examined by flow cytometry.Furthermore,the activities of caspase-3 and caspase-9 in the SGC-7901 cells were investigated by Caspase-Glo-3/9 kit.Finally,the expression of key regulatory protein p65 of NF-κB signaling pathway and apoptosis-related proteins Bcl-2 and Bax in the SGC-7901 cells was investigated by Western blot.RESULTS: Compared with untreated group and control siRNA group,the expression of DEK at mRNA and protein levels was significantly downregulated in DEK siRNA group ( P<0.05).In addition,the ratios of early phase apoptosis and total apoptosis in DEK siRNA group were markedly higher than those in untreated group and control siRNA group ( P<0.05).Most notably,the decrease in p65 and Bcl-2 proteins,increase in Bax protein and the increases of caspase-3 and caspase-9 activities were observed in DEK siRNA group.CONCLUSION: Downregulation of DEK mediates cell apoptosis of gastric carcinoma may be tightly associated with NF-κB signaling pathway.
[KEY WORDS]Gastric carcinoma; DEK; Apoptosis; NF-κB signaling pathway
通讯作者△Tel: 0373-4402216; E-mail: zhangcaifeng666@163.com
*[基金项目]河南省教育厅科技攻关项目( No.2009B320008) ;河南省卫生厅科技攻关项目( No.200804055) ;新乡医学院科研培育基金( No.2013QN128)
[收稿日期]2014-12-29[修回日期]2015-05-19
[文章编号]1000-4718( 2015)07-1197-06
[中图分类号]R730. 23; R735. 2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.008
