VEGF/bFGF复合多肽疫苗对雌性小鼠的毒性及其生殖的影响*
2015-05-16翁锐强彭卉彤吕成定暨南大学生命科学技术学院抗体工程研究中心广东省分子免疫与抗体工程重点实验室广东广州510632
翁锐强,潘 磊,彭卉彤,吕成定,邓 宁(暨南大学生命科学技术学院抗体工程研究中心,广东省分子免疫与抗体工程重点实验室,广东广州510632)
VEGF/bFGF复合多肽疫苗对雌性小鼠的毒性及其生殖的影响*
翁锐强,潘磊,彭卉彤,吕成定,邓宁△
(暨南大学生命科学技术学院抗体工程研究中心,
广东省分子免疫与抗体工程重点实验室,广东广州510632)
[摘要]目的:初步探究血管内皮生长因子( VEGF) /碱性成纤维细胞生长因子( bFGF)复合多肽疫苗( VEGF/bFGF complex peptide vaccine,VBP3)对雌性小鼠的毒性及其生殖的影响。方法:通过镍离子亲和层析柱纯化VBP3蛋白,将纯化获得的VBP3免疫雌性BALB/c小鼠,酶联免疫吸附实验( ELISA)方法检测小鼠血清抗体效价和特异性,监测亲本小鼠体重,测定亲本小鼠脏器重量并对小鼠脏器进行HE染色观察;将免疫小鼠与未免疫雄性小鼠交配后,测定F1代小鼠存活率、体重、相关脏器重量,并对相关脏器进行HE染色观察。结果:间接ELISA检测结果显示免疫小鼠血清中抗VEGF、抗bFGF抗体滴度分别为1∶3 000、1∶20 000,且免疫组F1代小鼠能检测出低滴度的抗bFGF抗体,但抗VEGF抗体不能检出。在小鼠生产率实验中,免疫组与对照组崽鼠数目未见明显差异,但免疫组F1代小鼠存活率较对照组降低( P<0.05)。在亲本小鼠中,免疫组小鼠各脏器重量与对照组比较均未有差异,而在F1代小鼠中,2个组别的小鼠肝脏重量存在差异,但其它脏器重量未有差异; HE染色显示,在亲本小鼠中,2个组别小鼠的各脏器形态未有明显差异;在F1代小鼠中,免疫组F1代小鼠的肝脏与对照组相比存在形态差异。结论: VEGF/bFGF复合多肽疫苗未对亲本小鼠主要脏器造成直接损伤,但对亲本小鼠的生殖及F1代小鼠健康具有一定的影响。
[关键词]血管内皮生长因子;碱性成纤维细胞生长因子;多肽疫苗
在肿瘤发生发展及转移等一系列的生理活动中,新血管的形成是必不可少的,因此在癌症研究领域中,以抑制血管的新生途径被认为是一种重要的、而且有效的抗癌模式[1]。在肿瘤血管新生机制中,发现有许多相关的促血管新生因子,其中血管内皮细胞生长因子( vascular endothelial growth factor,VEGF),碱性成纤维细胞生长因子( basic fibroblast growth factor,bFGF)是目前研究最多的促血管新生因子。肿瘤血管新生的机制,bFGF与VEGF具有协同作用,促进内皮细胞分泌血小板衍生因子( plateletderived growth factor,PDGF)及其受体PDGFRβ,启动PDGF-B-PDGFRβ信号促进肿瘤血管的生长成熟,进而促进肿瘤的生长及转移[1-2]。因此,同时抑制VEGF及bFGF两者的信号途径,阻断与其受体结合可以抑制肿瘤及肿瘤血管的发生发展,为肿瘤的治疗提供更为有效的模式。
VEGF/bFGF复合多肽疫苗( VEGF/bFGF complex peptide vaccine,VBP3)作为一种同时靶向VEGF和bFGF的肿瘤疫苗,它能够在机体体内刺激或诱导机体的免疫系统产生应答反应,产生抗体发挥作用。疫苗作为一种特殊的生物制品,其有效性和安全性是疫苗使用价值的2个重要参考。理想状体下的疫苗是对正常机体不会产生毒副作用的,但由于疫苗本身并不直接发挥作用,而是对机体的免疫系统进行刺激进而发挥作用,因此,在疫苗临床使用前,必须对疫苗的安全性进行评价。在疫苗临床前动物安全性评价过程中,根据对疫苗安全性担忧的各个方面,可以将临床前动物安全性评价概括为几个主要内容: ( 1)急性毒性试验; ( 2)重复给药毒性试验; ( 3)局部刺激性试验; ( 4)过敏性试验; ( 5)生殖毒性试验。由于疫苗是通过诱导机体产生免疫应答而并在过程中可能影响动物胚胎以及幼仔发育[3],因此在生殖毒性试验中,需研究疫苗对动物胚胎和幼仔发育的影响[4]。
本实验室在前期工作中利用生物信息学技术,计算机模拟得到一系列bFGF及VEGF相关的表位,并通过linker将优势表位进行连接构建至pET32a表达载体中进行表达鉴定,并建立起一套纯化、免疫小鼠的试验方法[5]。前期工作也探究了VBP3局部刺激与全身过敏性实验,并发现VBP3对家兔皮下注射的局部刺激反应轻微;豚鼠实验亦未见严重的过敏症状[6]。本研究初步探讨VBP3对小鼠的毒性及对生殖的影响,旨在进一步为VBP3作为一种多肽疫苗的临床前动物安全性评价奠定基础。
材料和方法
1菌株和动物
VBP3工程菌为本实验室构建; SPF级BALB/c小鼠购于南方医科大学动物实验中心,雌性BALB/c小鼠10只,雄性BALB/c小鼠5只,均为4~6周龄。
2主要试剂和仪器
2.1主要试剂bFGF及VEGF购自Prospec; His Tag镍离子柱为GE产品;弗氏完全佐剂( FCA)及弗氏不完全佐剂( FICA)购自Sigma;胰蛋白胨和酵母粉购于OXOID; OTC包埋剂购于Tissue-Tek; HE染色试剂购于艾斯金公司; HRP-羊抗鼠抗体购于博奥森公司,其余常规生化试剂均为国产分析纯。
2.2主要仪器荧光显微镜为Olympus产品;冰冻切片机购自Leica;多功能酶标仪购自Bio-Tec。
3试验方法
3.1VBP3免疫小鼠及效价检测
3.1.1 VBP3免疫BALB/c小鼠依照参考文献[7]制备VBP3复合多肽免疫雌性BALB/c小鼠,每只小鼠皮下多点注射100μg,具体免疫方法参考文献[8]实施。初次免疫将VBP3蛋白与弗氏完全佐剂1∶1体积比例完全乳化后,脚掌、耳缘后侧及皮下多点注射; 2周后进行第2次免疫,将VBP3蛋白与弗氏不完全佐剂1∶1体积比完全乳化,脚掌、耳缘后侧及皮下多点注射;间隔2周后进行第3次免疫,方法同第2次免疫;第3次免疫后10 d尾静脉取血,分离血清收集抗体,间接ELISA方法检测抗体的效价。
3.1.2小鼠血清中抗体效价检测( 1)分别用500 μg/L bFGF或VEGF包被ELISA板,4℃孵育16 h 后PBS-T洗涤3次,每次3 min; ( 2)加入200 μL封闭液(含5%脱脂奶粉的PBS-T溶液) 37℃孵育2 h,PBS-T洗涤3次,每次3 min; ( 3)加入200 μL系列稀释后的小鼠血清,37℃孵育1 h,PBS-T洗涤3次,每次3 min; ( 4)加入200μL辣根过氧化物酶标记的羊抗鼠IgGⅡ抗( 1∶8 000稀释) 37℃孵育45 min,PBST洗涤3次,每次3 min; ( 5) TMB避光显色10 min,2 mol/L硫酸终止显色,酶标仪测定A450值。
3.2检测指标及方法
3.2.1一般情况将免疫及对照组小鼠分别与雄性空白小鼠合笼,7 d后取出雄性小鼠,并实验期间每隔2 d记录小鼠的饮水、摄食和死亡情况;分别记录亲本雌性小鼠的体重、F1代小鼠的出生数、活仔数及F1代小鼠的体重变化情况等。
3.2.2脏器的称重实验结束后,将小鼠摘眼球取血后,迅速分离并剪取心脏、肝脏、脾脏、肺脏、肾脏等脏器,小心去除附着的组织,称重并进行OCT包埋,-80℃冻存。
3.2.3组织切片及HE染色将-80℃冻存的脏器进行冰冻切片,切片厚度为5μm,丙酮固定后进行苏木精液染色、1%盐酸乙醇处理,水返蓝后进行0.5%曙红液染色,最后通过梯度乙醇脱水,二甲苯透化,中性树胶封片风干后即可在显微镜下观察。
4统计学处理
应用SPSS 16.0统计软件进行数据分析,数据以均数±标准差( mean±SD)表示,差异显著性检验采用t检验。对不同时间各组小鼠的体重数据采用双因素方差分析。以P<0.05为差异有统计学意义。
结果
1免疫小鼠及F1代小鼠效价检测
间接ELISA检测抗bFGF抗体效价为1∶20 000,抗VEGF抗体效价为1∶3 000,见图1。免疫组F1代小鼠血清中的抗VEGF抗体效价与对照组相比无明显差异,但免疫组F1代小鼠血清相对对照组能检出低滴度抗bFGF抗体,见图2。
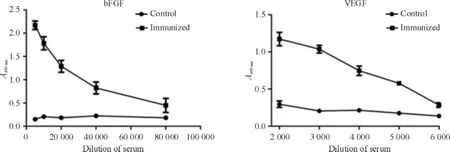
Figure 1.The antibody titer of serum in parent mice.Mean±SD.n =3.图1 亲本小鼠血清中抗体效价的检测
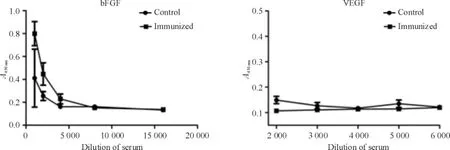
Figure 2.The antibody titer of serum in F1 mice.Mean±SD.n =5.图2 F1代小鼠血清中抗体效价的检测
2 F1代小鼠存活率
免疫组共产崽35只,平均产崽数为7只,共存活19只,存活率为54. 28%;对照组小鼠共产崽26只,平均产崽6.5只,共存活25只,存活率为96. 15%,明显高于免疫组( P<0. 05)。
3 亲本及F1代小鼠体重及脏器比较
免疫组亲本小鼠的体重变化趋势大致与对照组相同,2组之间无明显差异;在F1代小鼠中,2个组别小鼠体重变化趋势基本一致,无明显差异,见图3;在亲本小鼠各脏器重量的比较中,与对照组相比,免疫组小鼠的各脏器重量并无明显区别;但对F1代小鼠各个主要脏器重量的比较发现,免疫组F1代小鼠肝脏重量与对照组有差异,而2个组别的小鼠在脾脏、肾脏、肺脏及心脏的重量比较均未有明显差异,见图4。
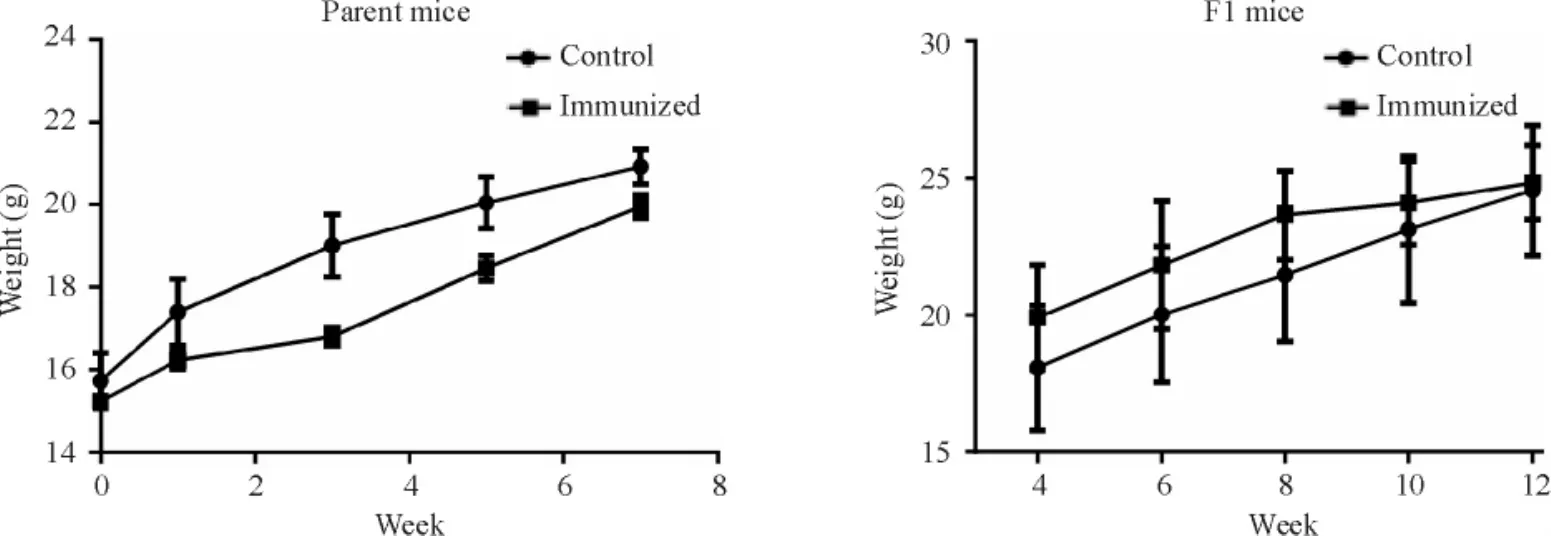
Figure 3.The body weight of the mice.Mean±SD.n =5~10.图3 小鼠体重的监测
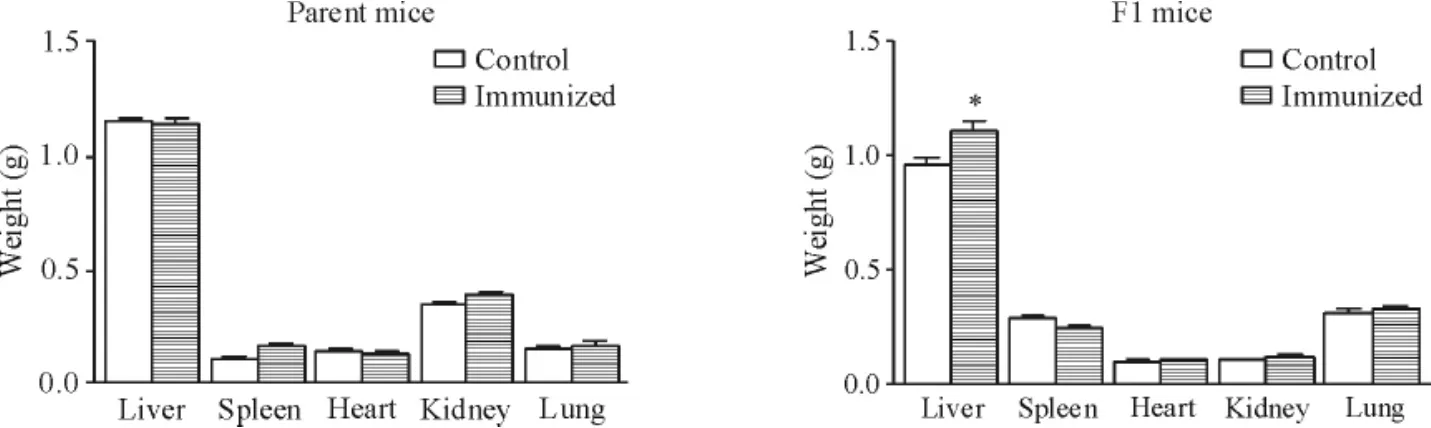
Figure 4.The organ weight of the mice.Mean±SD.n =5.*P<0. 05 vs control.图4 小鼠各脏器重量结果
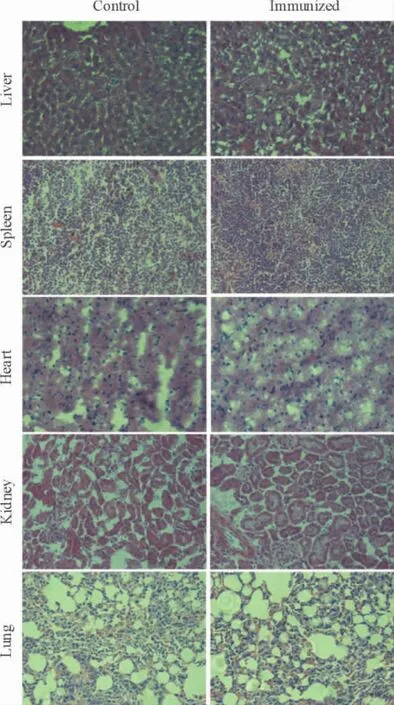
Figure 5.HE staining of organs from parent mice(×400).图5 亲本小鼠各脏器HE染色
4 各脏器的HE染色
亲本小鼠中,2个组别小鼠脏器的HE染色比较中,未有明显的形态差异,见图5;在F1代小鼠中,免疫组小鼠的肝脏细胞形态与对照组相比有差异,在其它的脏器HE染色比较中,2个组别的小鼠则未有明显的形态差异,见图6。
讨论
VBP3是通过将bFGF和VEGF的多个抗原表位通过Linker串联,在原核表达系统中表达获得。在小鼠实验中,该多肽疫苗能够在小鼠体内产生抗bFGF及VEGF的高滴度抗体,并在小鼠黑色素瘤模型中发现,该复合多肽疫苗能够能抑制肿瘤生长及血管新生[5]。然而,VBP3复合多肽疫苗在用于人体之前,其安全性是必须首先考虑的一个方面。实验室前期工作中完成了常规豚鼠主动过敏试验,结果发现VBP3几乎无致敏性,且高剂量的豚鼠均未出现不良或过敏症状[6]。
由于疫苗本身并不直接发挥预防或治疗的作用,而是通过诱导机体产生抗体或活化T细胞发挥作用,因此,疫苗的安全性尤其重要。本研究显示在免疫雌性BALB/c小鼠过程中,免疫组与对照组亲本小鼠生长情况基本一致,无明显差异。在重要器官重量的比较中,2组小鼠亦无明显差异;在HE染色比较中,免疫组与对照组亲本小鼠在各个器官的HE染色则无明显形态差异,结果表明在该实验条件下,VBP3对亲本小鼠的心脏、脾脏、肝脏、肾脏及肺等器官无明显毒性作用。
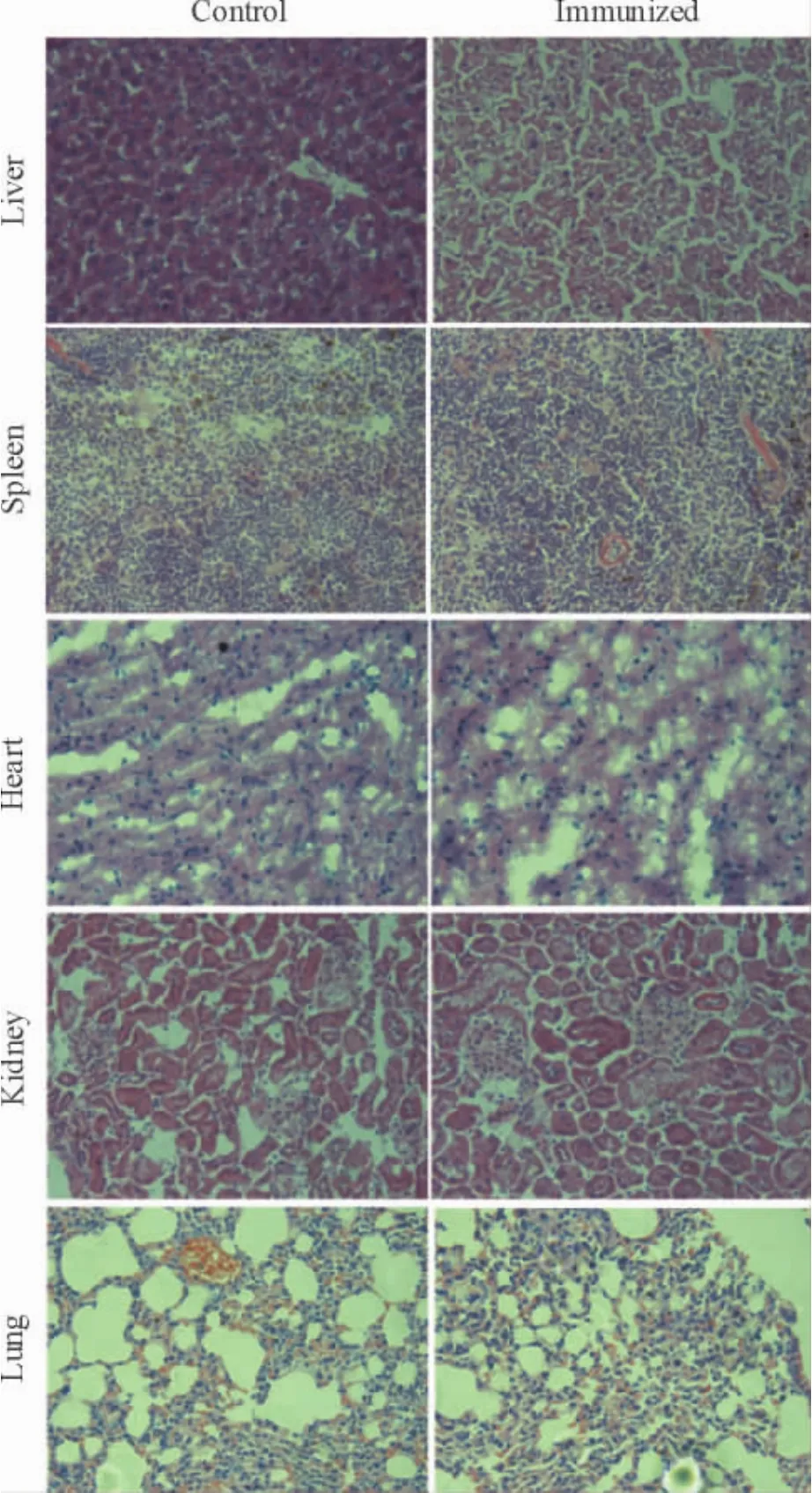
Figure 6.HE staining of organs from F1 mice(×400).图6 F1代小鼠各脏器HE染色
在药物非临床安全性评价中,发育和生殖毒性评价是重要组成部分。其中,发育主要包括胚胎的发育、胎仔的发育及出生幼仔的发育过程,药物发育毒性评价是指药物对在这一系列的发育过程中产生的损害作用进行评价[9]。亲本雌性小鼠与健康雄性小鼠交配后,在小鼠生产数目的比较中,免疫组与对照组未有明显差异存在,但在崽鼠存活率比较中,免疫组幼鼠存活率为54.28%,相对对照组(存活率94.15%)有差异。据相关文献报道,靶向VEGF、bFGF抗体均可抑制血管的新生[10-11],在小鼠胚胎发育过程中需要新生血管供给,而血管网络的建成需要VEGF、bFGF等细胞因子促趋化血管内皮细胞迁移形成血管[12]。我们推断,VBP3免疫小鼠后所产生的抗体可能会中和bFGF和VEGF的作用,进而抑制或延缓小鼠胚胎发育过程中的血管的新生,影响小鼠胚胎的发育,从而导致免疫组F1幼鼠的存活率的降低,其具体机制仍需进一步研究。在对F1代小鼠的检测指标监测中,其体重变化趋势、基本一致,未有明显差异。在各脏器的HE染色中,免疫组与对照组中的心脏、脾脏和肾脏中未有明显的形态变化,但在肝脏的比较中发现,在F1代小鼠的肝脏HE染色比较中,免疫组F1代小鼠的肝脏细胞间间隔较大,部分细胞呈弥散形,且存在较多空泡状的细胞。
[参考文献]
[1]Kano MR,Morishita Y,Iwata C,et al.VEGF-A and FGF-2 synergistically promote neoangiogenesis through enhancement of endogenous PDGF-B-PDGFRβ signaling [J].J Cell Sci,2005,118( Pt 16) : 3759-3768.
[2]Sufen G,Xianghong Y,Yongxia C,et al.bFGF and PDGF-BB have a synergistic effect on the proliferation,migration and VEGF release of endothelial progenitor cells [J].Cell Biol Int,2011,35( 5) : 545-551.
[3]张若明.疫苗的临床前安全性评价[J].中国新药杂志,2008,17( 13) : 1176-1179.
[4]梁昊宇.新疫苗和佐剂的临床前安全性评价[J].国际生物制品学杂志,2006,29( 4) : 163-165.
[5]王宏,朱中松,杨琴,等.bFGF与VEGF抗原表位筛选及复合肽的表达鉴定[J].免疫学杂志,2010,26 ( 8) : 688-693.
[6]康艳丽,王宏,向军俭,等.抑制肿瘤血管新生的复合肽VBP3局部刺激与全身过敏性实验[J].中国病理生理杂志,2011,27( 1) : 113-118.
[7]潘磊,张晋霞,王金胜,等.VEGF/bFGF复合多肽抗体的制备及对卵巢癌细胞增殖抑制作用[J].免疫学杂志,2014,30( 6) : 512-515.
[8]杨晶,王金胜,张辉挺,等.人源性EGFL6的重组表达及多克隆抗体制备研究[J].免疫学杂志,2013,29 ( 6) : 517-521.
[9]袁芳,潘晓靓,林海霞,等.生物技术药物的发育和生殖毒性评价[J].中国医药工业杂志,2012,43( 1) : 73-78.
[10]Li D,Wang H,Xiang JJ,et al.Monoclonal antibodies targeting basic fibroblast growth factor inhibit the growth of B16 melanoma in vivo and in vitro[J].Oncol Rep,2010,24( 2) : 457-463.
[11]Feflea S,Cimpean AM,Ceausu RA,et al.Effects of antibodies to EG-VEGF on angiogenesis in the chick embryo chorioallantoic membrane[J].In Vivo,2012,26( 5) :793-797.
[12]Lamalice L,Le Boeuf F,Huot J.Endothelial cell migration during angiogenesis[J].Circ Res,2007,100( 6) : 782-794.
Effect of VEGF/bFGF complex peptide vaccine on toxicity and reproductivity in female-mice
WENG Rui-qiang,PAN Lei,PENG Hui-tong,LU Cheng-ding,DENG Ning
( Antibody Engineering Center,Guangdong Province Key Laboratory of Molecular Immunology and Antibody Engineering,College of Life Science and Technology,Jinan University,Guangzhou 510632,China.E-mail: tdengn@ jnu.edu.cn)
[ABSTRACT]AIM: To investigate the toxicity and reproductive effect of vascular endothelial growth factor ( VEGF) /basic fibroblast growth factor ( bFGF) complex peptide vaccine ( VBP3) on the female-mice.METHODS: The VBP3 was purified with Ni-NTA affinity chromatography.The female BALB/c mice were immunized with the purified VBP3.The antibody titer in the serum was detected by ELISA.The data of the body weight and the organ weight of the parent mice were gathered and analyzed,and the pathological changes of the organs were observed with HE staining to investigate the toxicity of VBP3.To investigate the toxicity of VBP3 in the F1 mice,the parent immunized female mice were mated with the parent non-immunized male mice.After the F1 mice were born,the survival rate was calculated,the change of the body weight and the organ weight of the F1 mice were also determined.The pathological changes of the organs in F1 mice were also observed with HE staining.RESULTS: In the parent mice,high titers of the antibodies were detected against VEGF and bFGF,and no difference of the body weight,the organ weight and the pathological change between the immunized mice and control mice was found.In the F1 mice,a low titer of anti-bFGF antibody was detected compared with blank group.The survival rate in control group was higher than that in immunized group.In the 2 groups of the F1 mice,no obvious difference of the weight of the spleen,kidney,lung and heart was observed,and there was some difference in the weight of liver between the 2 groups.The results of the HE staining in the F1 mice showed some difference in the liver between the 2 groups.CONCLUSION: VEGF/bFGF complex peptide vaccine has no obvious organ toxicity in the parent female mice,but has some side effects on the reproductive and the healthy processes of F1 mice.
[KEY WORDS]Vascular endothelial growth factor; Basic fibroblast growth factor; Peptide vaccine
通讯作者△Tel: 020-85223259; E-mail: tdengn@ jnu.edu.cn
*[基金项目]国家自然科学基金资助项目( No.81372281) ;深圳市科技计划项目( No.JCYJ20140416085544636)
[收稿日期]2015-03-02[修回日期]2015-05-15
[文章编号]1000-4718( 2015)07-1184-05
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.006
