胸廓内动脉参与肝癌供血介入栓塞后皮肤损伤的发生及预防
2015-05-10宋鹏吴宁林福煌李斯锐陈峰
宋鹏 吴宁 林福煌 李斯锐 陈峰
肿瘤介入
胸廓内动脉参与肝癌供血介入栓塞后皮肤损伤的发生及预防
宋鹏 吴宁 林福煌 李斯锐 陈峰
目的 探讨胸廓内动脉(ITA)参与肝癌供血行介入栓塞治疗后皮肤损伤的发生特点及预防措施。方法 对26例经血管造影确认有ITA参与肝癌供血者行ITA栓塞治疗。26例患者既往行TACE治疗2~6次,5例有肝切除病史。其中16例用碘油-抗癌药物乳剂栓塞,10例用碘化油及明胶海绵颗粒进行栓塞。8例用微导管行超选择性肿瘤供血动脉栓塞。术后观察并随访患者前胸壁及肝区皮肤变化。结果 26例患者ITA参与肝癌供血者,右侧ITA 24例,左侧ITA 3例。19例介入治疗后出现不同程度前胸壁及肝区皮肤灼热感或针刺样疼痛。5例出现明显皮肤损伤,其中3例损伤皮肤出现破溃,1例继发感染。5例患者均应用碘油-抗癌药物乳剂行非选择性ITA栓塞。随诊1~4个月后5例均结痂愈合。结论 皮肤损伤是经导管介入栓塞ITA的常见并发症,应用碘油-抗癌药物乳剂非选择性栓塞ITA是造成皮肤损伤的主要原因。
皮肤损伤; 肝肿瘤; 胸廓内动脉; 动脉造影; 栓塞,治疗性
侧支动脉参与肿瘤供血是肝癌介入治疗后肿瘤残存与复发的重要原因[1-3],因此如何及时发现并正确处理参与肿瘤侧支供血动脉,已成为当前肝癌介入治疗的棘手问题。既往研究发现,参与肝脏肿瘤供血的侧支血管多达20余支,其中发自锁骨下动脉的胸廓内动脉(internal thoracic artery, ITA)是较常见的重要供血血管[4-7],因此栓塞包括ITA在内的侧支动脉已成为常规经导管肝动脉栓塞化疗术(transarterial chemoembolization, TACE)的重要补充技术。既往报道已将ITA的插管技术、栓塞方法及疗效做了报道,此次我们通过介入栓塞26例ITA明确参与肝脏肿瘤供血者,对ITA栓塞治疗后皮肤损伤的发生规律、发生原因及防治措施做一总结。
对象与方法
一、一般资料
收集2010年1月—2015年8月26例患者,其中男性29例,女性7例,年龄38~75岁(平均53岁),诊断为肝癌5~36个月。肝癌的诊断:①病理学证实;②无病理学结果,但符合以下3项标准:具有肝硬化以及HBV和(或)HCV感染证据;CT和(或)MRI符合肝癌表现;甲胎蛋白值>400 ng/ml。全部病例均曾行2~6次TACE,5例有外科手术史。全部患者均有2周内影像学检查资料,包括超声(US)、胸部X线片、CT和(或)磁共振(MRI)检查。术前1周内复查肝功能、血常规、凝血指标及肿瘤标记物甲胎蛋白(AFP)。
二、介入治疗方法
1.适应证:ITA造影的指征有:①肝癌累及S4、S5、S8段,特别是接近膈肌或(和)肝包膜;②常规TACE后,碘油充盈病灶不完整,周边残留活性病变;③肝动脉造影显示的病灶与CT和MRI所见不一致,肝动脉不是残余肿瘤的主要供血血管致。
2.ITA对比剂栓塞技术:对比将4F眼镜蛇导管或3F同轴微导管选择性插至ITA,使用高压注射器压力为300~500psi(磅/平方英寸);速度为1.5~2.0 ml/s,对比剂用量为6~8 ml。当造影确认有ITA参与肿瘤供血后即可进行栓塞治疗,肿瘤供血分支显示明显者,使用微导管者尽可能将导管插至肿瘤供血分支行超选择栓塞。栓塞材料包括碘油-抗癌药物乳剂(表阿霉素、奥沙利铂/洛铂、碘油)、碘油、明胶海绵颗粒,先注入碘油-抗癌药物乳剂或纯碘油,然后用明胶海绵颗粒进行栓塞。
三、观察内容
详细记录ITA栓塞术中及术后患者临床表现以及栓塞后患者前胸部、肝区皮肤变化及预后。
结 果
26例均曾接受2次以上TACE治疗,有外科手术史者5例(4.7%),造影均显示ITA 增粗,并有明确肿瘤染色,未见动静脉瘘及异常交通。其中右侧ITA 24例(图1),左侧3例(图2),1例患者双侧ITA均参与肝脏肿瘤供血。
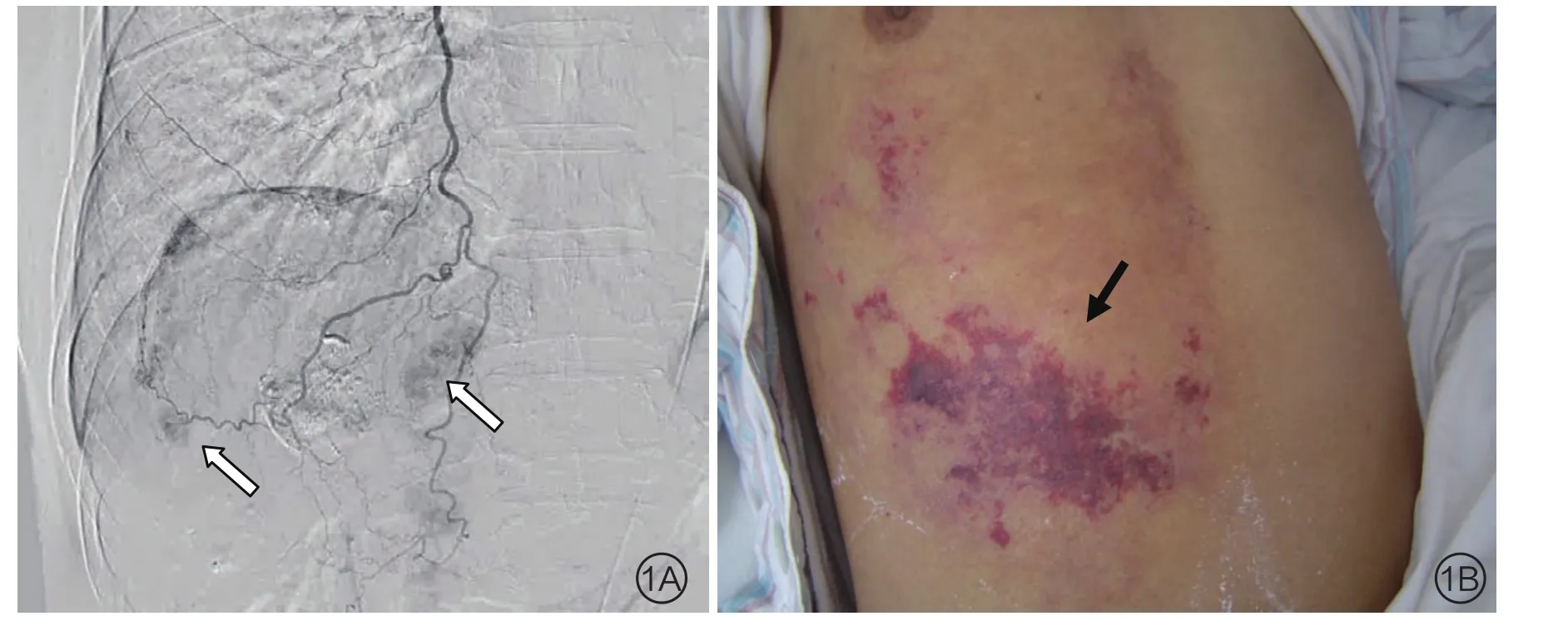
图1 患者男,47岁,肝癌,既往行4次TACE,RITA造影可见肝内多发肿瘤染色(箭,A),用碘油-抗癌药物乳剂行非超选择性栓塞治疗后第6天, 肝区可见明显的皮肤损伤(箭,B)局部伴有水泡
8例患者使用同轴微型导管插至肿瘤供血分支行超选择栓塞,均应用碘油-抗癌药物乳剂型治疗,用量1~4 ml(平均1.6 ml),3例术后出现前胸壁及肝区皮肤轻度针刺样疼痛,经止痛对症治疗1天后消失,皮肤未见异常。
18例患者未行超选择栓塞,其中8例患者应用碘油-抗癌药物乳剂栓塞,用量2.0~5.5 ml(平均3.2 ml),术后均出现前胸壁及肝区皮肤针刺、烧灼样疼痛,疼痛感觉明显且持续时间长,5例1周内出现明显的皮肤损伤(图1),表现为前胸壁及肝区皮肤点片状淤斑,伴或不伴水泡,分布基本与血管走行一致,范围较局限,其中3例损伤面积较大局部皮肤出现坏死、破溃,1例出现坏死部位感染,1~4个月后5例患者受损皮肤均结痂愈合。
其余10例非超选择栓塞者应用纯碘油治疗,用量2.0~4.5 ml(平均2.8 ml),8例术后出现前胸壁及肝区皮肤轻度针刺样或烧灼样疼痛,经止痛对症治疗2~5天内消失,皮肤未见明显损伤表现。

图2 患者男,53岁,肝癌,既往行3次TACE,LITA造影可见肝内肿瘤染色(箭,A),将同轴微导管超选择性插至肿瘤供血分支(肌膈动脉,箭)行超选择性栓塞治疗后,病变碘油聚集良好(箭,B),术后未见皮肤损伤
术后4周26例患者复查CT显示ITA供血区病变碘油聚集优良。
不同栓塞技术皮肤损伤统计见表1。

表1 不同栓塞技术皮肤损伤统计
讨 论
1.ITA参与肝肿瘤供血的解剖学基础:肝脏肿瘤行多次TACE后肝动脉发生狭窄或闭塞后,肝外侧支血管参与供血临床很常见,ITA是常见侧支血管之一[1-7]。ITA开口位于锁骨下动脉下缘,沿胸骨外侧、胸廓前壁下行,沿途发出前肋间动脉、纵隔支、心包膈动脉、前穿支动脉、胸骨动脉等,至第6肋软骨水平后分为肌膈动脉和腹壁上动脉两个终支[6-7]。ITA参与肝肿瘤供血的方式有:①间接途径:心包膈动脉、肌膈动脉、腹壁上动脉有分支与膈下动脉存在吻合,膈下动脉分支在肝脏裸区直接与肝脏相邻,常有小分支参与肝脏。②直接途径:右上腹壁动脉除发出分支至前腹壁和腹直肌外,尚有一分支经镰状韧带与肝动脉分支吻合[6-10]。
2.ITA参与肝肿瘤供血的特点:结合文献及笔者经验在以下情况时应考虑ITA参与肝肿瘤供血的可能:①肿瘤位于肝脏前部,并邻近膈肌侵犯肝包膜;②肝前部肿瘤术后复发,局部粘连侧支建立;③既住行多次TACE,腹腔动脉-肝动脉、肠系膜上动脉、膈下动脉造影均未见肿瘤供血动脉[3-4]。此外腹部增强CT,若在膈顶附近层面见到明显增粗的ITA血管影,亦是ITA 参与肝肿瘤供血的佐证。如果肿瘤位于肝左叶前部,应当考虑左侧ITA参与肝脏供血的可能[11-14]。在本组病例中有3例存在左侧ITA参与肝肿瘤供血。
3.皮肤损伤是ITA介入栓塞治疗后最常见的并发症[6-7,15-17]:ITA 插管技术并不复杂,用4F眼镜蛇导管配以超滑导丝即可插入ITA主干,少数开口变异者,可考虑用3F同轴微导管。但由于ITA行程长、沿途分支多、普通4F导管超选择插管困难等因素,非病变支发生误栓的机率较高[6-7,15-17]。前肋间动脉、腹壁上动脉是前胸腹壁皮肤及深部肌肉组织的主要供血动脉,当碘油-抗癌药物乳剂流入发生误栓,碘油的机械性栓塞以及化疗药物毒性在局部的缓慢释放便导致皮肤损伤的发生。临床表现为局部皮肤疼痛,进而发展为皮肤点片状淤斑,伴或不伴水泡,严重者会出现皮肤坏死破溃。本组病例8例患者应用碘油-抗癌药物乳剂行ITA非超选择性栓塞,术后均出现局部皮肤疼痛,其中5例出现明显的皮肤损伤,损伤部位与ITA分支供血部位相同,损伤范围与严重程度与药物注入量呈正相关。其余18例患者均为出现明显的皮肤损伤。
4.皮肤损伤的处理:范围较小的早期损伤可使用氢化可的松、透明质酸酶、利多卡因三联药物皮下封闭。糖皮质激素氢化可的松可以稳定局部组织细胞膜,降低血管通透性,抑制炎症细胞活性,减轻化疗药物对组织的损伤,减轻中毒症状;透明质酸酶可以增加局部胶原组织的通透性,促进渗出液的吸收,减轻局部组织的水肿;利多卡因可减轻局部疼痛, 降低患者痛苦。三联药物的使用既可减轻化疗药物直接引起的组织损伤又可限制机体自身的炎症过程。对于大面积的不可逆的皮肤坏死,处理重点是防止损伤部位皮肤破损感染、缓解疼痛、改善微循环以及促进组织细胞再生[16-17],临床上可选用的药物有利多卡因凝胶、如意金黄散、康复新液等,如发生感染可局部涂抹外用抗生素,不建议预防性涂抹抗生素。如坏死范围大且伴有皮肤深层组织坏死,短期内难以恢复者可考虑行植皮手术。与一般的皮肤损伤不同,ITA化疗栓塞后的皮肤损伤往往伴有损伤部位的缺血以及皮下组织甚至肌肉组织的损伤,因此损伤愈合较慢,本组5例皮肤损伤的患者1~4个月内皮肤愈合,均未行植皮手术。
1 Paul SB, Gamanagatti SR, Mukund A, et al. Transarterial chemoembolization for hepatocellular carcinoma: significance of extrahepatic collateral supply[J]. Indian J Cancer, 2011,48(3):339-344.
2 Miyayama S, Matsui O, Taki K, et al. Extrahepatic blood supply to hepatocellular carcinoma: angiographic demonstration and transcatheter arterial chemoembolization[J]. Cardiovasc Intervent Radiol, 2006,29(1):39-48.
3 Wang YL, Li MH, Cheng YS, et al. Infuential factors and formation of extrahepatic collateral artery in unresectable hepatocellular carcinoma[J]. World J Gastroenterol, 2005,11(17):2637-2642.
4 Fan QS, Huo XK, Wang MQ, et al. Effcacy and safety of transcatheter chemo- embolization of the internal thoracic artery in patients with hepatocellular carcinoma[J]. Chin Med J (Engl), 2011,124(9):1374-1380.
5 Nakai M, Sato M, Kawai N, et al. Hepatocellular carcinoma: involvement of the internal mammary artery[J]. Radiology, 2001,219(1):147-152.
6 王茂强,张金山,高育傲.胸廓内动脉参与肝脏肿瘤供血的影像表现与介入治疗(附6例报告)[J]. 临床放射学杂志,1998,17(1):47-49.
7 李强,王茂强,宋鹏,等.内乳动脉参与肝癌供血的介入治疗[J].介人放射学杂志,2007,16 (12):816-819.
8 Jonsson K, Karlsson S. Angiography of the internal mammary artery[J]. Acta Radiol, 1985,26(2):113-120.
9 Baba Y, Hokotate H, Nakajo M. Visualization of the internal mammary artery via the hepatic falciform artery in a patient with hepatocellular carcinoma[J]. Acta Radiol, 2004,45(7):716-717.
10 Kim HC, Chung JW, Choi SH, et al. Hepatocellular carcinoma with internal mammary artery supply: feasibility and effcacy of transarterial chemoembolization and factors affecting patient prognosis[J]. J Vasc Interv Radiol, 2007,18(5):611-619.
11 Kim SH, Kim HC, Hur S, et al. Chemoembolization via the left internal mammary artery supplying hepatocellular carcinoma[J]. J Vasc Interv Radiol, 2014,25(9):1389-1397.
12 Kanetsuki I, Hori A, Ohshiro K, et al. Left lobe recurrent hepatocellular carcinoma treated with lipiodol-TAE via the left internal mammary artery[J]. Cardiovasc Intervent Radiol,1997,20(5):387-389.
13 Miyayama S, Yamashiro M, Hashimoto M, et al. Clinical features of hepato- cellular carcinoma supplied by the left internal mammary artery[J]. Jpn J Radiol, 2012,30(10):798-805.
14 Miyayama S, Yamashiro M, Shibata Y, et al. Variations in feeding arteries of hepatocellular carcinoma located in the left hepatic lobe[J]. Jpn J Radiol, 2012,30(6):471-479.
15 Zhang J, Hu J, Xia P, et al. Spinal complication after transcatheter arterial chemo- embolization via right internal mammary artery in a patient with hepatocellular carcinoma[J]. J Vasc Interv Radiol, 2013,24(12):1930-1932.
16 Kajiwara K, Kakizawa H, Takeuchi N, et al. Cutaneous complications after trans- catheter arterial treatment for hepatocellular carcinoma via the internal mammary artery: how to avoid this complication[J]. Jpn J Radiol, 2011,29(5):307-315.
17 Lee JH, Chon CY, Ahn SH, et al. An ischemic skin lesion after chemoembolization of the right internal mammary artery in a patient with hepatocellular carcinoma[J]. Yonsei Med J, 2001,42(1):137-141.
Skin injury after embolization of ITA participating in blood supply of liver cancer
Song Peng, Wu Ning, LinFuhuang, Li Sirui, Chen Feng. Department of Interventional Radiology, Hainan General Hospital, Haikou 570311, China
Wu Ning, Email: 13307505266@163.com
Objective To explore the characteristics and the preventive measures of skin injury after interventional embolization of internal thoracic artery (ITA) participating in the blood supply of liver cancer. Methods ITA embolization was performed in 26 hepatic carcinoma patients confirmed to be the tumor blood supply arteries by angiography. All of the 26 patients had received TACE treatment for 2 to 6 times, and 5 of them had received liver resection. A total of 16 patients received ITA embolization by lipiodol antineoplastic emulsion, but lipiodol and Gelfoam were used in the other 10 patients. Eight cases received super selective embolization with microcatheter. Observe and follow-up the change of the anterior chest wall skin. Results Twenty-four of the 26 patients received RITA embolization, 3 received LITA embolization, and 1 patient received both RITA and LITA embolization. After interventional therapy, 19 patients experienced different degree of burning sense and stabbing pain in the skin of anterior chest wall and liver area. Obvious skin injury occurred in 5 cases, and 3 of them appeared damaged skin rupture, and 1 case got secondary infection. All of the 5 patients got non-selective ITA embolization with lipiodol antineoplastic emulsion, and they all healed in 1—4 months. Conclusions Non-selective ITA embolization with lipiodol antineoplastic emulsion is the main cause of the skin damage.
Skin injury; Liver neoplasms; Internal thoracic artery; Angiography; Embolization, therapeutic
2014-11-4)
(本文编辑: 黄强)
10.3877/cma.j.issn.2095-5782.2015.03.007
570311 海口,海南省人民医院放射介入科(宋鹏、吴宁、林福煌、李斯锐、陈峰)
吴宁,Email:13307505266@163.com
宋鹏,吴宁,林福煌,等.胸廓内动脉参与肝癌供血介入栓塞后皮肤损伤[J/CD].中华介入放射学杂志:电子版, 2015,3(3):140-143.
