腹痛、发热及肝脏多发占位为主要表现的肝内胆管细胞癌1例
2015-04-27吴道宏柴宁莉陈思文徐世平
吴道宏,柴宁莉,陈思文,徐世平
(解放军总医院南楼临床部消化科,北京 100853)
1 病例摘要
患者,男性,64岁,因“间断右上腹痛1个月,加重伴发热6d”于2014年4月1日入院。患者2014年3月2日无明显诱因出现右上腹针刺样疼痛,多于夜间发作,持续5~6h自行缓解,偶有阵发性加剧,呈绞痛,持续约10min能自行缓解,伴恶心,无肩背部放射痛,无反酸、烧心,无厌油、纳差,无腹泻,自觉发热,未测体温。未予治疗。3月25日凌晨4∶50睡眠中突发右上腹剧烈绞痛,伴畏寒、发热,测体温最高升至38.1℃,至海军总医院就诊。血象、血沉、C-反应蛋白及血清转氨酶升高(具体值不详),以急性胆囊炎收住院,予禁食、头孢噻肟钠舒巴坦钠(cefotaxime sodium and sulbactam sodium)+奥硝唑(ornidazole),后改为比阿培南(biapenem)+奥硝唑抗感染、保肝、补液及对症支持治疗,体温和血象有下降趋势,腹痛减轻,但血清转氨酶仍进行性升高。化验血清肿瘤标志物示糖类抗原125(carbohydrate antigen 125,CA125)和糖类抗原199(carbohydrate antigen 199,CA199)升高。腹部超声示肝内多发占位,胆囊壁毛糙增厚,胆囊内胆泥形成,胰脾未见明显异常。腹部CT平扫+胆道重建示:胆囊炎,不除外胆囊泥沙样结石;肝内多发异常密度影,转移瘤可能性大;胃底贲门周围、肝门、门腔静脉间多发淋巴结,胃壁不均匀。PET/CT示:肝脏肿胀伴多发占位,葡萄糖代谢异常增高,考虑肝脏恶性病变-转移瘤(隐匿癌)或原发恶性肿瘤伴肝内播散;肝门部及门腔间隙多发肿大淋巴结,葡萄糖代谢异常增高,考虑淋巴结转移;肝周少量积液;门脉增宽;脾脏增大,脾静脉迂曲;T1椎体及左侧肱骨局限性葡萄糖代谢异常增高,考虑骨转移表现。腹部增强MRI示:肝内多发恶性占位,考虑转移瘤;腹腔、肝门、腹膜后多发肿大淋巴结;胆囊炎;胃壁增厚;少量腹水。为进一步诊疗,从海军总医院转入我院。既往史:有高血压病、脂肪肝、胆囊结石、反流性食管炎、非萎缩性胃炎、结肠多发息肉等病史。
入院查体体温37.5℃,心率70次/min,皮肤、巩膜无黄染,未见肝掌和蜘蛛痔,浅表淋巴结无肿大,心肺无阳性体征。腹部膨隆,无腹壁静脉曲张,未见胃肠型及蠕动波,右上腹及中上腹压痛,无反跳痛及肌紧张,肝肋下约5cm,质硬,有触痛,墨菲征可疑阳性,移动性浊音阴性,肠鸣音减弱。双下肢无水肿。
诊疗经过入院诊断考虑“发热、肝脏多发占位,性质待定”。完善检查:尿便常规无异常,白细胞计数12.7×109/L,中性粒细胞0.864,血红蛋白、血小板无明显异常;丙氨酸氨基转移酶114U/L,天冬氨酸氨基转移酶143U/L,总胆红素21.25µmol/L,直接胆红素9.78µmol/L,γ-谷氨酰基转移酶617U/L,碱性磷酸酶699U/L,乳酸脱氢酶743U/L,血清白蛋白26.6g/L,C-反应蛋白7.99mg/dl;血清肿瘤标志物CA125 120.4U/ml,CA199 3 222U/ml;乙肝核心抗体阳性,丙肝抗体阴性;抗中性粒细胞胞浆抗体、抗核抗体、抗线粒体抗体、抗平滑肌抗体和抗双链DNA抗体均为阴性;免疫球蛋白A、D、E、G及其亚型均无异常;两次血培养均为阴性;上腹部增强MRI提示肝内弥漫多发乏血供实性病灶,考虑转移瘤可能性大,伴肝门及腹膜后多发淋巴结转移,少量腹水(图1);腹部超声见肝脏体积增大,满布不均匀低回声结节,部分结节内有不规则液性透声区,多普勒超声检查病灶内未见血流信号,超声造影动脉期病灶边缘及内部可见散在点状灌注,门脉期少部分病灶内仍无灌注,延迟期病灶内造影剂廓清较正常肝实质快,提示炎性改变,胆管壁增厚,胆囊壁水肿,胆囊内胆汁透声欠佳,可见沉积物,少量腹水。PET/MRI见肝内多发异常信号伴代谢增高,腹腔及腹膜后多发增大淋巴结伴代谢增高,骨骼多发异常信号伴代谢增高,考虑转移瘤可能性大。2014年4月4日超声引导下肝穿刺活检,镜下见中低分化腺癌浸润伴大片坏死,结合免疫组化染色结果,支持胆管腺癌。免疫组化:AFP(-)、GPC-3(局灶+)、Arg-1(-)、Ck7(+)、Ck19(+)、TTF-1(-)、Cox-2(-)。结合临床特点,诊断考虑为“肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC),肿瘤坏死伴感染,急性胆囊炎”,由于存在淋巴结、骨转移,肿瘤分期晚,且存在肝内肿瘤坏死并感染,肿瘤负荷大,无手术治疗指征,难以耐受化疗、放疗、介入治疗等创伤性大的治疗,以抗感染、对症支持治疗为主,尽量延长生命,改善生活质量。给予限制饮食、抗感染、保肝、营养支持、增强免疫、DC免疫细胞及对症治疗,但感染未得到控制,仍存在发热,每日最高体温波动在38℃~39℃,血象持续升高,肝、肾功能进行性恶化,腹腔积液进行性增多,腹水穿刺显示为黄色混浊腹水,腹水中查见核异形细胞,考虑为腺癌细胞。5月11日患者出现脑梗死。6月2日患者死亡。行腹部局部尸检,镜下见肝内多结节型中分化ICC伴坏死,膈肌、阑尾、直肠、肠系膜、右肾脂肪囊可见多发转移癌,门静脉可见癌栓。
死亡诊断ICC。
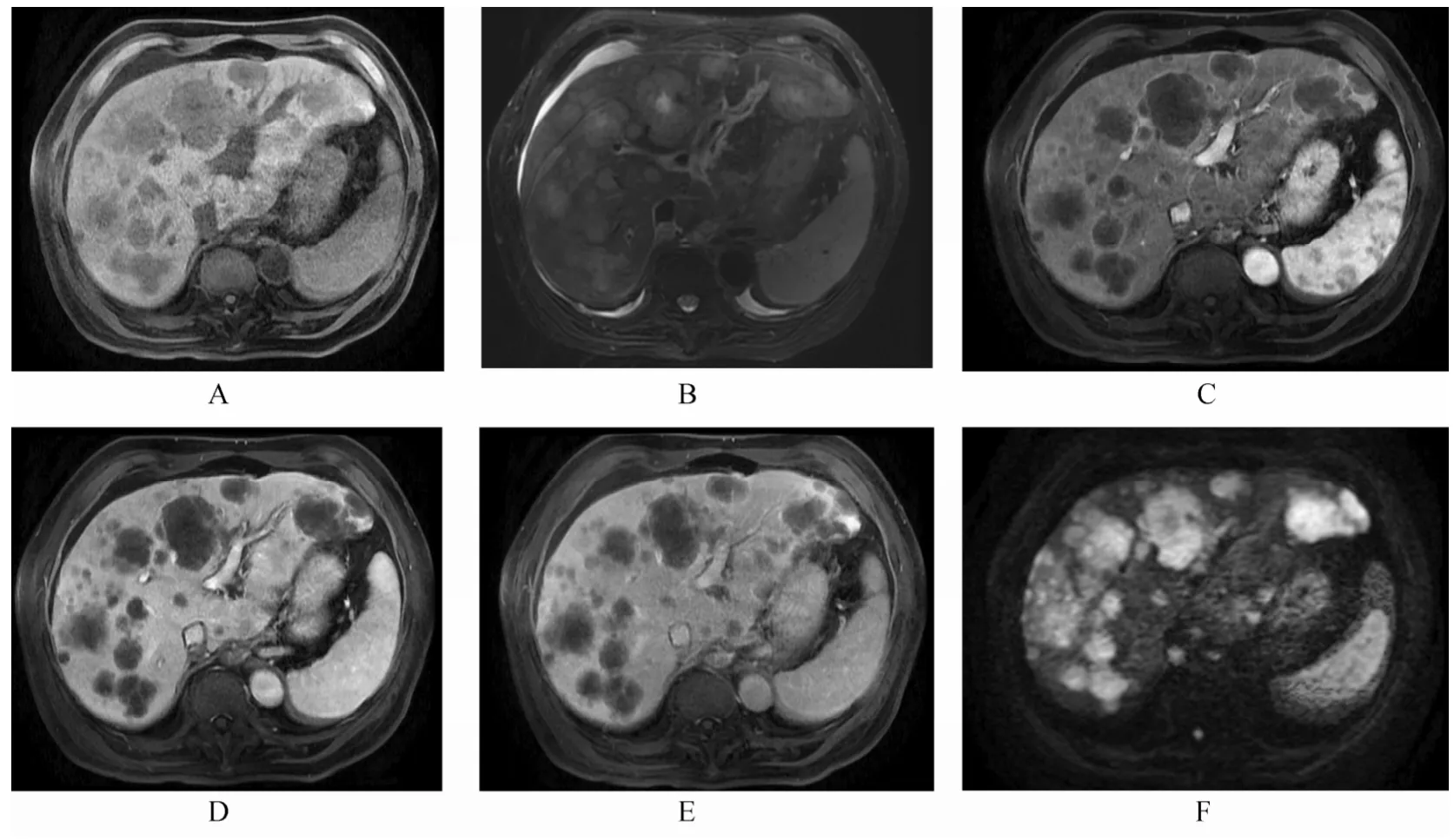
图1 患者增强MRI结果Figure 1 Enhanced magnetic resonance imaging examination for the patient
2 临床病理讨论
王节主任医师(南楼超声科)患者入院后超声检查见肝脏多发结节,回声偏低,大者达6cm×4cm,超声造影动脉期显示结节中央有液化,周边强化,延迟期消退较快,大部分在门脉期有灌注,不是典型牛眼征表现。肝内胆管壁和胆囊壁增厚,胆囊可见双边征,内有沉积物,胆管无扩张,胰腺、肾脏未见异常。患者有胆系感染征象,肝内病灶有感染性病变特点,也要考虑转移癌合并感染的可能。肝内病灶是恶性肿瘤、还是感染性疾病,要根据临床、多种影像学综合分析判断进行鉴别。肝脏上有些肿瘤如ICC与细菌性肝脓肿在超声上较难鉴别,典型的肝脓肿表现为厚壁的含液性肿块,这与合并内部液化坏死的ICC有重叠之处,而不典型的肝脓肿与ICC更难鉴别。其细微差别主要是因为ICC病灶内部纤维结缔组织较多,后方回声衰减明显,以致后方边界不清,另外肿块内部的纤维组织收缩可牵拉周围的胆管向肿块汇聚,从而使部分ICC病灶周边可见“枯树枝样”的扩张胆管走行。超声造影技术可以实时动态的观察病灶内部的微血管的灌注情况,已被广泛应用于肝脏病变的诊断及鉴别诊断当中。ICC的超声造影具有“快进快出”、环状增强和(或)树枝状增强等表现;肝脓肿的超声造影同样具有“快进快出”、环状增强等表现,其他特点有周边一过性增强、“花瓣样”或“蜂窝状”增强。这些特点与它们各自的病理发展过程相关,ICC主要有实性期和内部液化坏死期,而对于肝脓肿而言就比较复杂,分化脓性炎症期、脓肿形成初期和脓肿形成期三期。化脓性炎症期的肝脓肿病灶周边肝组织可出现局部的炎症、充血、水肿,二维超声很难清楚分辨病灶和周围肝组织,而造影后可清晰显示病灶范围,而周围充血水肿的肝组织则在动脉期出现一过性快速增强,“蜂窝样”改变为脓肿形成初期病灶造影的特征性改变。病理基础可能为脓肿形成初期整个病灶未能完全液化,而是由多发小脓腔组成,中间及周边残留肝脏的网状支架,造影后,超声造影剂可充填这些网状支架,从而形成“蜂窝样”或“花瓣状”强化。这与ICC的液化坏死形成的空洞是有明显区别的,因为ICC病灶液化坏死中间部分形成空洞,未能保持正常肝脏的网状支架。ICC是一种恶性肿瘤,其生长方式为浸润性生长,二维超声很难显示其浸润范围,造影后病灶异常灌注,病灶范围较二维超声明显增大,在造影中,处于内部液化坏死期的ICC和处于脓肿形成期的肝脓肿病灶均可出现环征,典型的肝脓肿为双环征,而ICC为单环征,肝脓肿出现双环的病理基础可能是动脉期脓肿壁的环状增强,周围水肿带的低增强和脓腔液化坏死区无增强。ICC形成单环征的原因可能为动脉期肿瘤中心坏死区域的无增强和周边肿瘤实性部分的增强或者当肿瘤较大时,纤维组织增多,内部血管减少,甚至中央区出现硬化,血管仅分布在瘤体周边、内部无血管,因此造影剂可能只会充填瘤体周边呈环状增强或呈不均匀性增强。两者均为“快进快出”模式,延迟相均呈低增强,虽然ICC较肝脓肿的达峰强度高,但有时也难以鉴别[1]。因此,当鉴别困难时,需要超声引导下穿刺活检。
安宁豫主任医师(南楼放射诊断科)MRI检查可见肝脏多发类圆形结节,结节的边界清晰,呈长T1稍长T2信号,大者中央有液化坏死,呈靶征,弥散加权成像(diffusion weighted imaging,DWI)显示实体部分信号高,胆囊壁增厚,周边渗出,肝门、胰头周围及腹膜后散在肿大淋巴结;动态增强扫描,动脉期周边轻度环状强化,门脉期及延迟期呈轻度强化,肝内外胆管未见扩张,考虑恶性肿瘤肝脏、淋巴结转移可能性大。虽然患者有高热,需要排除肝脓肿,但个人从未见过如此表现的多发肝脓肿,最终,肝穿刺活检证实为ICC。肿块型ICC MRI平扫主要表现为分叶状或不规则形、无包膜的软组织肿块,边界多不清楚,肿瘤在T1WI上呈不均匀低信号,T2WI呈不规则形混杂高或稍高信号,部分中心可见局灶性星芒状、条状或片状低信号,当病灶内出现坏死时,T2WI呈明显高信号;与超声造影不同,增强MRI的表现为“快进慢出”模式,动脉期周边环状增强,而门脉期和延迟期表现为延迟强化[2];DWI病灶周围部分肿瘤细胞丰富处为高信号。ICC患者出现肝门区、腹膜后淋巴结转移比肝细胞癌多,MRI除了对淋巴结大小、形态、多系列信号的观察外,DWI上肿瘤转移的淋巴结可呈高信号,并对转移淋巴结的敏感性较高,这有利于对肝门区、腹膜后淋巴结转移的诊断。部分肝脓肿和ICC常不易鉴别,特别是早期肝脓肿,两者都可合并肝内胆管结石,且部分ICC合并有炎症,但脓肿壁内缘较清楚,外缘较模糊,中央部分DWI呈高信号,而ICC病灶中央区坏死部分DWI呈低信号,中央坏死区的壁不规则。转移性腺癌与ICC的MRI表现相似,需要依赖肝外原发肿瘤病史来鉴别[3]。
陈思文经治医师(南楼消化科)本患者老年男性,发病时间近1个月,表现为右上腹痛、发热和肝脏多发占位,无明显黄疸;体检无肝掌、蜘蛛痣,右上腹有压痛,肝脏明显增大,质地硬,墨菲征可疑阳性;化验外周血白细胞、C-反应蛋白、转氨酶明显升高,肿瘤标志物甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcino-embryonic antigen,CEA)正常,CA199显著升高;超声显示肝脏多发乏血供占位,肝内胆管壁增厚,胆囊可见双边征,超声造影显示占位病变呈炎性改变特点;MRI检查肝内占位可见靶征,肝门、胰周及腹膜后散在肿大淋巴结;PET/MRI见肝内多发异常信号伴代谢增高,腹腔及腹膜后多发增大淋巴结伴代谢增高,骨骼多发异常信号伴代谢增高。从临床、肿瘤标志物、多种影像学表现来看,恶性肿瘤伴肝脏、淋巴结、骨转移可能性大,但发病时有高热,炎性指标升高明显,肝内占位病变液化坏死明显,需要排除肝脓肿。
吴道宏主管医师(南楼消化科)从临床症状来看,具有感染性疾病特点,如畏寒、高热,白细胞、C-反应蛋白等炎性指标升高,超声、MRI检查见肝脏多发低回声结节,结节中央有液化、坏死,胆管壁增厚、胆囊壁双边征。因此患者存在感染情况,是单纯感染还是恶性肿瘤合并感染还需要进一步鉴别。结合患者其他临床表现,CA199显著升高,MRI及PET/MRI显示肝门、胰头周围及腹膜后散在肿大淋巴结、骨骼多发高代谢灶,更符合恶性肿瘤多发转移的特点。但从PET/MRI上未发现明确肝外原发肿瘤病灶,肝转移癌常见原发肿瘤为结直肠癌、胃癌、胆囊癌、乳腺癌、卵巢癌、胰腺癌、肺癌等[4],该患者2013年10月曾行胃肠镜检查,未发现明显异常,影像学检查也未发现胆囊、胰腺、肺脏肿瘤。因此还需要考虑原发肝脏恶性肿瘤肝内转移,虽然患者乙肝核心抗体阳性,既往感染过乙肝病毒,但患者无慢性乙肝、肝硬化背景,AFP正常,影像学特点也不支持原发性肝细胞癌,故需要考虑ICC,最终超声引导下肝穿刺活检证实为ICC。患者发热的原因可能为ICC合并感染,青岛大学医学院附属医院毕卫群等[5]报道了15例ICC合并肝脓肿,15处肿瘤,16处肝脓肿,其中10例患者ICC和肝脓肿位于同一肝段或肝叶,5例患者ICC和肝脓肿位于不同肝段或肝叶,该患者还需要排除上述情况。
徐世平主诊医师(南楼消化科)同意前面各位临床医师的分析,患者诊断为ICC,肿瘤坏死伴感染,急性胆囊炎。文献报道[6],ICC伴发化脓性感染要明显多于肝细胞癌(23%vs3%)。肝脏原发恶性肿瘤中,ICC占4.6%~7.7%[7,8],ICC生物学行为具有症状隐匿、发展迅速、早期发现难、恶性程度高、根治性切除机会少、预后不佳等特点,生存率与病理类型有关,高分化的肿瘤平均生存时间为10个月,分化较差的肿瘤平均为2个月,总的来说,5年生存率<5%[9]。发病因素是多方面的,最常见的病因包括肝内胆管结石、胆管分支(胆管树)形态异常和血吸虫等慢性感染,大量流行病学和实验室研究发现,乙型肝炎病毒或丙型肝炎病毒感染亦可能与ICC的发生有关[8,10]。常见于50~70岁人群,男女发病比例接近。早期行根治性手术切除是ICC唯一有希望治愈的治疗方法,但由于淋巴结侵犯占85%、神经浸润占80%、淋巴结转移占58%、肝外门静脉受侵占40%、肝门部静脉受侵占37%,因此根治性手术切除率仅有15%~20%,根治性手术切除术后中位生存时间27.8~28个月,5年生存率为23.4%~33.0%。但由于多数患者初次就诊时已处于肿瘤进展期,因此失去了手术切除的机会,75%的患者在1年内死亡[9,11,12]。由于器官紧缺和移植后肿瘤的高复发率,肝移植作为ICC的治疗选择尚存争议[13],复旦大学附属中山医院徐泱等[14]报道12例ICC肝移植预后很不理想,中位生存时间为370d,2年存活率为24.6%。其他姑息性治疗方法有放疗、化疗、肝动脉化疗栓塞、微波消融、射频消融治疗[15,16],但疗效均欠佳。解放军总医院王茂强等[17]报道30例ICC行肝动脉化疗栓塞治疗,中位生存时间9个月,2年生存率为10%。解放军总医院于晓玲等[18]报道26例ICC患者47个结节行超声引导下经皮微波消融治疗,中位生存时间10个月,2年生存率为53.8%。由于该患者为肿瘤晚期,合并感染,治疗难度大,缺乏有效治疗手段,虽然联合应用了多种广谱抗生素治疗,感染仍难以控制。肝内坏死组织合并感染如果不能进行有效引流,单纯药物治疗有时难以有效控制感染,该患者肝内转移广泛,坏死组织多,合并有急性胆囊炎,难以像肝脓肿一样实施超声引导下穿刺引流。另外针对ICC治疗手段有限,再加上转移广泛,无法手术治疗;患者有发热、肝内病灶>75%肝脏体积,不适合介入治疗;肿瘤负荷大,剩余的正常肝组织少,难以耐受全身化疗,且ICC缺乏有效的化疗方案,感染又得不到有效控制,因此也无法进行化疗。治疗上以对症、支持治疗为主,尽量减少痛苦,延长生命。
李杰主治医师(病理科)患者2014年4月超声引导下肝穿刺活检,镜下见中低分化腺癌浸润伴大片坏死,免疫组化:AFP(-)、GPC-3(局灶+)、Arg-1(-)、Ck7(+)、Ck19(+)、TTF-1(-)、Cox-2(-),结合免疫组化染色结果,支持胆管腺癌。2014年6月从尸检情况看,肝脏表面多发结节,结节切面灰黄,与周围组织界限清楚,肝门部门静脉内可见癌栓,光镜下见中分化ICC伴大片坏死,肿瘤多灶分布,胰腺周围淋巴结可见转移癌。膈肌表面布满灰白色粟粒样结节,光镜下见多发癌结节,纤维血管增生,多发脉管癌栓;阑尾、直肠浆膜面局部呈粟粒样,肠系膜表面见1枚3cm×2cm×2cm大小结节,光镜下见阑尾、直肠浆膜面、肠系膜多发转移癌并见癌结节;右肾表面脂肪囊见1枚2.5cm×1.0cm×0.5cm结节,切面灰白,质中,光镜下见脂肪囊内转移癌。ICC从大体形态上分为肿块型、管周浸润型和管内生长型3种基本类型,肿块型多发生于小胆管,向外穿透胆管壁后呈膨胀性生长,形成结节状肿瘤,边界清楚,无包膜,中央可见坏死。管周浸润型多发生于较大的肝内胆管分支,倾向沿胆管壁经Glissons鞘的神经和神经周围间隙向肝门方向扩散。管内生长型少见,肿瘤早期局限于黏膜层,向管腔内生长。从尸检情况来看,该病例属于肿块型ICC,合并肝内及肝外多部位转移。
【参考文献】
[1]Jiang LP, Yu Q, Yuan XC,et al.The contrast-enhanced ultrasound value of differential diagnosis on intrahepatic cholangiocarcinoma and bacterial hepatic abcess[J].J Pract Med, 2014, 30(18):2976-2978.[蒋丽萍, 喻 沁,袁新春, 等.超声造影对肝内胆管癌和细菌性肝脓肿的鉴别诊断价值探讨[J].实用医学杂志, 2014, 30(18):2976-2978.]
[2]Mao F, Huang BJ, Yuan HX,et al.Comparison of enhancement features of peripheral intrahepatic cholangiocarcinoma on contrast-enhanced ultrasound and dynamic enhanced MRI[J].Tumor, 2014, 34(11):1023-1027.[毛 枫, 黄备建, 袁海霞, 等.周围型肝内胆管细胞癌超声造影与增强MRI的对比研究[J].肿瘤, 2014, 34(11):1023-1027.]
[3]Xiao GQ, Zou S.Progress on the CT and MRI diagnosis of intrahepatic cholangiocarcinoma[J].Fujian Med J,2014, 36(3):141-143.[肖桂卿, 邹 松.肝内胆管细胞癌CT和MRI影像诊断进展[J].福建医药杂志, 2014,36(3):141-143.]
[4]Wu ZL, Wu YC, Yang G,et al.Influential factors on curative effect of interventional therapy for liver metastases[J].J Hebei Med Univ, 2015, 36(3):304-308.[武中林, 吴勇超, 杨 光, 等.影响肝转移瘤介入治疗效果因素分析[J].河北医科大学学报, 2015, 36(3):304-308.]
[5]Bi WQ, Feng WG, Liu SF,et al.Multi-slice CT diagnosis of intrahepatic cholangiocarcinoma complicated with hepatic abscess[J].J Med Imaging, 2011, 21(12):1834-1838.[毕卫群, 冯维刚, 刘士锋, 等.肝胆管细胞癌并发肝脓肿的MSCT诊断[J].医学影像学杂志,2011, 21(12):1834-1838.]
[6]Zou LX, Zhang HY.Differential diagnosis of ultrasound on hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J].Hebei Med J, 2013, 35(16):2475-2476.[邹丽娴, 张红艳.超声对肝细胞肝癌和肝胆管细胞癌的鉴别诊断[J].河北医药, 2013, 35(16):2475-2476.]
[7]Wu LQ, Cao JY, Wang ZS,et al.Prognosis of primary liver cancer with different pathological types after hepatectomy:a report of 567 cases[J].Chin J Dig Surg,2012, 11(6):561-565.[吴力群, 曹景玉, 王祖森, 等.567例不同病理类型的原发性肝癌肝切除术后预后分析[J].中华消化外科杂志, 2012, 11(6):561-565.]
[8]Zhu Z, Cong WM.Clinicopathological study of intrahepatic bile duct cancers from 1982 to 2011[J].J Clin Hepatol, 2013, 29(1):142-144.[朱 珍, 丛文铭.肝内胆管细胞癌的临床病理学观察[J].临床肝胆病杂志,2013, 29(1):142-144.]
[9]Huang YZ, Yang XW, Yang JH.Progress on the treatment of intrahepatic cholangiocarcinoma[J].J Hepatobiliary Surg, 2014, 22(1):73-76.[黄元哲, 杨新伟, 杨家和.肝内胆管细胞癌的治疗进展[J].肝胆外科杂志, 2014,22(1):73-76.]
[10]Matsumoto K, Onoyama T, Kawata S,et al.Hepatitis B and C virus infection is a risk factor for the development of cholangiocarcinoma[J].Intern Med, 2014, 53(7):651-654.
[11]Spolverato G, Yakoob MY, Kim Y,et al.Impact of complications on long-term survival after resection of intrahepatic cholangiocarcinoma[J]. Cancer, 2015,121(16):2730-2739.
[12]Hwang S, Lee YJ, Song GW,et al.Prognostic impact of tumor growth type on 7th AJCC staging system for intrahepatic cholangiocarcinoma:a single-center experience of 659 cases[J].J Gastrointest Surg, 2015,19(7):1291-1304.
[13]Hashimoto K, Miller CM.Liver transplantation for intrahepatic cholangiocarcinoma[J].J Hepatobiliary Pancreat Sci, 2015, 22(2):138-143.
[14]Xu Y, Fan J, Zhou J,et al.The outcome of liver transplantation for 12 patients with cholangiocellular carcinoma[J].Chin J Organ Transplant, 2007, 28(11):662-665.[徐 泱, 樊 嘉, 周 俭, 等.12例胆管细胞癌患者肝移植的预后分析[J].中华器官移植杂志, 2007,28(11):662-665.]
[15]Boehm LM, Jayakrishnan TT, Miura JT,et al.Comparative effectiveness of hepatic artery based therapies for unresectable intrahepatic cholangiocarcinoma[J].J Surg Oncol, 2015, 111(2):213-220.
[16]Han K, Ko HK, Kim KW,et al.Radiofrequency ablation in the treatment of unresectable intrahepatic cholangiocarcinoma:systematic review and meta-analysis[J].J Vasc Interv Radiol, 2015, 26(7):943-948.
[17]Chang ZF, Wang MQ, Liu FY,et al.The clinical analysis for 30 patients of intrahepatic cholangiocarcinoma with transarterial chemoembolization treatment[J].Chin J Clin(Electron Ed), 2013, 7(6):205-206.[常中飞, 王茂强,刘凤永, 等.肝动脉化疗栓塞治疗肝内胆管细胞癌30例临床分析[J].中华临床医师杂志(电子版), 2013, 7(6):205-206.]
[18]Zhang DD, Yu XL, Liang P,et al.Efficacy analysis for percutaneous microwave ablation of intrahepatic cholangiocarcinoma[J].Chin J Med Ultrasound(Electron Ed), 2011, 8(11):2314-2318.[张德东, 于晓玲, 梁 萍,等.经皮微波消融治疗肝内胆管细胞癌的疗效分析[J].中华医学超声杂志(电子版), 2011, 8(11):2314-2318.]
