抗CD133/CD3双特异性抗体装载的CIK细胞对高表达CD133结直肠癌细胞杀伤效应的探讨
2015-04-27吕海燕刘传杰黄建华
吕海燕,刘传杰,黄建华
(解放军总医院基础医学研究所免疫研究室,北京 100853)
结直肠癌发病率和死亡率在世界范围逐年增高。由于其潜在的临床表现和早期症状的非特异性,40%~50%的新病例被诊断时已属晚期,导致手术治愈率低[1]。对于晚期结直肠癌患者尤其是老年患者,常规化疗在一定程度上虽可观察到疗效,却不能有效地提高整体生存率。此外,化疗的多重不良反应会严重影响患者的生活质量[2]。因此迫切需要确定新的针对结直肠癌的有效治疗策略。
越来越多的证据表明[3-5],治疗肿瘤需要创建有效靶向杀灭肿瘤干细胞的新策略。到目前为止,所发现的肿瘤干细胞特异性标志物非常稀少,而CD133则是目前所发现肿瘤干细胞中最常见的标志物之一[6]。由此我们选定了CD133作为针对CD133阳性结直肠癌治疗研究的新靶点。
本研究拟进行抗体与细胞因子活化杀伤(cytokine-induced killer,CIK)免疫细胞治疗技术的融合与创新,构建抗CD133/CD3双功能特异性抗体装备的CIK细胞作为效应细胞,为开展靶向治疗高表达CD133人结直肠癌的可行性研究奠定基础。
1 材料与方法
1.1 细胞
人结直肠癌细胞株SW620、HT29和LOVO均购于美国模式培养物集存库(American type culture collection,ATCC),并于本实验室保存。
1.2 试剂
无血清细胞培养基(RPMI1640;GIBCO公司,美国);胎牛血清(fetal bovine serum,FBS;HyClone公司,新西兰);鼠抗人CD3单克隆抗体(monoclonal antibody,mAb;TaKaRa公司,日本);鼠抗人CD133-PE抗体和抗CD133(AC133)mAb(美天旎生物技术公司,德国);鼠抗人CD3-PerCP、CD4-FITC、CD8-PE、CD56-APC四标荧光标记抗体和同型对照IgG1(BD公司,美国);Traut’s试剂和4-(N-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(SULFO-SMCC)试剂(赛默飞世尔科技公司,美国);人淋巴细胞分离液(天津灏洋生物制品科技有限责任公司);细胞计数试剂盒(cell counting kit-8,CCK8;DojinDo公司);PD-10脱盐层析柱(安玛西亚公司,瑞典);人IFN-γ ELISA试剂盒(R&D抗体公司,美国)。
1.3 CIK细胞的培养
取健康志愿者外周静脉血10ml,肝素抗凝,用生理盐水1∶1稀释后,加至淋巴细胞分离液上层,离心收集外周血单个核细胞(peripheral blood mononuclear cell,PBMC),用含6%自体血清的RPMI1640培养液调整细胞密度为2×106个/ml,置于37℃,5%CO2培养箱中培养24h后,加入鼠抗人CD3mAb(50ng/ml)和人重组白介素-2(1000U/ml),每2d加液补充人重组白介素-2,14d后,流式检查细胞表型(CD3、CD4、CD8和CD56)后收获CIK细胞。
1.4 CIK细胞表型的检测
将培养0d和14d的CIK细胞调整浓度为5×106个/ml,各取200µl加入Falcon管中,加入鼠抗人CD3-PerCP、CD4-FITC、CD8-PE、CD56-APC四标抗体及同型对照IgG1单抗各5µl,混匀,在4℃暗室反应30 min后,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤2次,流式细胞仪检测。
1.5 抗CD133/CD3双特异性抗体的制备
我们按照文献[7]方法制备双特异性抗体。取鼠抗人CD3mAb(OKT3抗体)1mg溶于5倍摩尔浓度的Traut’s试剂500µl,室温下作用1h,用PD-10柱过滤,移除未交联的mAb;取鼠抗人CD133mAb(1mg)溶于4倍摩尔浓度的交联剂SULFO-SMCC500ul,室温下作用1h,用PD-10柱过滤,移除未交联的mAb;将已交联的两种mAb混合后4℃过夜,制备得到抗CD133/CD3双功能特异性抗体。双抗体蛋白产物通过8%非还原、变性SDS-聚丙烯酰胺凝胶电泳图、考马斯亮蓝染色检测后,用蛋白定量BCA试剂盒检测双抗的蛋白含量。
1.6 抗CD133/CD3双特异性抗体装载CIK细胞
离心收集培养14d并经表型检测过的CIK细胞,PBS洗涤2次,按1×106个CIK/50ng双抗浓度加入抗CD133/CD3双功能特异性抗体,混匀后室温静置60min,PBS洗涤没有结合上的抗体,CIK重悬培养液中,按一定比例加入靶细胞培养液中,得到抗CD133/CD3双特异性抗体装载的CIK(BsAb-CIK)细胞。
1.7 细胞毒作用的检测
以CIK细胞为效应细胞,以人结直肠癌细胞系SW620、HT29和LOVO作为靶细胞,检测对比BsAb-CIK细胞的杀伤作用。用健康供者的CIK细胞分别对SW620、HT29和LOVO细胞进行体外杀伤实验。
取对数生长期肿瘤细胞,铺96孔细胞培养板(10000个/孔),第2天分别加入CIK细胞或BsAb-CIK细胞(1×106个/50ng),以效靶比1∶1、5∶1、10∶1和20∶1的浓度(3个平行孔/浓度)共同培养4~6h,实验同时设单纯CIK细胞对照组、靶细胞对照组和空白组。弃上清液,PBS漂洗细胞2次后,加入CCK8细胞计数试剂盒中继续培养4h,96孔细胞培养板放入酶联仪检测450nm处吸光度A,根据公式计算细胞杀伤作用:杀伤率(%)=[1-A实验组/(ACIK对照+A靶细胞对照)]×100%。
1.8 细胞因子检测
取对数生长期人结直肠癌细胞系SW620、HT29和LOVO,铺96孔细胞培养板(10 000个/孔),第2天加入CIK细胞或BsAb-CIK细胞,以效靶比1∶1、5∶1、10∶1和20∶1的浓度共同培养4~6h后,收集上清液,用ELISA试剂盒检测细胞INF-γ分泌水平。
1.9 裸鼠荷瘤制备实验
6~8周龄雌裸鼠27只,随机分成3组:对照组、单纯CIK组和BsAb-CIK细胞组。每只裸鼠右腋下皮下注射2×106个人结直肠癌细胞系SW620或HT29细胞,10d后肿瘤长到约0.3cm×0.3cm×0.17cm大小,治疗组分别在每只裸鼠腹腔内注射CIK或BsAb-CIK细胞1×107个,6d后再次注射相同数量细胞,共2次。1个月后处死小鼠取瘤秤重,统计3组间肿瘤生长的差异。
1.10 统计学处理
2 结 果
2.1 培养后的CIK细胞表型
结果表明在多种细胞因子的诱导下,随着培养时间的延长,培养14d的细胞与0d的细胞比较,CD8+/CD56+由2.65%升至11.70%,CD3+/CD8+由28.50%升至67.21%,CD3+/CD56+由3.16%升至15.92%,其中CD3+/CD8+和CD3+/CD56+细胞比率明显升高,表明CIK细胞主要成分是具有杀伤作用的淋巴细胞,包括T细胞和NKT细胞(图1)。
2.2 构建抗CD133和抗CD3的双特异性功能抗体
在温和的条件下将小鼠抗人CD133和CD3mAb进行化学偶联,制备抗CD133/CD3双特异性抗体。通过8%非还原、变性SDS-PAGE蛋白电泳检测,证实抗CD133/CD3两种抗体偶联的二聚体蛋白条带为300kD,而单体为150kD(图2)。
2.3 结直肠癌肿瘤细胞中CD133的表达
通过流式细胞仪对7种结直肠癌细胞株的CD133表面抗原进行检测,筛选出高、低表达CD133的配对细胞株。其中SW620表达CD133的阳性率为99.43%,HT29为66.67%,LOVO为2.92%(图3)。
2.4 BsAb-CIK细胞体外杀伤CD133高表达结直肠癌细胞系
用CCK8试剂盒检测细胞增殖情况。结果发现在不同效靶比条件下(1∶5,1∶10,1∶20),BsAb-CIK细胞对高表达CD133的结直肠癌细胞系SW620和HT29的杀伤作用均明显高于单纯CIK组(P<0.05),而BsAb-CIK细胞对低表达CD133的结直肠癌细胞系LOVO的杀伤作用与单纯CIK组相比,没有显著性差异(P>0.05)。无论是CIK细胞还是BsAb-CIK细胞,其杀伤靶细胞的作用与效应细胞的浓度均呈正相关(图4)。

图1 培养0d和14d的健康人CIK细胞表型Figure 1 The phenotype of the CIK cells from the healthy individual on day 0 and day 14

图2 CD133/CD3两种抗体偶联的二聚体蛋白Figure 2 Production of anti-CD3/ anti-CD133 BsAb
2.5 细胞因子INF-γ的分泌水平
各组培养上清中细胞因子均伴有INF-γ分泌水平明显增高,BsAb-CIK细胞与单纯CIK组比较差异显著(P<0.05;图5)。表明BsAb-CIK细胞对靶细胞的杀伤效应与INF-γ分泌水平密切相关。
2.6 BsAb-CIK细胞对裸鼠体内移植瘤的杀伤
经统计学分析表明,与单纯CIK治疗组比较,BsAb-CIK细胞对小鼠SW620和HT29细胞皮下移植瘤的生长抑制作用更加显著(P<0.05;表1)。
3 讨 论
目前,CD133已经确定为结直肠癌肿瘤干细胞表面标志分子[10,11]。由于直接作用于肿瘤干细胞的细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)还没有问世[12,13],而单纯CIK细胞又不能靶向杀伤肿瘤干细胞,所以我们利用mAb的靶向杀伤作用和CIK细胞所具有的非主要组织相容性复合体(major histocompatibility complex,MHC)限制性强大杀瘤活性的特性,构建了BsAb-CIK新型效应细胞。
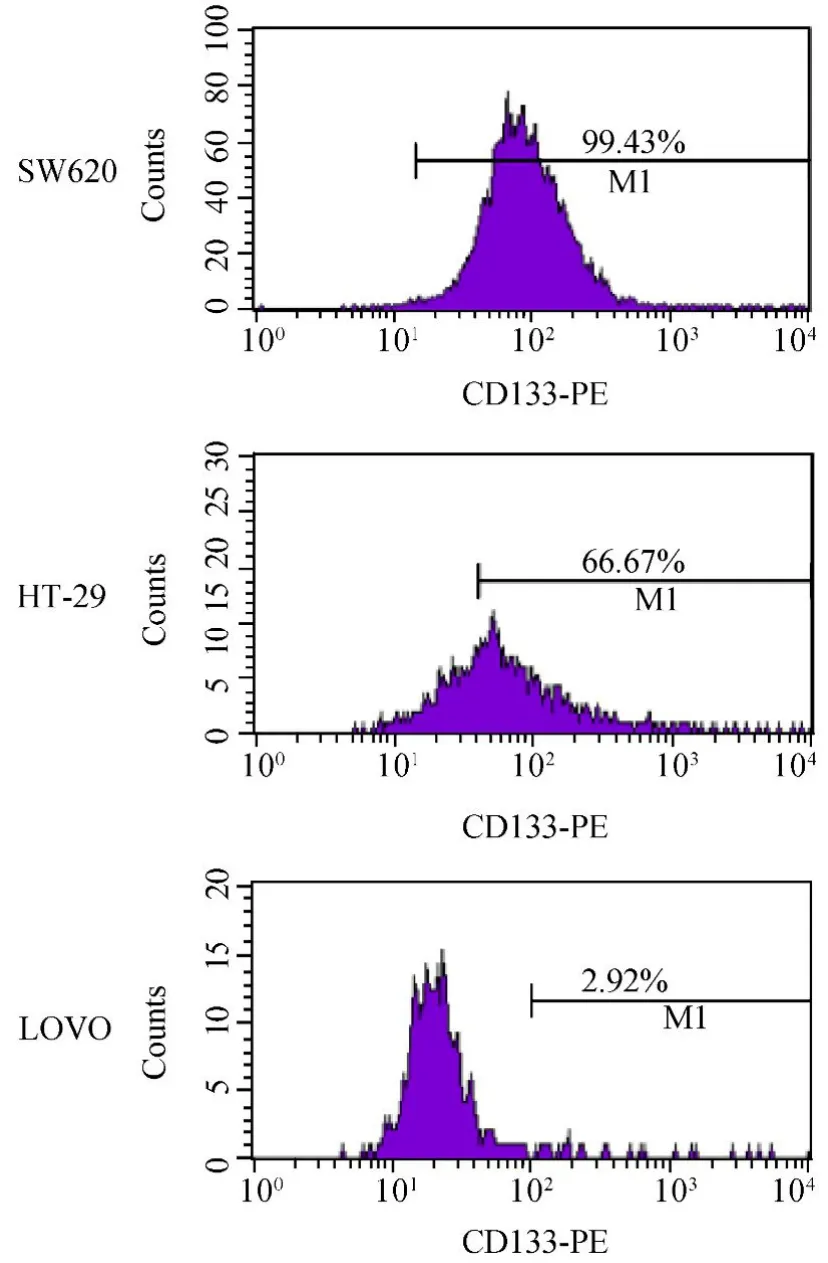
图3 人结直肠癌细胞系CD133的表达Figure 3 Expression of CD133 in human colorectal cancer cell lines
本研究通过用抗CD133抗体对7种人结直肠癌肿瘤细胞株的CD133抗原表达的筛查后,选择了高低配对细胞株作为靶细胞。结果表明CIK细胞在装备了抗CD133/CD3双抗体之后,不仅发挥了CIK广谱直接杀伤肿瘤细胞的治疗作用,而且利用双功能抗体的桥联作用将效应细胞和高表达CD133的肿瘤靶细胞有机地结合到一起,形成杀伤组合体,发挥了抗体靶向打击消灭CD133阳性的肿瘤干细胞的强大作用。双特异性抗体不仅将效应细胞富集在肿瘤周围,而且可以模拟天然配体的作用,与细胞表面引发分子结合,激活效应细胞,实现对肿瘤细胞的靶向性的杀伤。由于抗体对抗原的识别不需要抗原提呈及MHC的表达,因此CIK装载特异性双抗的治疗方案不但能够有效地解决肿瘤干细胞对宿主免疫监视逃逸和耐药性等影响疗效的关键难题,而且能够修补CIK细胞免疫治疗不能消灭具有复发转移的种子——肿瘤干细胞的缺陷。我们的研究结果与文献报道结果是一致的[14]。由此可以推测BsAb-CIK新型效应细胞不仅能够对CD133高表达的结直肠癌细胞进行高效打击,而且也有可能对各种肿瘤中的高表达CD133的干细胞细胞亚群进行有效抑制。这一靶向杀伤CD133阳性细胞的治疗方案有可能对如何消灭肿瘤干细胞、从源头上解决肿瘤复发与转移、根治肿瘤提供了新的线索与论据。
我们的实验发现BsAb-CIK对靶细胞的杀伤效应与INF-γ分泌水平密切相关。IFN-γ可以促进naiveCD4+T细胞向Th1细胞分化,同时还具有抑制naiveCD4+T向Th2细胞分化的功能,提示了BsAb-CIK细胞是通过增强抗肿瘤免疫调节机制发挥更强的杀伤肿瘤作用。
总之,我们的研究表明抗BsAb-CIK细胞能够有效的靶向杀伤CD133高表达的肿瘤细胞。这一研究结果为创建高效靶向消灭CD133阳性肿瘤干细胞的新型免疫治疗策略与方案提供了重要科学论据,为深入探讨增效杀瘤作用机制奠定了基础。
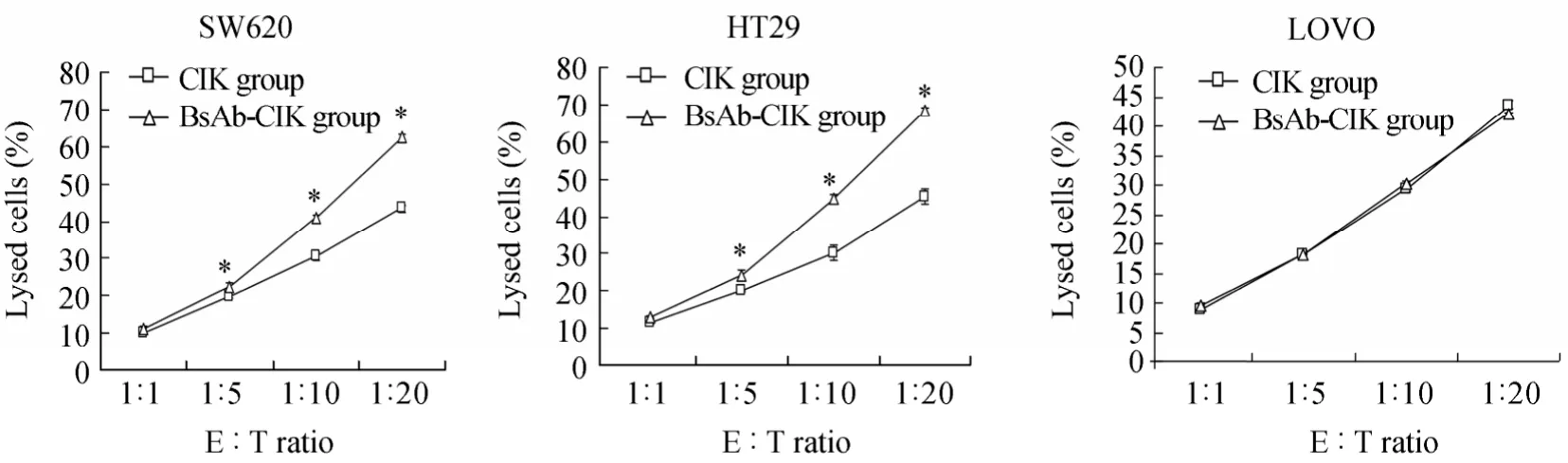
图4 CIK和BsAb-CIK细胞杀伤结直肠癌细胞系Figure 4 The killing effect of CIK and BsAb-CIK cells on the human colorectal cancer cell lines (n=3)
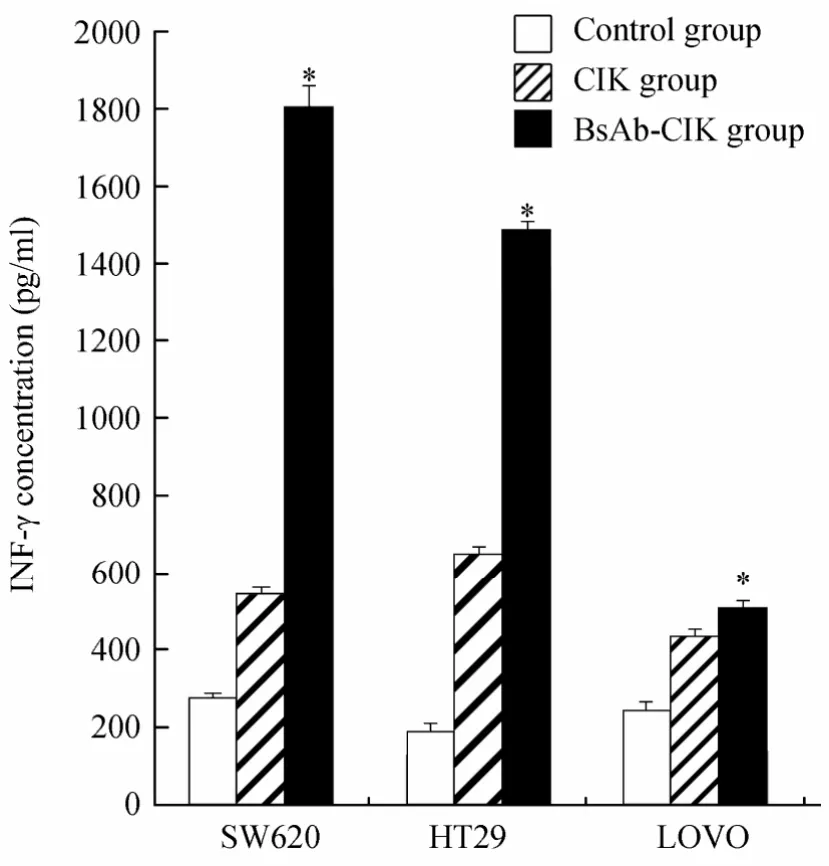
图5 CIK组和BsAb-CIK组INF-γ分泌水平Figure 5 Secretion level of INF-γ in CIK group and BsAb-CIK group (n=3)
表1 各组移植瘤经治疗后肿瘤瘤重比较Table 1 Comparison of tumor weight after treatment in each group(n=9, g, ±s)

表1 各组移植瘤经治疗后肿瘤瘤重比较Table 1 Comparison of tumor weight after treatment in each group(n=9, g, ±s)
Compared with CIK group, *P<0.05
Cell line Control group CIK group BsAb-CIK group SW620 3.74±0.09 2.80±0.11 1.54±0.12*HT29 1.42±0.18 0.72±0.23 0.43±0.18*
【参考文献】
[1]Jemal A, Bray F, Center MM,et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2]Hazama S, Nakamura Y, Tanaka H,et al. A phase Ⅱ study of five peptides combination with oxaliplatin-based chemotherapy as a first-line therapy for advanced colorectal cancer (FXV study)[J]. J Transl Med, 2014, 12: 108.
[3]Reya T, Morrison SJ, Clarke MF,et al. Stem cells, cancer,and cancer stem cells[J]. Nature, 2001, 414(6859): 105-111.
[4]Mimeault M, Batra SK. New advances on critical implications of tumor- and metastasis—initiating cells in cancer progression, treatment resistance and disease recurrence[J]. Histol Histopathol, 2010, 25(8): 1057-1073.
[5]Jin L, Hope KJ, Zhai Q,et al.Targeting of CD44 eradicates human acute myeloid leukemic stem cells[J]. Nat Med, 2006,12(10): 1167-1174.
[6]Klonisch T, Wiechec E, Hombach-Klonisch S,et al. Cancer stem cell markers in common cancers—therapeutic implications[J]. Trends Mol Med, 2008, 14(10): 450-460.
[7]Singh SK, Clarke ID, Terasaki M,et al. Identification of a cancer stem cell in human brain tumors[J]. Cancer Res, 2003,63(18): 5821-5828.
[8]Sangiolo D. Cytokine induced killer cells as promising immunotherapy for solid tumors[J]. J Cancer, 2011, 2:363-368.
[9]Tita-Nwa F, Moldenhauer G, Herbst M,et al.Cytokine-induced killer cells targeted by the novel bispecific antibody CD19×CD5 (T5.16×HD37) efficiently lyse B-lymphoma cells[J]. Cancer Immunol Immunother, 2007,56(12): 1911-1920.
[10]Chan JK, Hamilton CA, Cheung MK,et al. Enhanced killing of primary ovarian cancer by retargeting autologous cytokine-induced killer cells with bispecific antibodies: a preclinical study[J]. Clin Cancer Res, 2006, 12(6):1859-1867.
[11]O’Brien CA, Pollett A, Gallinger S,et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J]. Nature, 2007, 445(7123):106-110.
[12]Ricci-Vitiani L, Lombardi DG, Pilozzi E,et al. Identification and expansion of human colon-cancer-initiating cells[J].Nature, 2006, 445(7123): 111-115.
[13]Takayama T, Sekine T, Makuuchi M,et al. Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: a randomized trial[J]. Lancet,2000, 356 (9232): 802-807.
[14]Hontscha C, Borck Y, Zhou H,et al. Clinical trials on CIK cells: first report of the international registry on CIK cells(IRCC)[J]. Cancer Res Clin Oncol, 2011, 137(2): 305-310.
[15]Smith LM, Nesterova A, Ryan MC,et al. CD133/prominin-1 is a potential therapeutic target for antibody-drug conjugates in hepatocellular and gastric cancers[J]. Br J Cancer, 2008,99 (1): 100-109.
