超声波辅助乙醇法浸提无核紫葡萄花青素工艺研究
2015-04-23贾文婷吴洪斌金新文
杨 慧,贾文婷,吴 宏,吴洪斌,金新文*
(新疆农垦科学院农产品加工研究所 新疆农垦科学院农产品加工重点实验室 石河子 832000)
葡萄是一种世界性的水果,富含糖、氨基酸、维生素等营养成分,因其营养价值高,被誉为“世界水果的明珠”[1-2]。无核紫葡萄(Vitis romanetiiRom.Caill.)别名无核黑、马纽卡(Monukka),属中晚熟品种,抗寒性、抗病性良好。果穗圆锥形,果皮呈紫红色,皮薄肉脆、肉质细腻、酸甜可口,可溶性固形物含量18%~21%,属鲜食、制干、制汁多用的优新品种,该品种现已在新疆大面积推广[3-4]。目前新疆无核紫葡萄主要用于鲜食和制干[3-5]。
花青素(anthocyanidin)又称花色素,属黄酮类化合物,是一类广泛分布在自然界中的多酚化合物,在植物的根、叶、茎和果实中广泛存在。在自然状态下,花青素在植物体内常与各种单糖结合形成糖苷,称为花色苷。1853年,由Marguart用来命名矢车菊花朵中的蓝色提取物,现在作为同类物质的总称[6]。花青素具有防止脑神经老化、清除体内自由基、保护视力等多种生理活性功能[7]。目前对花青素的提取方法主要有溶剂提取法、超声提取法、超临界二氧化碳提取法[8-10]。超声提取法具有明显的优势,其强烈的空化效应、局部高温和高加速度能使细胞壁的通透性提高,加速花青素进入溶剂,提高提取率[11-14]。本试验用超声波技术辅助乙醇法浸提无核紫葡萄中的花青素,以获得较高纯度的花青素,以期使新疆无核紫葡萄资源得到更充分利用,为新疆无核紫葡萄深加工和综合利用提供理论依据和技术参考。
1 材料与方法
1.1 材料与试剂
新鲜无核紫葡萄:购自于石河子市果蔬批发市场。
HCl、KCl、CH3COONa和无水乙醇(均为分析纯):上海化学试剂有限公司。
pH 1.0 HCl-KCl缓冲液、pH 4.5 HCl-CH3COONa缓冲液、5%HCl-CH3CH2OH溶液:实验室配制[15]。
1.2 仪器与设备
DFY-500型高速万能粉碎机:浙江温岭市林大机械有限公司;Neofuge 13台式高速离心机:力康发展有限公司;BSA-CW型万分之一天平:北京赛多利斯仪器系统有限公司;UV 2600型紫外可见分光光度计:日本岛津有限公司;R-201型旋转蒸发仪:德国海尔道夫公司;KQ-100DE型超声波清洗器:昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 无核紫葡萄中花青素提取工艺及操作要点
无核紫葡萄→预处理→粉碎→超声波浸提→离心→上清液→定容→花青素测定
操作要点:将购买的新鲜无核紫葡萄去柄,用蒸馏水洗净,沥干待用。称取预处理过的无核紫葡萄100 g,用高速粉碎机粉碎,精确称取1.000 0 g无核紫葡萄匀浆于100 mL三角瓶中,按照不同的料液比、提取温度、提取时间和乙醇体积分数设计试验在180 W超声功率条件下进行超声波提取,在4 000 r/min条件下旋转离心,得到澄清的色素上清液。取2 mL上清液,用5%HCl-CH3CH2OH稀释定容至100 mL,分别移取10 mL,用pH 1.0 HCl-KCl缓冲液和pH 4.5 HCl-CH3COONa缓冲液稀释至100 mL,静置一段时间,测定花青素含量。
1.3.2 无核紫葡萄花青素的光谱分析
将无核紫葡萄花青素提取液在波长450~600 nm范围内进行光谱扫描分析,得出无核紫葡萄花青素的吸收光谱图,以确定最大吸收波长。
1.3.3 无核紫花青素含量及其得率测定
用pH示差法原理对无核紫葡萄中花青素进行定量分析。pH示差法原理是花青素发色团的结构转换是pH的函数,而起干扰作用的褐色降解物的特性不随pH变化。结合朗伯-比尔定律,在花青素最大吸收波长下pH 1.0和pH 4.5的花青素溶液的吸光度值差值与花青素的含量成比例。根据FULEKI T的经验公式[16]可计算出无核紫葡萄中的花青素含量。试验以蒸馏水作空白,计算公式如下:
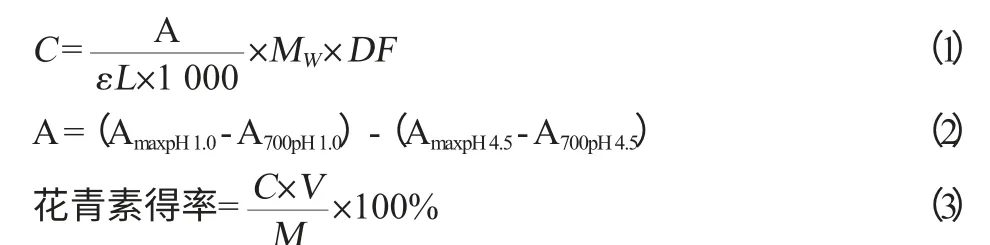
式(1)中:C为无核紫葡萄提取液花青素含量,g/L;A表示吸光度值,由式(2)换算得来;ε为摩尔消光系数,26 900;L为比色皿光程,1 cm;MW为花青素分子质量,449.2;DF为稀释倍数50。
式(2)中:A700用来抵消无核紫葡萄样液浑浊的影响。
式(3)中:V为无核紫葡萄提取液体积,mL;M为无核紫葡萄质量,g。
1.3.4 单因素试验设计
乙醇体积分数的确定:分别选择乙醇体积分数为50%、60%、70%、80%、90%,在料液比1∶20(g∶mL),提取温度50 ℃条件下提取50 min,测定无核紫葡萄花青素含量及其得率。
料液比的确定:料液比分别为1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL),在乙醇体积分数为70%、提取温度50 ℃条件下提取50 min,测定无核紫葡萄花青素含量及其得率。
提取温度的确定:提取温度分别为30 ℃、40 ℃、50℃、60 ℃、70 ℃,在乙醇体积分数为70%、料液比1∶20(g∶mL)条件下提取50 min,测定无核紫葡萄花青素含量及其得率。
提取时间的确定:分别设定提取时间为30 min、40 min、50 min、60 min、70 min,在乙醇体积分数为70%、料液比1∶20(g∶mL),提取温度50 ℃条件下提取,测定无核紫葡萄花青素含量及其得率。
1.3.5 正交试验设计
根据单因素试验结果,选取乙醇体积分数、料液比、提取温度和提取时间4个对无核紫葡萄提取率影响显著的因素,进行L9(34)正交试验,以花青素得率为评价指标,最终确定新疆无核紫葡萄花青素提取的最佳工艺条件。正交试验设计因素与水平见表1。

表1 花青素提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for anthocyanin extraction conditions optimization
2 结果与分析
2.1 无核紫葡萄在可见光区的最大吸收波长的确定
将无核紫葡萄提取液在波长450~600 nm范围内进行光谱扫描,结果见图1。由图1可知,无核紫葡萄花青素的最大吸收波长为510 nm。
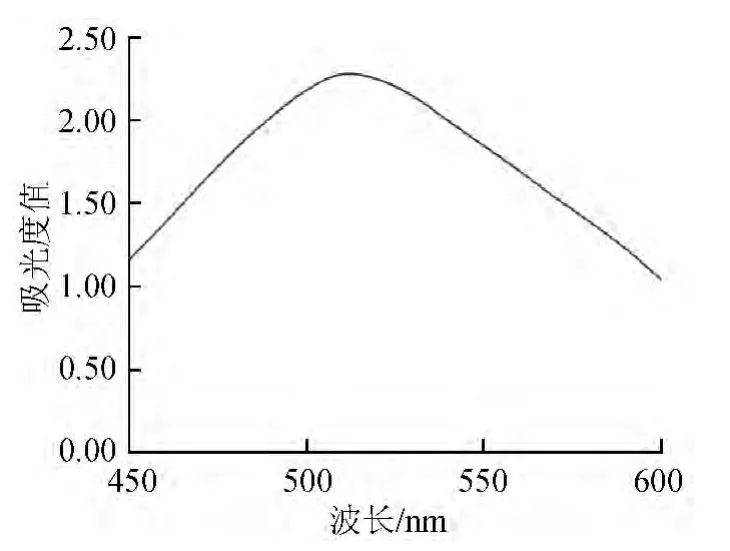
图1 无核紫葡萄花青素吸收光谱Fig.1 Absorption spectrogram of anthocyanin Monukka grapes
2.2 各因素对提取效果的影响
2.2.1 不同乙醇体积分数对提取效果的影响
不同乙醇体积分数条件下的花青素得率如图2所示。
由图2可知,不同的乙醇体积分数对花青素提取效果有显著影响,乙醇体积分数60%时得率最高。但随着乙醇体积分数继续升高,花青素的得率逐渐降低,原因可能是花青素具有两性特征,即其结构中含有显酸性的酚羟基和显碱性的四价氧原子,致使花青素稳定性受pH值变化影响较大,pH值过高或过低都会直接影响色素的提取效果,因此选择乙醇最佳体积分数为60%。
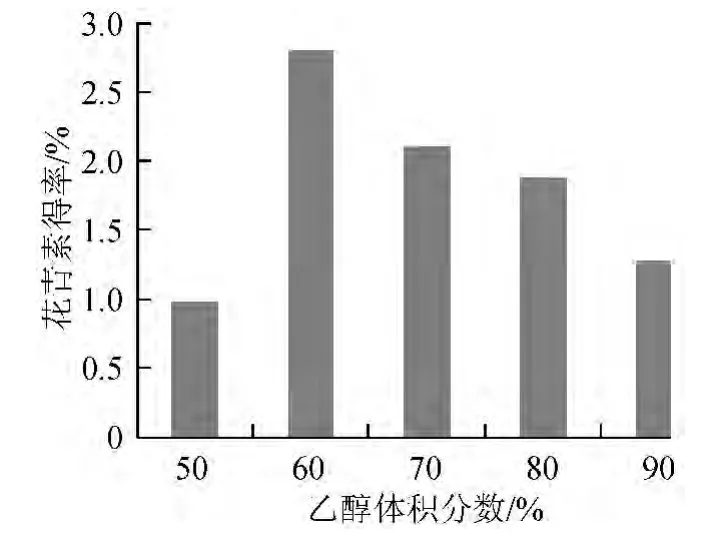
图2 乙醇体积分数对花青素得率的影响Fig.2 Effect of ethanol concentration on anthocyanln yield
2.2.2 料液比对花青素提取效果的影响
不同料液比条件下的花青素得率如图3所示。
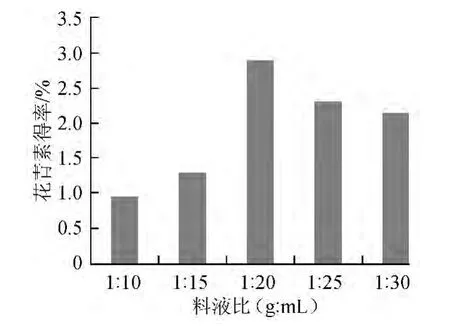
图3 料液比对花青素得率的影响Fig.3 Effect of solid liquid ratio on anthocyanln yield
由图3可以看出,当料液比<1∶20(g∶mL)时,花青素得率随料液比的增加而增加,料液比>1∶20(g∶mL)时,得率极速下降后趋于平稳。说明料液比过大,溶剂中含有大量的乙醇,与固体物料接触机率增大,极性减小,不利于花青素的提取。因此选取1∶20(g∶mL)为最佳料液比。
2.2.3 提取时间对花青素提取效果的影响
不同提取温度条件下的花青素得率如图4所示。
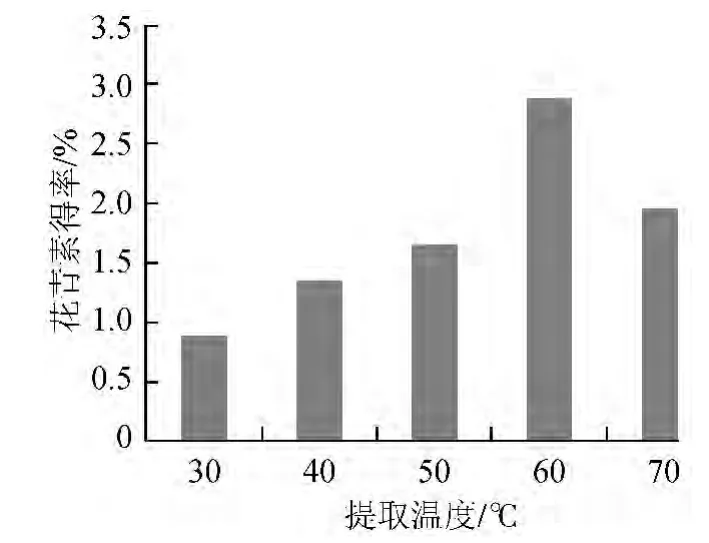
图4 温度对花青素得率的影响Fig.4 Effect of temperature on anthocyanln yield
由图4可知,随着提取温度的升高,花青素得率逐渐增大,温度达到60 ℃时花青素得率最大,当温度>60 ℃后,花青素得率迅速降低,原因可能是温度过高使花青素稳定性降低,导致花青素降解。故选取最佳提取温度为60 ℃。
2.2.4 提取时间对花青素提取效果的影响
不同提取时间的花青素得率如图5所示。
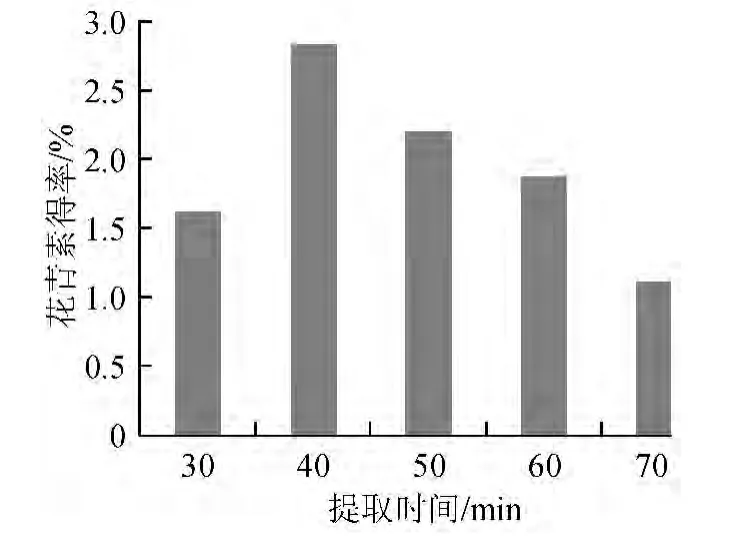
图5 提取时间对花青素得率的影响Fig.5 Effect of extraction time on anthocyanln yield
由图5可知,提取时间40 min时花青素得率最高,为2.85%,随着提取时间的延长,花青素得率开始降低,原因可能是超声波具有较强的机械剪切作用,长时间作用会破坏花青素的内部结构,导致花青素降解。因此提取时间为40 min最为合适。
2.3 提取无核紫葡萄花青素的最佳工艺
在单因素试验的基础上,对乙醇体积分数、料液比、提取温度、提取时间进行L9(34)正交试验,试验设计及分析结果见表2,方差分析见表3。
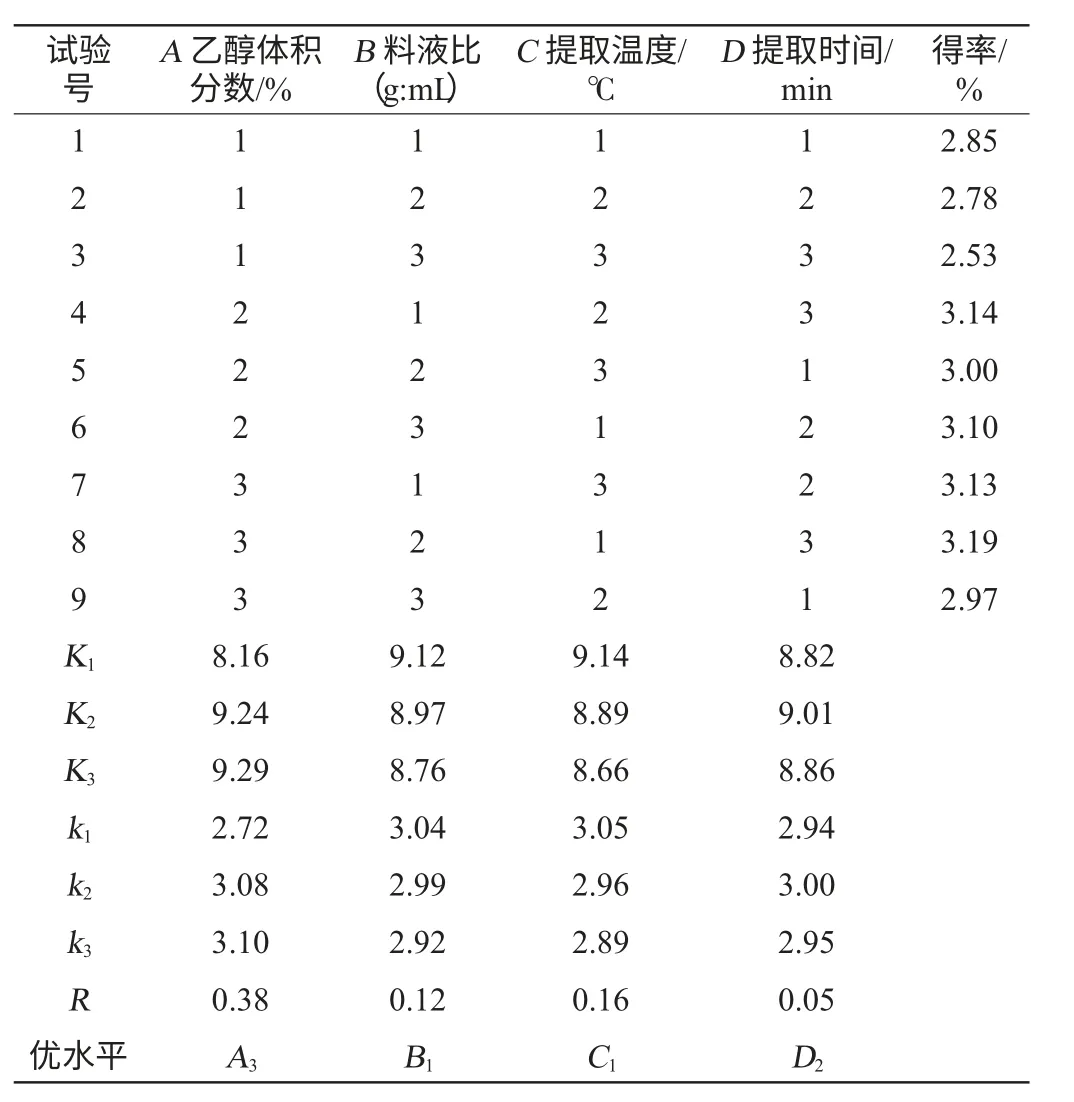
表2 花青素提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments foranthocyanin extraction conditions optimization
从表2极差分析结果可以看出,乙醇体积分数的极差最大,其次是提取温度、料液比、提取时间,可见影响无核紫葡萄花青素得率的因素主次顺序为A>C>B>D,即乙醇体积分数>提取温度>料液比>提取时间。无核紫葡萄花青素超声提取的最佳工艺组合为A3B1C1D2,即乙醇体积分数为65%、料液比为1∶15(g∶mL)、提取温度为50 ℃、提取时间为40 min。在此条件下进行3次验证试验,结果无核紫葡萄花青素平均得率为3.35%,高于正交试验表中最大得率3.19%,故可认为该组合为超声波辅助法提取无核紫葡萄花青素的最佳提取工艺。
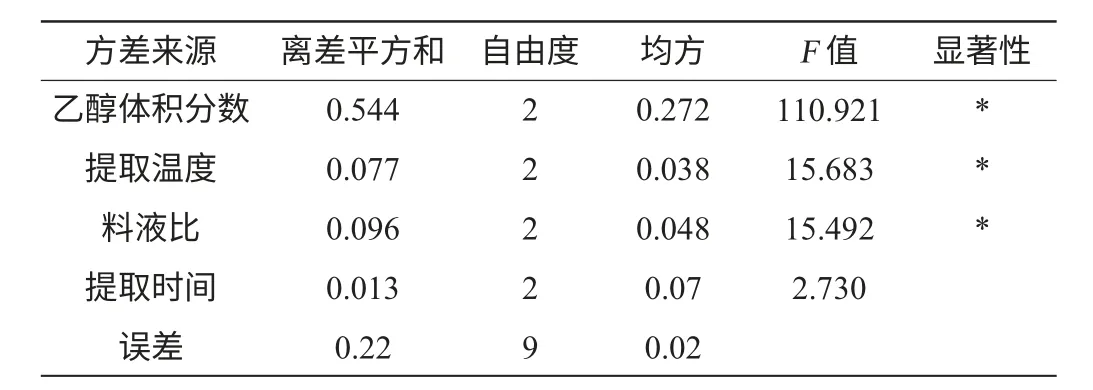
表3 正交试验结果方差分析Table 3 Variance analysis results of orthogonal experiments
由表3方差分析可知,乙醇体积分数、提取温度和料液比均为显著因素,而提取时间在试验设计水平下为不显著因素。原因可能是超声波强烈的空化效应和机械剪切作用,提取30~50 min已经超过了限度,提取效果已达最大化,因此可以推论无核紫葡萄花青素提取时间应该控制在40 min以内。
2.4 对比试验
为了考察超声波辅助乙醇法提取无核紫葡萄花青素的得率,该文将其与传统乙醇浸提法进行了对比试验,结果如表4所示。

表4 无核紫葡萄花青素两种提取方法的比较Table 4 Comparison of two extraction methods of anthocyanin from Monukka grape
从表4可以看出,与传统乙醇法相比,超声波辅助乙醇法浸提无核紫葡萄花青素得率提高了20.5%,说明超声波技术能有效促进无核紫葡萄花青素的提取。
3 结论
单因素试验结果表明,新疆无核紫葡萄花青素超声提取过程中受乙醇体积分数、料液比、提取温度和提取时间4个因素影响较大,且各因素水平数据之间存在一定的梯度差。正交试验结果表明,无核紫葡萄中花青素最佳提取工艺条件为乙醇体积分数65%、料液比1∶15(g∶mL)、提取温度50 ℃、提取时间40 min。此条件下花青素平均得率为3.35%。对比试验结果表明,超声波辅助乙醇法较传统乙醇法浸提效果好,花青素得率提高了20.5%。
利用超声波技术辅助乙醇法提取无核紫葡萄花青素具有节约时间、能耗低、提取率高等优点,可为大规模工业化生产无核紫葡萄花青素的提供理论基础。
[1]乔宪生.中国葡萄及其加工品贸易现状与发展方向[J].中国食物与营养,2004(3):27-31.
[2]XU X Q,CHENG G,DUAN L L,et al.Effect of training systems on fatty acids and their derived volatiles in Cabernet Sauvignon grapes and wines of the north foot of Mt.Tianshan[J].Food Chem,2015,181(15):198-206.
[3]杨文侠,高振江,谭红梅,等.气体射流冲击干燥无核紫葡萄及品质分析[J].农业工程学报,2009,25(4):237-242.
[4]SINGH S P,JAIRAJ K S,SRIKANT K.Universal drying rate constant of seedless grapes:A review[J].Renew Sust Energ Rev,2012,16(8):6295-6302.
[5]周晓明,韩立群.新疆不同葡萄品种制干前后果重及果形变化的研究[J].中国农学通报,2013,29(18):187-192.
[6]亓 伟,张亓伊雯,格日勒.酿酒葡萄渣粕原花青素提取工艺研究[J].中国酿造,2014,33(5):137-141.
[7]徐亚伟,于晓明,张 欣.水蜡树果中原花青素的最佳提取工艺研究[J].北方园艺,2010,22(35):45-47.
[8]郑先哲,陶 岩,李秀伟,等.微波萃取蓝莓中花青素获取和降解的同步模型[J].东北农业大学学报,2014,45(11):108-115.
[9]顾焰波,谭晓艳,江 冰.纤维素辅助提取苹果皮中原花青素的工艺研究[J].中国食品添加剂,2014(6):102-106.
[10]姜贵全,方桂珍,张卓睿,等.超临界CO2辅助-超声波强化对落叶松树皮原花青素提取工艺的研究[J].食品工业科技,2013,34(18):257-261.
[11]柯春林,郭 猛,王 娣,等.蔓越莓原花青素的提取工艺及其体外抗氧化活性研究[J].应用化工,2015(1):81-84.
[12]李 璐,倪婷婷,关文玉,等.基于响应面法提取“紫鹃”茶花青素最佳工艺的优化研究[J].2014,27(4):1704-1706.
[13]张莉弘,吴 琼,牟 莉,等.蓝莓花青素的提取工艺研究[J].食品研究与开发,2014,35(15):49-51.
[14]NICOLETTI I,BELLO C,DE ROSSI A.Identification and quantification of phenolic compounds in grapes by HPLC-PDA-ESI-MS on a semim-icroseparation scale[J].J Agr Food Chem,2008,56(19):8801-8808.
[15]杨兆艳.pH 示差法测定桑椹红色素中花青素含量的研究[J].食品科技,2007(4):201-202.
[16]FULEKI T,FRANCIS F J.Quantitative method for anthocyanins 2 determination of total antocyanin and degraiton index for cranberry juice[J].Food Sci,1968,33:78-83.
