低温锻炼对酿酒酵母发酵特性的影响
2015-04-23吴苏生郑祖亮张玲玲
吴苏生,白 亮,郑祖亮,张玲玲,刘 晴,赵 辉,杜 刚*
(天津商业大学 生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
低温发酵(10~15 ℃)可以减少高级醇含量以及增加萜烯类和乙酸酯类香气物质[1-2],从而提高葡萄酒的风味[3-4],因此低温发酵技术被广泛的应用于葡萄酒的生产中。例如,白葡萄酒和桃红葡萄酒的发酵温度为10~15 ℃,冰酒和起泡葡萄酒的瓶内二次发酵温度为8 ℃左右。然而酿酒酵母(Saccharomyces cerevisiae)的最适发酵温度为25~28 ℃,低温发酵不仅降低酵母细胞的生长速率,延长潜伏期至一周以上,而且降低发酵速率,使发酵周期延长至两周以上,给葡萄酒产业带来巨大损失[5]。因此,选育具有优良发酵性能的低温酿酒酵母对葡萄酒产业的发展至关重要。
为了保持葡萄酒酵母代谢研究中发酵培养基成分的一致性,模拟合成葡萄汁培养基被广泛应用到实验室的研究中[6]。在实际操作中,活性干酵母的活化温度为40 ℃左右,而发酵温度为10~15 ℃,若直接把活化好的酵母接种到发酵罐内,会对酵母的存活率和发酵的启动产生不良影响,使发酵启动点推迟。为了使酵母适应这种低温的发酵环境,实际操作中,先将活化好的酵母与葡萄汁混合,再控制温度逐渐下降至发酵温度,目的是使酿酒酵母适应低温的发酵环境后再启动发酵。但此低温锻炼操作缺乏科学性解释并且相关的低温锻炼的研究较少且不够深入,因此,该文开展与低温锻炼相关的研究,不仅可以用于解释上述干酵母活化实际操作的科学性,而且对低温锻炼的研究内容提供了理论依据。
1 材料与方法
1.1 材料与试剂
霞多丽葡萄:采摘于北京郊区的葡萄园。
酿酒酵母(Saccharomyces cerevisiae)BH8:从中科院植物所选育的酿酒品种“北红”中筛选得到并由中科院微生物研究所鉴定[7]。
硫代硫酸钠、硫酸铵、酒石酸、亚甲基蓝、柠檬酸钠、浓硫酸、氯化钾、磷酸二氢钾、无水乙醇等均为分析纯:北京蓝弋化工产品有限责任公司;葡萄糖、蛋白胨、酵母膏:淮坊盛泰药业有限公司;二烷酸二甲酯(dimethyl dicarbonate)、4-羟乙基哌嗪乙磺酸(4-(2-hydroxyerhyl)piperazine-1-erhaesulfonic acid,hepes)缓冲液、磷酸二羟基丙酮(dihydroxyacetone phosphate,DHAP)、尼克酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、乙二胺四乙酸(ethlenediaminetetra acetic acid,EDTA)、二硫苏糖醇(dithiothreitol,DTT)、牛血清白蛋白(albumin from bovine serum,BSA):美国Sigma公司。
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)培养基:葡萄糖2.0%,酵母膏2.0%,蛋白胨2.0%,pH 7.0,121 ℃灭菌20 min[8]。
1.2 仪器与设备
Waters2695高效液相色谱仪、Waters2414示差检测器、Aminex HPX-87H色谱柱:美国伯乐公司;Q700超声破碎仪:宁波天生科技有限公司;0.22 μm纤维素膜:广州市荔湾区精科玻璃仪器贸易商行;SW-CJ-1F型单人双面净化工作台:苏州净化设备有限公司;MPR-1411R-PC大容量环境试验箱:北京西冲科技发展有限公司;TGL-16型高速台式离心机:江苏省金坛市医疗仪器厂;WP-1型紫外分析仪:温州永嘉上塘教学仪器厂。
1.3 实验方法
1.3.1 低温锻炼
酿酒酵母BH8在YPD培养基中25 ℃培养12 h,然后每隔10 min控制温度下降1 ℃,直到温度降至13 ℃。以未经过低温锻炼的酿酒酵母为对照,把未经锻炼的酿酒酵母称为B,经过低温锻炼的酿酒酵母称为B1。
1.3.2 低温发酵试验
霞多丽葡萄经压榨后,在10 ℃澄清18 h,然后分离出清汁并添加20 mg/L二氧化硫,含糖量调至200 g/L。利用硫酸铵将含氮量调至190 mg/L[9],因酒石酸在葡萄和葡萄酒中均有存在,并且不容易被酵母菌代谢,故利用85%的酒石酸将葡萄汁的pH值调为3.3。最后添加体积分数为0.2%的二烷酸二甲酯,将葡萄汁于4 ℃静置48 h,消除微生物的污染[10]。
发酵液装液量为400 mL/500 mL,顶部连有发酵栓,其可使酵母代谢产物二氧化碳排出和发酵过程中对发酵液的取样,同时又阻止了外部氧气的进入。起始加入的酿酒酵母约为1×106个/mL。低温发酵试验在13 ℃进行,3个重复,静置发酵。
1.3.3 发酵液密度测定及细胞活性分析
发酵液密度(ρ)的测定通过称取5 mL(v)发酵液的质量(m)求得(ρ=m/v)[11];活细胞数的测定通过亚甲基蓝染色后的镜检结果计算[12];发酵速度用失重表示,为整个装置每天所减轻二氧化碳质量,二氧化碳质量即从发酵栓中溢出的气体质量测定,每天定时对发酵栓中发酵液进行摇匀,使二氧化碳从发酵栓中溢出直至无气泡溢出时,对整个发酵装置称质量。当二氧化碳的减少量<0.2 g/(L·d)时认为发酵结束。发酵速度计算公式如下:
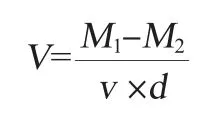
式中:V为发酵速度,g/(L·d);M1为装置第N天的总质量,g;M2为装置第N+1天的总质量,g;v为发酵液的体积,L;d为时间,d。
1.3.4 理化指标的测定
葡萄糖、果糖、海藻糖、甘油、琥珀酸、乙酸和乙醇含量通过高效液相色谱测定[13]。将上清液先通过0.22 μm的纤维素膜过滤,再经过Aminex HPX-87H色谱柱,流动相为5 mmol/L硫酸,流速0.6 mL/min,柱温65 ℃,进样量10 μL。
1.3.5 酶活性的测定
将干质量约10 mg的酵母悬浮于20 mmol/L 4 ℃的羟乙基哌嗪乙磺酸(hepes)(pH 7.1)缓冲溶液中30 min,利用超声破碎仪使酿酒酵母细胞破碎[14],将溶液在18 000×g,4 ℃离心30 min,所得上清液为粗酶液。
3-磷酸甘油脱氢酶(3-glycerophosphate dehydrogenase,GPD)的测定:依赖于NAD+的3-磷酸甘油脱氢酶是酵母菌甘油合成的关键酶。此酶活的测定是按照参考文献[15]的方法,略有改动。反应溶液包含20mmol/L(pH7.1)的Hepes缓冲液、20 mmol/L氯化钾、1 mmol/L EDTA、1 mmol/L DTT、5 mmol/L磷酸二羟基丙酮(DHAP)和0.1 mmol/L NADH。反应温度为30 ℃,加入DHAP后反应开始,NADH的减少通过波长340 nm条件下紫外分光光度计测定。溶液中蛋白质含量的减少量就相当于消耗的GPD酶量,蛋白含量的测定采用考马斯亮蓝法[17]。GPD酶活被定义为每分钟消耗1 μmol的NADH所需的酶量,以U/g表示,计算公式如下:
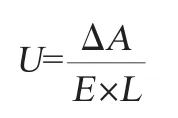
式中:U为GPD酶活性,U/g;ΔA为单位时间内的吸光度值变化;E为消光系数,ε340=6.2×103/(mmol·cm-1)[16];L为液层的厚度,cm。
乙醇脱氢酶(ethanol dehydrogenase,ADH)的测定:按照参考文献[18]的方法,略有改动。反应溶液包括50 mmol/L磷酸二氢钾,1.0 mmol/L NAD+,pH值为8.0,反应开始加入100 mmol/L的乙醇,反应温度为30 ℃,波长340 nm条件下紫外分光光度法测定吸光度值。考马斯亮蓝法测定蛋白质含量。
2 结果与分析
2.1 低温锻炼对酵母发酵动力及其主要代谢物的影响
发酵温度和酵母菌种都能够影响发酵速率、发酵时间、酵母生长及代谢物的含量,13 ℃条件下普通酵母菌和低温锻炼酵母菌对各种指标的影响见表1。由表1可知,与对照相比,经过低温锻炼的酿酒酵母B1发酵时间缩短2 d,发酵效率提高了7.41%;最大活菌数增加了8.33%;残糖量降低了16.28%;乙醇含量增加了4.04%;乙酸含量降低了6.70%。
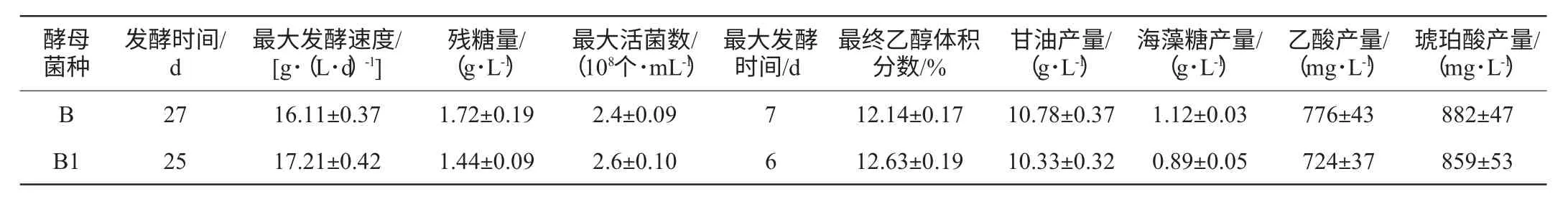
表1 低温发酵对于酿酒酵母发酵动力及其主要代谢物的影响Table 1 Effect of low temperature on fermentation kinetics and main metabolites of strains
目前研究已经证实甘油、海藻糖和琥珀酸等物质具有抗低温的性质,在低温发酵条件下酵母细胞会大量产生这些抗性物质使发酵得以继续进行[19]。然而与对照相比,经过低温锻炼的酵母产生的抗性物质却有所下降,其甘油产量下降了4.17%;海藻糖产量下降了20.53%;琥珀酸产量下降了2.61%。这种情况的产生很可能是酿酒酵母在低温锻炼过程中已经产生了抗低温的能力。
2.2 低温锻炼对乙醇、残糖和ADH活性动力曲线的影响
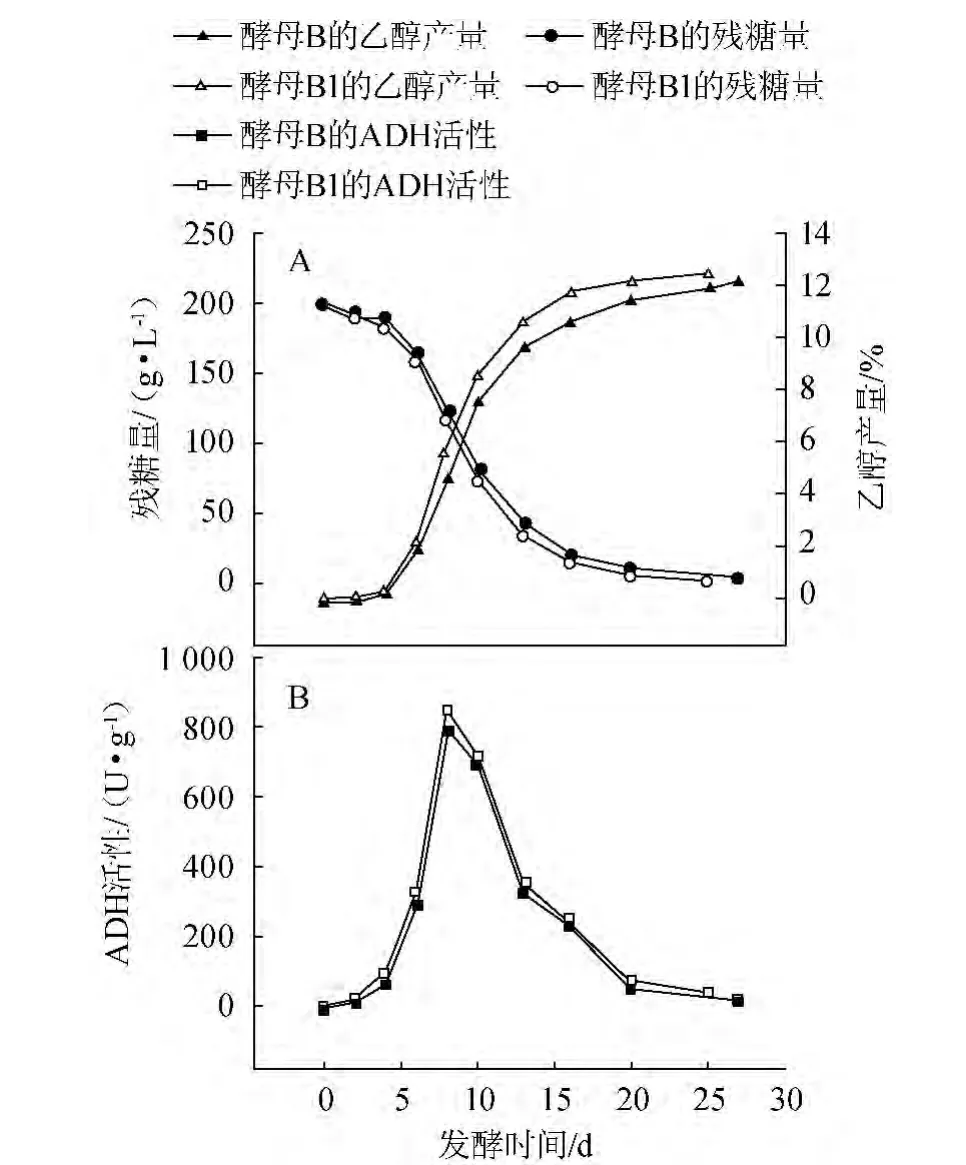
图1 低温发酵对酵母B和B1的残糖量、乙醇产量(A)和ADH活性(B)的影响Fig.1 Effect of low temperature fermentation with yeast B and B1 on residual sugar,ethanol production(A) and ADH activity(B)
图1A显示酵母菌B和B1在13 ℃发酵条件下糖的消耗和乙醇含量的变化趋势。由于受到低温的影响,两种酵母菌进入到酒精发酵的时间都比较晚,大约5 d左右发酵才开始启动。13 d后酒精发酵和糖的利用率都明显的减慢,未经低温锻炼和经过低温锻炼的菌株分别在第27天和第25天完成了酒精发酵的过程,各自产生12.14%和12.63%的乙醇,残留1.72 g/L和1.44 g/L的糖。
图1B显示低温发酵下ADH活性的动力曲线。未经低温锻炼和经过低温锻炼的菌株ADH活性都在第8天达到最大值,并且ADH活性在6~13 d都处于较大值。较为不同的是,经过低温锻炼的菌株其ADH活性比未经过低温锻炼的要高。这也使得经过低温锻炼的B1更快地完成酒精发酵,并且产生更多的乙醇和更少的残糖。
2.3 低温锻炼对甘油和GPD活性动力曲线的影响
低温发酵对酿酒酵母B和B1的甘油产量和GPD活性的动力学影响见图2。

图2 低温发酵对酵母B和B1的甘油产量和GPD活性的影响Fig.2 Effect of low temperature fermentation with yeast B and B1 on glycerol production and GPD activity
由图2可知,低温发酵条件下,发酵10 d以后,未经低温锻炼和经过低温锻炼的菌株甘油积累都明显减缓,并且其前10 d的产量分别到达总产量的70.4%和63.1%。最终甘油的产量分别为10.78 g/L和10.33 g/L。GPD活性最大值都在发酵第4天达到,然后酶活性迅速下降,10 d后趋于平缓。与未经低温锻炼的菌株略有不同的是,经过低温锻炼的菌株的GPD活性在第16天稍有增加,而未经低温锻炼的菌株B则平缓的下降。
3 结论
结果显示,经过低温锻炼的酿酒酵母其发酵速率和酵母活菌数均高于未经锻炼的酿酒酵母,从而使酒精发酵时间缩短,有利于成本的节约。造成这种结果的原因有可能在于经过低温锻炼的酿酒酵母可以使LOT1基因诱导表达,增加了酵母体内的不饱和脂肪酸的含量,从而增强了酵母耐受低温的抗性,使活菌数增加,发酵速率加快。另外,又可使酵母耐受酒精的能力增强[20]。
葡萄酒发酵过程中,酿酒酵母需要持续应对多种胁迫条件。为了能够继续生长,其产生了多个抗性分子,其中包括甘油、海藻糖、琥珀酸等。然而经过低温锻炼的酿酒酵母在产生这些抗性分子方面却少于未经过低温锻炼的酿酒酵母。造成这种情况的原因有可能是经过低温锻炼的酿酒酵母使得体内已经产生了针对低温胁迫的应答,或者其产生了许多的抗低温的分子,比如糖原等[21]。
酒精发酵过程中,经过低温锻炼的酿酒酵母酒精产量比未经过低温锻炼的酿酒酵母增加了4.04%,残糖量下降了16.28%,ADH的活性也有所提高。这些结果很可能是由于低温锻炼的酿酒酵母使ADH1基因表达量增加,从而提高了ADH的活性,使其产生更多的乙醇。另外,这也可能是因为经过低温锻炼使酿酒酵母活菌数增加,提高了糖的利用率,从而提高了乙醇产量。
葡萄酒发酵过程中,经过低温锻炼的酿酒酵母其GPD酶的最大活性略低于未经低温锻炼的酿酒酵母,而且在整个发酵的前期过程中也略低于对照组,最终的甘油、海藻糖和琥珀酸等具有抗低温性质的物质产量也低于对照组,但经过低温锻炼的酿酒酵母的乙醇产量却高于对照组。结果表明,虽然低温锻炼使酿酒酵母GPD酶活性略有降低,但经过低温锻炼使酿酒酵母产生了抗低温的性质。
经过低温锻炼的酿酒酵母如果能适应低温发酵的胁迫条件,对于很多只能在低温发酵的葡萄酒酒种质量的提高将会有很大的帮助,并且这种研究对于驯化筛选适应低温发酵的酿酒酵母都有理论的意义。
[1]BAKOYIANIS V,KANA K,KALIAFAS A,et al.Low-temperature wine making by kissiris-supported biocatalyst:volatile by-products[J].J Agr Food Chem,1992,41(3):465-468.
[2]KANDYLIS P,KOUTINAS A A.Extremely low temperature fermentations of grape must by potatoes supported yeast-strain AXAZ-1.A contribution is performed to catalysis of alcoholic fermentation[J].J Agr Food Chem,2008,56(9):3317-3327.
[3]GAMERO A,TRONCHONI J,QUEROL A,et al.Production of aroma compounds by cryotolerantSaccharomycesspecies and hybrids at low and moderate fermentation temperatures[J].J Appl Microbiol,2013,114(5):1405-1414.
[4]LÓPEZ-MALO M,CHIVA R,ROZES N,et al.Phenotypic analysis of mutant and overexpressing strains of lipid metabolism genes inSaccharomyces cerevisiae:implication in growth at low temperatures[J].Int J Food Microbiol,2013,162(1):26-36.
[5]KANDYLIS P,MANOUSI M E,BEKATOROU A,et al.Freeze-dried wheat supported biocatalyst for low temperature wine making[J].LWTFood Sci Technol,2010,43(10):1485-1493.
[6]RIOU C,NICAUD J M,BARRE P,et al.Stationary-phase gene expression inSaccharomycescerevisiaeduringwinefermentation[J].Yeast,1997,13(10):903-915.
[7]DU G,ZHAN J C,LI J Y,et al.Effect of fermentation temperature and culture medium on glycerol and ethanol during wine fermentation[J].Am J Enol Viticult,2012,63:132-138.
[8]徐亚男,刘秋萍,赵九洲,等.产淀粉酶非酿酒酵母菌的筛选及产酶特性研究[J].中国酿造,2014,33(8):90-94.
[9]AERNY J.Composés azotés des mo ts et vins.Revue Suisse de Viticulture[J].Arboriculture et Horticulture,1996,28(3):161-165.
[10]PÉREZ-TORRADO R,GIMENO-ALCAÑIZ J V,MATALLANA E.Wine yeast strains engineered for glycogen overproduction display enhanced viability under glucose deprivation conditions[J].Appl Environ Microb,2002,68(7):3339-3344.
[11]张多连.液体密度测定方法种种[J].甘肃教育,2006,15(15):52-53.
[12]MARAÑÓN I M D,CHAUDANSON N,JOLY N,et al.Slow heat rate increases yeast thermotolerance by maintaining the plasma membrane integrity[J].Biotechnol Bioeng,1999,65(2):176-181.
[13]MOREIRA N,MENDES F,HOGG T,et al.Alcohols,esters and heavy sulphur compounds production by pure and mixed cultures of apiculate wine yeasts[J].Int J Food Microbiol,2005,103(3):285-294.
[14]孙晓璐,孙玉梅,曹 芳,等.对产油脂酵母的细胞破碎方法及油脂提取效果的比较[J].河南工业大学学报:自然科学版,2007(4):67-69.
[15]GANCEDO C,GANCEDO J M,SOLS A.Glycerol metabolism in yeasts.Pathways of utilization and production[J].Eur J Biochem,1968,5(2):165-172.
[16]BLOMBERG A,ADLER L.Roles of glycerol and glycerol-3-phosphate dehydrogenase (NAD+)in acquired osmotolerance ofSaccharomyces cerevisiae[J].J Bacteriol,1989,171(2):1087-1092.
[17]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[18]黄清伟.乙醇脱氢酶活性测定方法[J].广东职业病防治,1980(2):37-39.
[19]郑祖亮,赵 辉,杜 刚.酿酒酵母低温耐受机制的研究进展[J].中国酿造,2015,34(1):1-4.
[20]ALEXANDRE H,ROUSSEAUX I,CHARPENTIER C.Ethanol adaptation mechanisms inSaccharomyces cerevisiae[J].Biotechnol Appl Biochem,1994,20(2):173-183.
[21]RADLER F,SCHUTZ H.Glycerol production of various strains ofSaccharomyces[J].Am J Enol Viticult,1982,33(1):36-40.
