海藻酸钠与羧甲基纤维素钠固定化高温碱性脂肪酶
2015-04-23虞凤慧马韵升刘圣鹏徐泽平刘结磊
虞凤慧,马韵升,刘圣鹏,徐泽平,3 *,李 锋,刘结磊
(1.黄河三角洲京博化工研究院有限公司,山东 滨州 256500;2.山东京博控股股份有限公司,山东 滨州 256500;3.滨州市环境微生物技术工程研究中心,山东 滨州 256500)
脂肪酶(1ipase,EC3.1.1.3)全称即三酰基甘油酰基水解酶,能在油-水界面上催化酯水解或醇解、酯合成、酯交换[1-3]、多肽等有机合成反应[4],是目前被重点研究的酶催化剂[5-6]。随着研究的逐渐深入,脂肪酶的生产技术日趋成熟,应用越来越广,但游离脂肪酶存在易失活、不易回收[7]、难重复使用等问题[8]。因此,在有机反应体系中,游离脂肪酶作为催化剂难以大规模应用。而固定化酶可解决以上问题,与游离酶相比,固定化酶在保持其高效专一及温和的酶催化反应特性的同时[9-10],又呈现操作稳定性高、分离回收容易、可多次重复使用、操作连续可控和工艺简便等优点[11-13],已成为目前研究的热点之一。近年来,脂肪酶固定化的研究日益增加,并广泛应用于食品、洗涤剂、油脂和制药等领域,在生物柴油制备方面也有重要应用[14]。
脂肪酶固定化的方法主要有包埋法、吸附法、共价结合法和交联法等[14-17]。包埋法具有不改变酶的结构、酶活收率高等优点,且包埋常用载体-海藻酸钠,因其价格低廉、具有良好的生物相溶性而受到广泛重视[11]。目前,海藻酸钠单独作为固定化载体的研究较多,而海藻酸钠与羧甲基纤维素钠共同作为载体的报道还不多见。本研究拟采用包埋法、以海藻酸钠和羧甲基纤维素钠为复合载体进行脂肪酶的固定化,通过单因素及正交试验筛选最优的固定化条件,期望为固定化脂肪酶的生产及应用提供参考。
1 材料与方法
1.1 材料与试剂
脂肪酶为毕赤酵母产高温碱性脂肪酶(70 kU/mL):实验室自制;其余试剂均为国产分析纯。
1.2 仪器与设备
HH-1型数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;85-2型数显恒温磁力搅拌器:江苏金坛城东光芒仪器厂。
1.3 方法
1.3.1 脂肪酶的固定化
分别称取一定质量的海藻酸钠和羧甲基纤维素钠,用蒸馏水加热溶解,配成一定含量的混合溶液,冷却后加入一定量的脂肪酶粗酶液,使总酶活为200 U,搅拌、混匀、静置。用注射器将无气泡的混合溶液逐滴加入0.1 mol/L CaCl2溶液中,固化30 min。纱布过滤,用蒸馏水洗净固定化颗粒,滤纸吸干水分,测定固定化酶酶活,计算酶活收率。
1.3.2 脂肪酶固定化条件的优化
分别考察不同固定化载体、载体含量、加酶量、CaCl2浓度及固定化时间对脂肪酶固定化的影响,以固定化酶酶活收率为指标,筛选各个单因素试验的最佳条件。
根据单因素试验结果,选择影响脂肪酶固定化的主要因素,进行正交设计,以固定化酶酶活收率为评价指标,筛选最优的固定化条件。
1.3.3 酶活力及酶活收率的测定
游离脂肪酶酶活力测定:参照GB/T 23535—2009《脂肪酶制剂》中指示剂滴定法。酶活定义:1 mL液体酶(或1 g固体酶粉),在40 ℃温度和pH 7.5条件下,1 min水解底物产生1 μmol可滴定的脂肪酸,即为1个酶活力单位,以U/mL(U/g)表示。
固定化脂肪酶酶活力测定:按照游离脂肪酶酶活力测定方法。酶活收率计算公式如下:

2 结果与分析
2.1 不同载体对脂肪酶固定化的影响
分别选择海藻酸钠、海藻酸钠-明胶(3∶1)、海藻酸钠-PEG600(3∶1)、海藻酸钠-聚乙烯醇(3∶1)、海藻酸钠-羧甲基纤维素钠(3∶1)为包埋载体,进行脂肪酶的固定化,载体终含量为1.5%,结果见图1。由图1可知,以海藻酸钠和羧甲基纤维素钠为复合载体时,脂肪酶的固定化效果最好,固定化酶酶活收率最高,为34.20%。因此,选择海藻酸钠-羧甲基纤维素钠复合载体进行后续脂肪酶固定化研究。
2.2 海藻酸钠含量对脂肪酶固定化的影响
海藻酸钠含量过大或者过小,都会显著影响酶的固定化效果。因此,固定羧甲基纤维素钠的含量为0.4%,筛选出海藻酸钠的最佳含量。分别设定海藻酸钠含量为0.5%、1.0%、1.5%、2.0%、2.5%,进行脂肪酶的固定化,结果见图2。由图2可知,海藻酸钠含量为1.0%时,脂肪酶的固定化效果最好,固定化酶酶活收率为42.55%。因此,确定海藻酸钠最佳含量为1.0%。
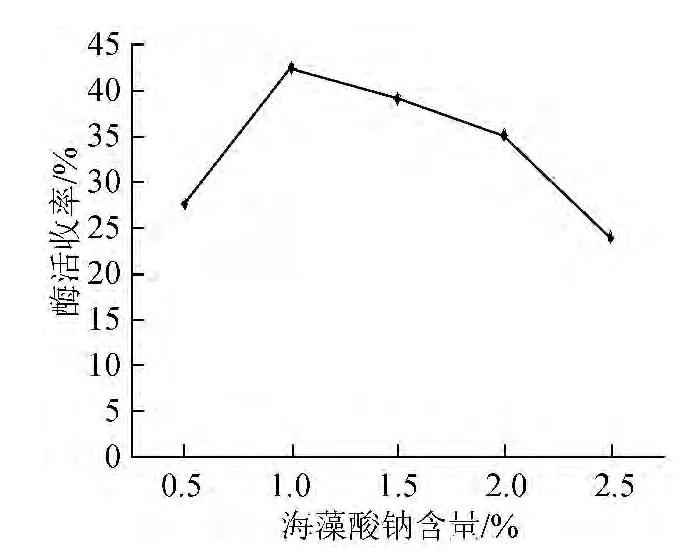
图2 海藻酸钠含量对脂肪酶固定化的影响Fig.2 Effect of sodium alginate content on lipase immobilization
2.3 羧甲基纤维素钠含量对脂肪酶固定化的影响
固定海藻酸钠含量为1.0%,分别设定羧甲基纤维素钠含量为0.1%、0.2%、0.4%、0.6%、0.8%,进行脂肪酶的固定化,结果见图3。由图3可知,羧甲基纤维素钠含量为0.4%时,固定化酶酶活收率为58.35%,因此,确定羧甲基纤维素钠最佳含量为0.4%。
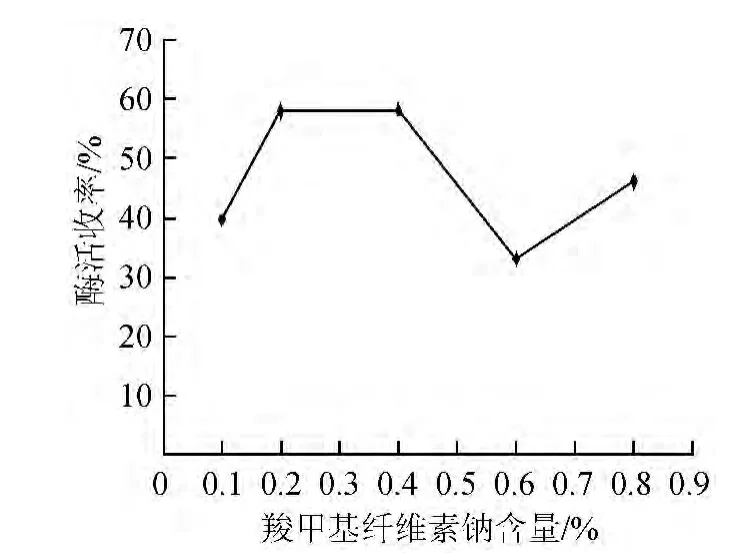
图3 羧甲基纤维素钠含量对脂肪酶固定化的影响Fig.3 Effect of carboxymethyl cellulose sodium content on lipase immobilization
2.4 加酶量对脂肪酶固定化的影响
固定上述最佳条件,分别设定脂肪酶添加量为50 U/(g载体)、100 U/(g载体)、150 U/(g载体)、200 U/(g载体)、400 U/(g载体)、800 U/(g载体),研究加酶量对脂肪酶固定化效果的影响,结果见图4。由图4可知,加酶量为100 U/(g载体)时,固定化酶酶活收率最高,随着加酶量的逐渐增加,酶活回收率呈明显的下降趋势。因此,确定加酶量为100 U/(g载体)。
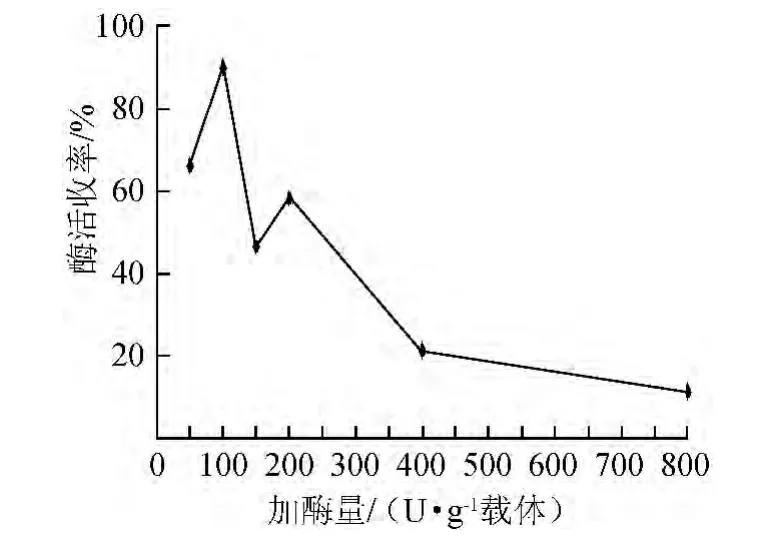
图4 加酶量对脂肪酶固定化的影响Fig.4 Effect of enzyme amount on lipase immobilization
2.5 CaCl2浓度对脂肪酶固定化的影响
固定上述最佳条件,分别设定CaCl2溶液浓度为0.1mol/L、0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L,研究CaCl2溶液浓度对脂肪酶固定化效果的影响,结果见图5。由图5可知,CaCl2溶液浓度为0.2 mol/L时,固定化酶酶活收率最高。因此,确定CaCl2溶液最佳浓度为0.2 mol/L。
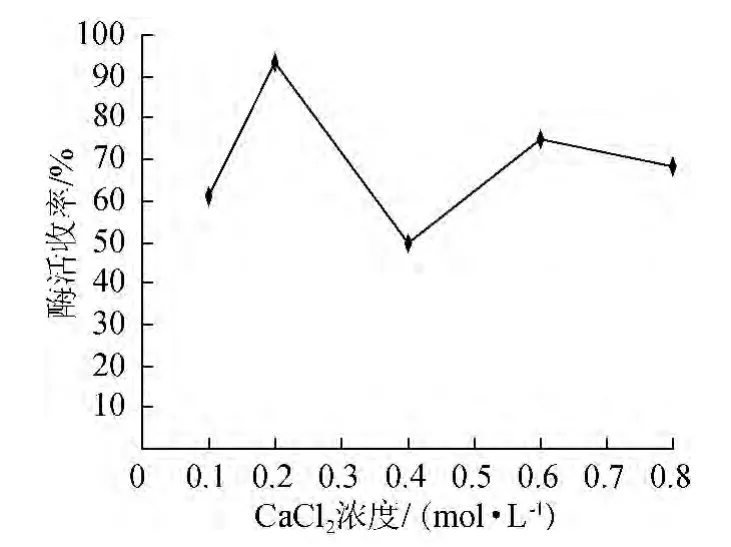
图5 CaCl2浓度对脂肪酶固定化的影响Fig.5 Effect of CaCl2concentration on lipase immobilization
2.6 固定化时间对脂肪酶固定化的影响
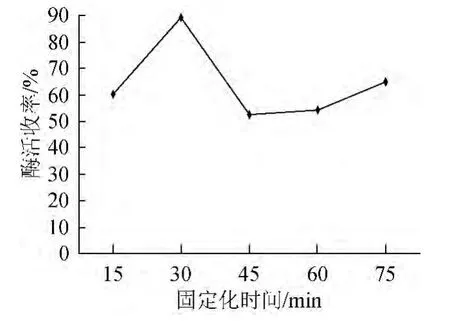
图6 固定化时间对脂肪酶固定化的影响Fig.6 Effect of immobilization time on lipase immobilization
固定上述最佳条件,分别设定固定化时间为15 min、30 min、45 min、60 min、75 min,研究固定化时间对脂肪酶固定化效果的影响,结果见图6。由图6可知,随着固定化时间的延长,固定化酶酶活收率呈先增加再减少后趋于稳定的趋势,30 min为最佳固定化时间。
2.7 脂肪酶固定化条件优化正交试验
根据单因素试验结果,以海藻酸钠含量、羧甲基纤维素钠含量、加酶量、CaCl2浓度和固定化时间为5个影响因素,以固定化酶酶活收率为评价指标,设计L16(45)正交试验,因素与水平见表1,结果与分析见表2,方差分析结果见表3。
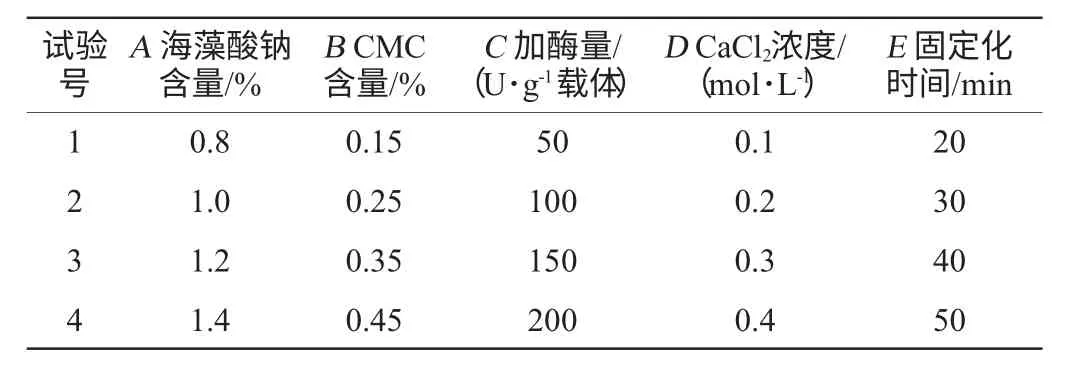
表1 脂肪酶固定化条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for lipase immobilization conditions optimization

表2 脂肪酶固定化条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for lipase immobilization conditions optimization
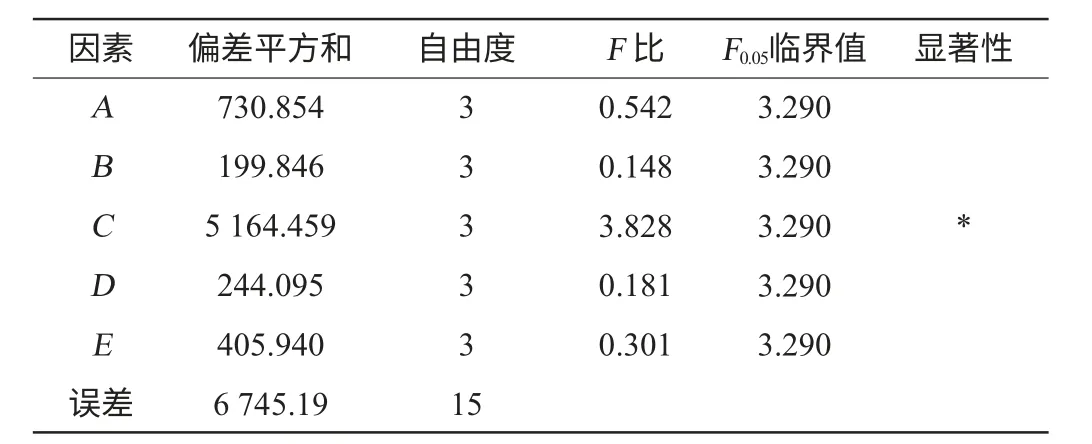
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2可知,影响固定化酶酶活收率的因素主次关系为RC>RA>RE>RD>RB,即酶与载体配比>海藻酸钠含量>固定化时间>CaCl2浓度>羧甲基纤维素钠含量。最佳组合为A2B2C1D4E3,即脂肪酶的最优固定化条件为海藻酸钠含量1.0%、羧甲基纤维素钠含量0.25%、加酶量50 U/g载体、CaCl2浓度0.4 mol/L,固定化时间40 min。并在此最优固定化条件下进行验证试验,得到固定化脂肪酶酶活收率达99.50%。由表3可知,加酶量对固定化酶酶活收率有显著影响,海藻酸钠含量、羧甲基纤维素钠含量、CaCl2浓度和固定化时间对固定化酶酶活收率影响均不显著。
3 结论
本研究采用包埋法进行了脂肪酶的固定化研究。以海藻酸钠和羧甲基纤维素钠为复合载体,通过单因素及正交试验对固定化条件进行了优化,得到最优固定化条件为海藻酸钠浓度为1.0%、羧甲基纤维素钠浓度为0.25%、加酶量为50 U/(g载体)、CaCl2浓度为0.4 mol/L,固定化时间40 min。期望为固定化脂肪酶的研究及生产提供理论依据。
[1]金红娣,王巧映,余 凯,等.海藻酸钠固定化脂肪酶的制备及性质研究[J].科技创新导报,2012(14):142.
[2]KLIBANOV A M.Improving enzymes by using them in organic solvents[J].Nature,2001,409(11):241-246.
[3]SHARMA D,SHARMA B,SHUKLA A K.Biotechnological approach of microbial lipase:a review[J].Biotechnology,2011,10(1):23-40.
[4]何 茹,刘 娅,谢晓霞,等.内生黑曲霉产脂肪酶条件研究及其粗酶酶学特性[J].中国酿造,2014,33(3):52-56.
[5]冯 超,蒋丽娟,黎继烈,等.固定化脂肪酶研究进展[J].食品工业科技,2011,32(2):373-375.
[6]刘新喜.脂肪酶固定化方法的研究进展[J].河北师范大学学报:自然科学版,2001,25(3):370-373.
[7]李 阳,韦 伟,曹 茜,等.脂肪酶固定化新材料[J].中国粮油学报,2014,29(7):122-127.
[8]REN Y H,RIVERA J G,HE L H,et al.Facile,high efficiency immobilization of lipase enzyme on magnetic iron oxide nanoparticles via a biomimetic coating[J].BMC Biotechnol,2011(11):63-71.
[9]张 斌,金 莉.固定化酶及其在食品中的应用[J].中国食品添加剂,2006(1):147-150.
[10]刘海洲,张媛媛,张广柱.固定化酶制备技术的研究进展[J].化学工业与工程技术,2009,30(1):21-23.
[11]于殿宇,罗淑年,王 瑾,等.海藻酸钠-明胶固定化磷脂酶的研究[J].食品工业,2008(3):9-10.
[12]韩志萍,叶剑芝,罗荣琼.固定化酶的方法及其在食品中的应用研究进展[J].保鲜与加工,2012,12(5):48-53.
[13]陈冬梅.固定化酶及其在食品工业中的应用[J].食品科学,2010,31(19):330-332.
[14]刘志勤,宋 笛.脂肪酶固定化及固定化脂肪酶的应用研究进展[J].农产品加工·学刊,2012(5):89-92.
[15]鲁玉侠,蔡妙颜,郭祀远,等.海藻酸钠包埋法制备固定化脂肪酶研究[J].现代食品科技,2006,22(4):30-32.
[16]王爱玲,杨江科,黄 瑛,等.海藻酸钠明胶协同固定化黑曲霉脂肪酶[J].应用化工,2007,36(4):317-320.
[17]MENDES A A,FREITAS L,DE CARVALHO A K,et al.Immobilization of a commercial lipase fromPenicillium camembertii(Lipase G) by different strategies[J].Enzyme Res,2011,doi:10.4061/2011/967239.
