老年患者显微镜下多血管炎临床及生存分析
2015-04-23金晓盛王文月程曼曼郑文洁喻昌利施举红
金晓盛,王文月,3,程曼曼,彭 敏,郑文洁,喻昌利,3,施举红*
老年患者显微镜下多血管炎临床及生存分析
金晓盛1,王文月1,3,程曼曼1,彭 敏1,郑文洁2,喻昌利1,3,施举红1*
(中国医学科学院北京协和医院:1呼吸科,2风湿免疫科,北京 100730;3华北理工大学附属医院呼吸科,唐山 063000)
探索老年人显微镜下多血管炎(MPA)的临床特点、转归和影响生存的因素。入选2007年1月至2012年12月期间在北京协和医院确诊并住院治疗的MPA患者191例。按年龄分为两组:≥65岁组和<65岁组。比较两组患者的临床资料,分析年龄对预后及生存的影响。对可能影响生存时间的因素进行Cox回归分析。两组患者比较,<65岁组以弥漫性肺泡出血(DAH)更为多见(=0.004);≥65岁组则以肺间充质病变常见(=0.016);≥65岁组患肾功能衰竭者明显多于<65岁组(=0.033);≥65岁组C−反应蛋白(CRP;=0.017)水平更高。采用Kaplan-Meier法绘制生存曲线,发现两组之间的生存函数差异有统计学意义(Log-rank=10.462,=0.001)。行Cox单因素分析,显示年龄(HR:1.04,=0.002)、白细胞(HR:0.65,=0.000)、CRP(HR:1.01,=0.006)、肌酐(HR:1.00,=0.006)、尿素氮(HR:1.03,=0.002)、肺部感染(HR:5.57,=0.000)、DAH(HR:2.11,=0.007)和BVAS评分(HR:1.12,=0.000)与发生死亡相关。行Cox多因素分析,结果提示只有年龄(HR:1.02,=0.003)、肺部感染(HR:3.79,=0.040)、DAH(HR:5.02,=0.004)和BVAS评分(HR:1.10,=0.000)是发生死亡的高危因素。MPA好发于老年人,无性别差异,高龄患者生存时间会明显缩短。
显微镜下多血管炎;临床特点;肺间充质疾病;预后;老年人
显微镜下多血管炎(microscopic polyangiitis,MPA)是一种系统性、坏死性小血管炎,主要累及小动脉、小静脉和毛细血管,也可累及中等动脉。MPA的病理特征为小血管节段性纤维素样坏死,无肉芽肿形成,免疫组织学检查无或寡免疫复合物沉积。最初名为显微镜下结节性多动脉炎,20世纪20年代后独立于结节性多动脉炎命名,并在1994年Chapel Hill共识大会被归为抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody,ANCA)相关性血管炎的一种。2013年更新版Chapel Hill仍然命名为显微镜下多血管炎[1]。
关于MPA临床特点和生存的研究,尤其是年龄对生存的影响,目前国内相对较少。欧美国家研究表明,MPA患者的平均年龄为50~57岁[2−4],日本研究显示ANCA相关性血管炎平均年龄为69.2岁[5],韩国研究MPA患者平均年龄为62.4岁[6]。国内研究显示,肾脏病起病的血管炎患者年龄>65岁者约占40%[7]。
本文对MPA患者的临床特征和治疗预后进行分析研究,旨在了解MPA患者重要脏器的受累情况及其他系统的临床表现,探讨影响其生存预后的危险因素。
1 对象与方法
1.1 研究对象
入选2007年1月至2012年12月期间在北京协和医院确诊并住院治疗的MPA患者191例。男性89例,女性102例,年龄17~85(63.1±13.84)岁。入选标准:(1)符合2012年美国Chapel Hill会议指定的MPA命名分类法[1];(2)ANCA阳性或ANCA阴性但经肾脏病理活检示节段坏死性肾小球肾炎。排除标准:(1)药物相关血管炎;(2)恶性肿瘤继发血管炎。按年龄分为两组:≥65岁组(=97)和<65岁组(=94)。
1.2 方法
1.2.1 重要脏器受累评估 (1)呼吸系统。弥漫肺泡出血,肺间充质病变。(2)肾脏。血尿、蛋白尿、肾功能不全。(3)外周神经系统。四肢麻木、感觉异常、肌力下降、运动障碍等。(4)中枢神经系统。脑出血,脑梗死,神志异常伴脑脊液改变(不包括外感染)。(5)消化道。消化道出血、恶心、腹泻。(6)心血管系统。心包积液、心肌梗死,心肌病变。
1.2.2 疾病活动程度评分 (1)五因子评分(Five Factor Score,FFS)[8]。每1项加1分:年龄>65岁;肾功能不全(血肌酐≥150µmol/L);重度消化道受累[出血、穿孔、梗死和(或)胰腺炎];心功能不全;中枢神经系统受累;耳鼻喉受累。(2)伯明翰血管炎活动程度评分(Birmingham Vasculitis Activity Score,BVAS)[9]。依据临床症状与体征评估病情活动度,评分内容包括一般情况、皮肤、黏膜/眼睛、耳鼻喉、胸部、心血管、腹部、肾脏和神经系统9大系统,共61项,每1项有不同权重分数,各大系统有总分限制。
1.2.3 治疗方法 191例患者中:190例患者接受了糖皮质激素治疗;1例因糖尿病仅用环磷酰胺治疗。190例接受糖皮质激素治疗患者中:183例应用糖皮质激素和环磷酰胺联合治疗;1例应用糖皮质激素和骁悉治疗;1例应用糖皮质激素和雷公藤联合治疗;5例仅糖皮质激素治疗。
1.3 统计学处理
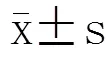
2 结 果
2.1 两组患者一般资料比较
两组患者除了C−反应蛋白(C-reactive protein,CRP)水平存在显著性差异(=0.017)外,性别、病程、非特异性临床表现和其他实验室检查结果的差异均无统计学意义(>0.05;表1)。
2.2 两组患者重要脏器受累情况比较
对呼吸系统受累情况的比较显示,两组患者出现弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH;=0.004)和双肺间充质病变(=0.016)的差异均存在统计学意义。对肾脏受累情况的比较显示,两组患者出现肾功能不全的差异存在统计学意义(=0.033)。对两组患者神经系统、消化系统及心脏受累情况的比较结果显示,差异均无统计学意义(>0.05;表2)。
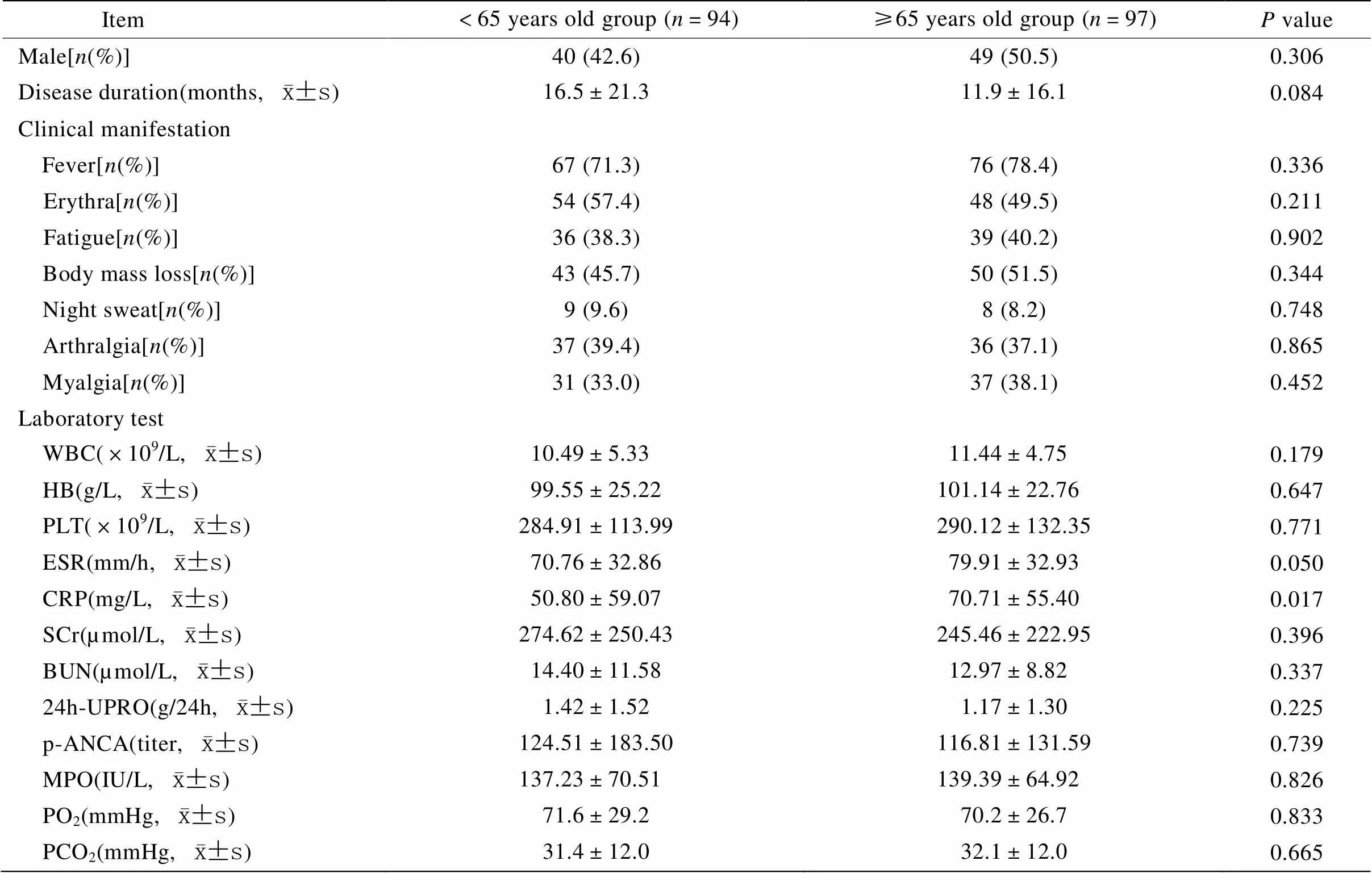
表1 两组患者一般资料比较
WBC: white blood cell; HB: hemoglobin; PLT: platelet; ESR: erythrocyte sedimentation rate; CRP: C-reactive protein; SCr: serum creatinine; BUN: blood urea nitrogen; UPRO: urine protein; p-ANCA: perinuclear anti-neutrophil cytoplasmic antibodies; MPO: myeloperoxidase; PO2: arterial partial pressure of oxygen; PCO2: arterial partial pressure of carbon dioxide
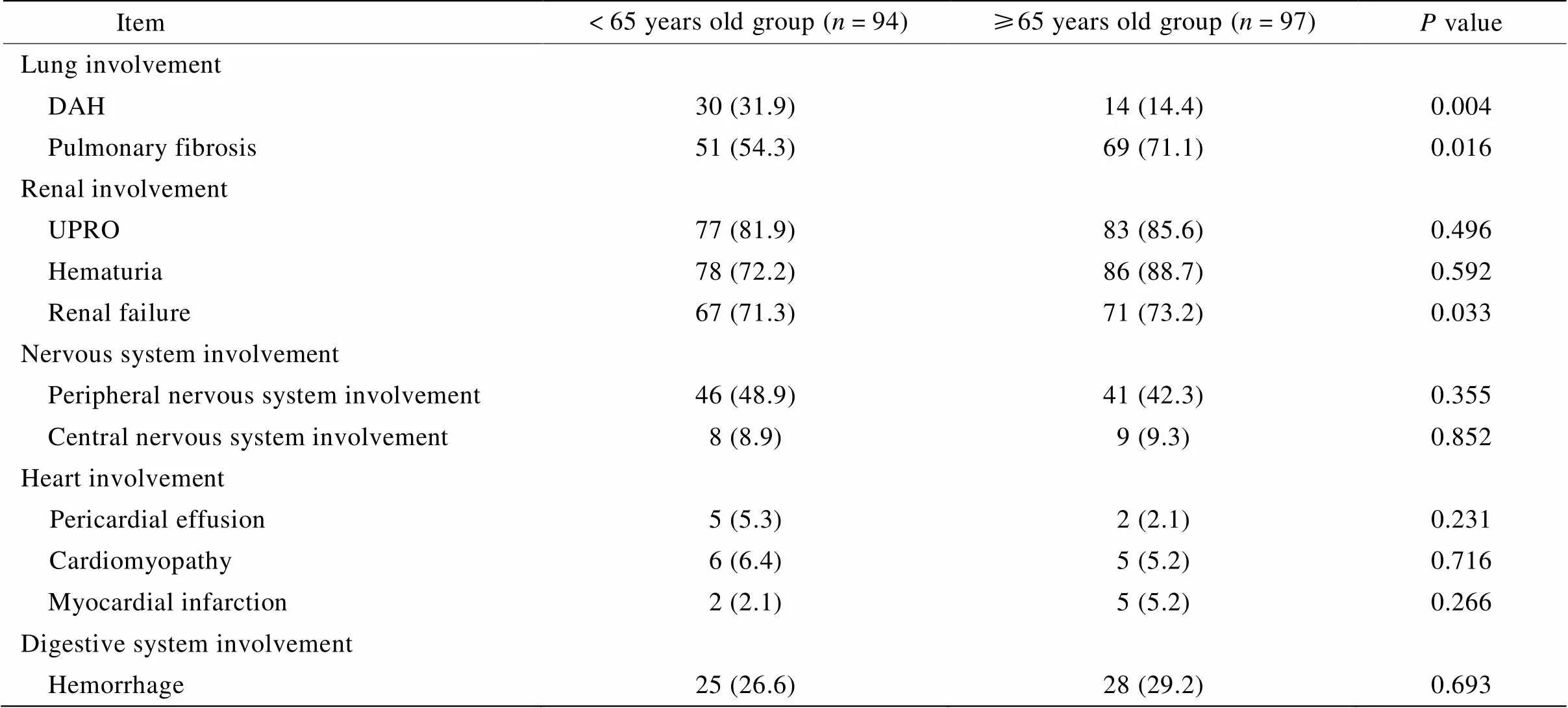
表2 两组患者重要脏器受累情况比较
DAH: diffuse alveolar hemorrhage; UPRO: urine protein
2.3 两组患者疾病活动程度评分比较
采用FFS和BVAS两种评估工具,对两组患者进行疾病活动程度评分。(1)FFS评分:年龄<65岁组为1.27±1.04,年龄≥65岁组为1.09±0.92,两组比较差异无统计学意义(=0.225)。(2)BVAS评分:年龄<65岁组为21.23±8.40,年龄≥65岁组为22.05±8.96,两组比较差异无统计学意义(=0.516)。结果显示两组患者的疾病活动程度差异无统计学意义。
2.4 远期预后预测因素分析
随访时间为(26.78±24.34)个月。在此期间,191例MPA患者死亡60例(31.4%),其中38例(63%)死于肺部感染。根据是否死亡,将患者分为死亡组和非死亡组。行Cox单因素分析,显示年龄(HR:1.04,=0.002)、白细胞(HR:0.65,=0.000)、CRP(HR:1.01,=0.006)、血肌酐(HR:1.00,=0.006)、尿素氮(HR:1.03,=0.002)、肺部感染(HR:5.57,=0.000)、DAH(HR:2.11,=0.007)和BAVS评分(HR:1.12,=0.000)与发生死亡相关。将上述危险因素纳入Cox多因素分析,结果提示只有年龄(HR:1.02,=0.003)、肺部感染(HR:3.79,=0.040)、DAH(HR:5.02,=0.004)和BAVS评分(HR:1.10,=0.000)是发生死亡的高危因素(表3)。

表3 MPA患者死亡预测因素的Cox分析结果
HR: hazard ratio; CI: confidence interval; BAVS: Birmingham vasculitis activity score; DAH: diffuse alveolar hemorrhage; WBC: white blood cell; CRP: C-reactive protein; SCr: serum creatinine; BUN: blood urea nitrogen
2.5 生存曲线
采用Kaplan-Meier法绘制生存曲线,发现年龄≥65岁组与年龄<65岁组之间的生存函数差异有统计学意义(Log-rank=10.462,=0.001,图1)。
3 讨 论
MPA以坏死性炎症、寡或无免疫复合物沉积、无肉芽肿形成为特点。其临床表现多样,病程长短不一,以肾脏受累最为多见,好发于中老年男性。与欧洲既往研究相比,韩国研究显示MPA患者男女比例相等,但平均发病年龄要大于欧洲人[6]。日本研究则显示MPA女性患者多于男性,且发病平均年龄较大,为67.7~69.4岁[10]。本研究及国内其他研究结果显示中国人MPA发病年龄约在65岁[11],推测亚洲人MPA的发病年龄较欧洲人大。除肾脏外,肺脏是MPA最常见的受累脏器之一。欧美研究显示25%~55%的MPA患者存在肺受累,常表现为肺泡出血、肺浸润、肺间充质纤维化[2]。日韩两国研究示肺受累占72.0%~73.7%[5,6]。我院病例资料显示DAH发生率为23%,肺间充质病变发生率为63%,与日韩资料相似,显著高于欧洲既往研究,提示亚洲MPA患者肺受累发生率高于欧洲。欧美与亚洲MPA患者发病年龄及肺受累的差异性可能与ANCA亚型及遗传因素有关[12,13]。Chen等[14]发现年龄较大的ANCA相关性血管炎患者p-ANCA阳性率显著高于年轻患者,肺受累(严重病变)也更为常见。这一研究发现从另一方面体现了年龄、脏器受累与ANCA三者之间的相关性。
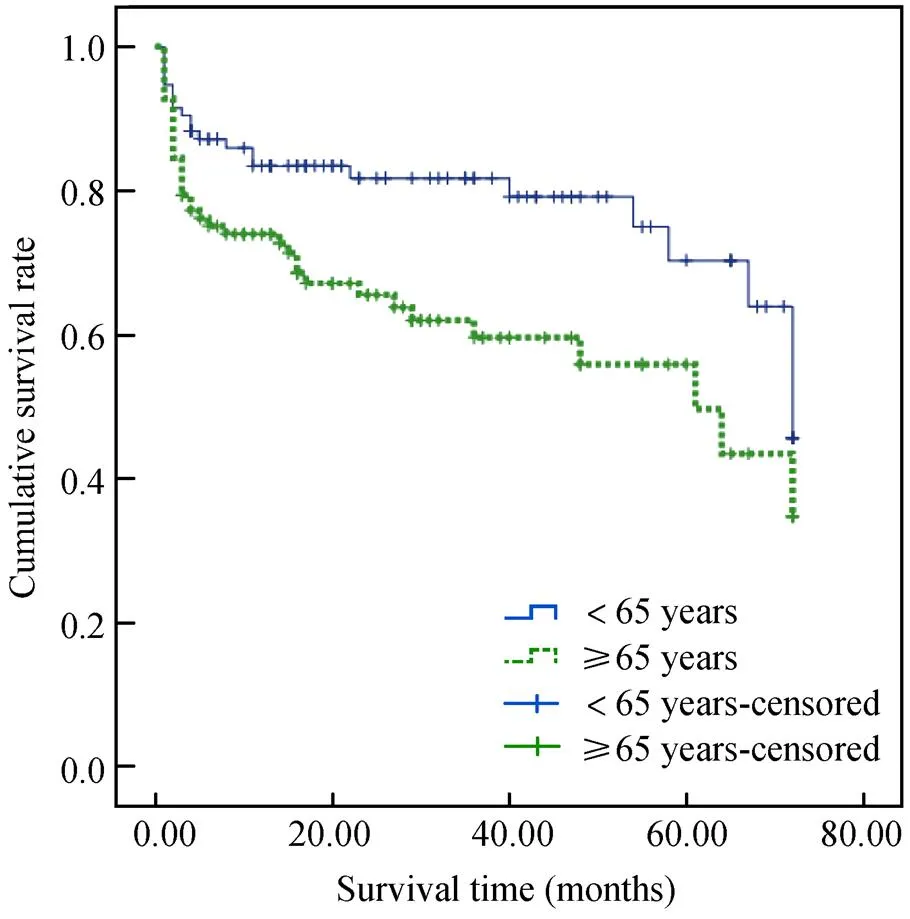
图1 两组患者的生存曲线
Figure 1 Survival curves of the two groups
国外研究报道MPA患者DAH的发生率为12%~39%[15]。我院调查示23%的患者出现DAH,且亚组分析结果显示年龄<65岁患者DAH的发生率明显高于年龄≥65岁患者,并且是造成MPA患者死亡的危险因素之一。这一结果在MPA临床研究中首次报道。
肺间充质疾病是MPA肺部受累的表现之一[16]。患者常见表现为干咳、呼吸困难,胸部高分辨CT示网格影、蜂窝肺、纤维索条影及结节影等。目前有两种假说解释ANCA相关性血管炎肺间充质纤维化的发生。(1)反复亚临床肺泡出血导致肺间充质纤维化的形成。ANCA相关性血管炎肺受累患者肺泡灌洗液中含铁血黄素巨噬细胞较结缔组织病相关肺间充质疾病常见。(2)髓过氧化物酶(myeloperoxidase,MPO)-ANCA对肺间充质纤维化的形成有直接作用。MPO在炎症因子的刺激下转移至中性粒细胞表面,与循环中的ANCA耦联,导致中性粒细胞脱颗粒,释放氧自由基,引起肺组织损伤,继而形成肺纤维化。本研究显示年龄≥65岁患者肺间充质病变发生率显著高于年龄<65岁患者,具体机制尚需进一步研究。
关于MPA患者的死亡率及死亡原因,现有的研究结果不尽相同。Schirmer等[17]的研究显示MPA死亡率约35%,>2/3死于血管炎病情活动。Guillevin等[18]报道MPA死亡率为32.9%,血管炎相关死亡与感染相关死亡分别占35.7%及28.6%。韩国的研究显示[19]MPA死亡率50%,DAH是主要原因(50%)。而日本的研究显示[20]血管炎死亡率为16.2%,60%死于感染。本研究示MPA死亡率31.4%,肺部感染是主要死因(63%)。因此MPA治疗过程中,一方面要运用糖皮质激素及免疫抑制剂控制原发病活动,另一方面要注意防止激素及免疫抑制剂引起的感染发生。
本研究显示MPA好发于老年人,且发病人群无性别差异。MPA患者肺部受累的主要表现为DAH及肺间充质病变。肺部感染和DAH是常见的导致MPA患者死亡的危险因素。高龄患者生存时间会明显缩短。
[1] Jennette JC. Overview of the 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides[J]. Clin Exp Nephrol, 2013, 17(5): 603−606.
[2] Chung SA, Seo P. Microscopic polyangiitis[J]. Rheum Dis Clin North Am, 2010, 36(3): 545−558.
[3] Ball GV. The history of ANCA-associated vasculitis[J]. Rheum Dis Clin North Am, 2010, 36(3): 439−446.
[4] Ntatsaki E, Watts RA, Scott DG. Epidemiology of ANCA-associated vasculitis[J]. Rheum Dis Clin North Am, 2010, 36(3): 447−461.
[5] Hasegawa M, Hattori K, Sugiyama S,. A retrospective study on the outcomes of MPO-ANCA-associated vasculitis in dialysis-dependent patients[J]. Mod Rheumatol, 2015, 27: 1−5.
[6] Oh JS, Lee CK, Kim YG,. Clinical features and outcomes of microscopic polyangiitis in Korea[J]. J Korean Med Sci, 2009, 24(2): 269−274.
[7] Xu PC, Chen M, Zhao MH. Antineutrophil cytoplasmic autoantibody-associated vasculitis in Chinese patients[J]. Clin Exp Nephrol, 2013, 17(5): 705−707.
[8] Guillevin L, Pagnoux C, Seror R,. The Five-Factor Score revisited: assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group (FVSG) cohort[J]. Medicine (Baltimore), 2011, 90(1): 19−27.
[9] Luqmani RA, Bacon PA, Moots RJ,. Birmingham Vasculitis Activity Score (BVAS) in systemic necrotizing vasculitis[J]. QJM, 1994, 87(11): 671−678.
[10] Sugiyama K, Sada KE, Kurosawa M,. Current status of the treatment of microscopic polyangiitis and granulomatosis with polyangiitis in Japan[J]. Clin Exp Nephrol, 2013, 17(1): 51−58.
[11] Li ZY, Chang DY, Zhao MH,. Predictors of treatment resistance and relapse in antineutrophil cytoplasmic antibody-associated vasculitis: a study of 439 cases in a single Chinese center[J]. Arthritis Rheumatol, 2014, 66(7): 1920−1926.
[12] Hauer HA, Bajema IM, van Houwelingen HC,. Renal histology in ANCA-associated vasculitis: differences between diagnostic and serologic subgroups[J]. Kidney Int, 2002, 61(1): 80−89.
[13] Zhang W, Zhou G, Shi Q,. Clinical analysis of nervous system involvement in ANCA-associated systemic vasculitides[J]. Clin Exp Rheumatol, 2009, 27(1 Suppl 52): S65−S69.
[14] Chen M, Yu F, Zhang Y,. Antineutrophil cytoplasmic autoantibody-associated vasculitis in older patients[J]. Medicine (Baltimore), 2008, 87(4): 203−209.
[15] Sada KE, Yamamura M, Harigai M,. Classification and characteristics of Japanese patients with antineutrophil cytoplasmic antibody-associated vasculitis in a nationwide, prospective, inception cohort study[J]. Arthritis Res Ther, 2014, 16(2): R101.
[16] Fernandez Casares M, Gonzalez A, Fielli M,. Microscopic polyangiitis associated with pulmonary fibrosis[J]. Clin Rheumatol, 2015, 34(7): 1273−1277.
[17] Schirmer JH, Wright MN, Vonthein R,. Clinical presentation and long-term outcome of 144 patients with microscopic polyangiitis in a monocentric German cohort[J]. Rheumatology (Oxford), 2015, DOI: 10.1093/rheumatology/kev286.
[18] Guillevin L, Durand-Gasselin B, Cevallos R,. Microscopic polyangiitis: clinical and laboratory findings in eighty-five patients[J]. Arthritis Rheum, 1999, 42(3): 421−430.
[19] Pagnoux C, Hogan SL, Chin H,. Predictors of treatment resistance and relapse in antineutrophil cytoplasmic antibody-associated small-vessel vasculitis: comparison of two independent cohorts[J]. Arthritis Rheum, 2008, 58(9): 2908−2918.
[20] Akikusa B, Kondo Y, Irabu N,. Six cases of microscopic polyarteritis exhibiting acute interstitial pneumonia[J]. Pathol Int, 1995, 45(8): 580−588.
(编辑: 吕青远)
Clinical features and outcomes of microscopic polyangiitis in the elderly
JIN Xiao-Sheng1, WANG Wen-Yue1,3, CHENG Man-Man1, PENG Min1, ZHENG Wen-Jie2, YU Chang-Li1,3, SHI Ju-Hong1*
(1Department of Respiratory Diseases,2Department of Rheumatology and Immunology, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730, China;3Department of Respiratory Diseases, North China Universty of Science and Technology, Tangshan 063000, China)
To investigate the clinical features, outcome and influencing factors of microscopic polyangiitis (MPA) in the elderly patients.Clinical data of 191 MPA patients admitted in our department from January 2007 to December 2012 were collected in this study. They were divided into ≥65 years old group and <65 years old group. Their clinical data were analyzed for the effect of age on the prognosis and survival. Cox regression analysis was employed to study the factors affecting survival.Diffuse alveolar hemorrhage (DAH) was more common in <65 years old group (=0.004), while interstitial lung disease in ≥65 years old group (=0.016) was more common. The incidence of renal failure (=0.033) and the serum level of C-reactive protein (CRP;=0.017) were significantly higher in ≥65 years old group than in <65 years old group.Kaplan-Meier survival analysis indicated that there was significant difference in the survival function between the 2 groups (Log-rank=10.462,=0.001). Cox univariate analysis showed that age (HR: 1.04,=0.002), leukocytes (HR: 0.65,=0.000), CRP (HR: 1.01,=0.006), creatinine (HR: 1.00,=0.006), urea nitrogen (HR: 1.03,=0.002), pulmonary infection (HR: 5.57,=0.000), DAH (HR: 2.11,=0.007) and Birmingham Vasculitis Activity Score (BVAS; HR: 1.12,=0.000) were correlated with death. Cox multivariate analysis suggested that only age (HR: 1.02,=0.003), pulmonary infection (HR: 3.79,=0.040), DAH (HR: 5.02,=0.004) and BAVS score (HR: 1.10,=0.000) be high-risk factors for death.MPA is common in the elderly, with no difference between genders. But the patients with older age have shorter survival time.
microscopic polyangiitis; clinical feature; interstitial lung disease; prognosis; aged
(2011BAI11B17).
R593.2; R592
A
10.11915/j.issn.1671-5403.2015.12.205
2015−09−02;
2015−09−28
国家“十二五”科技支撑计划课题(2011BAI11B17)
王文月,为共同第一作者
施举红, E-mail: shijh@pumch.cn
