硫化氢供体对低氧大鼠肺动脉平滑肌细胞小窝蛋白的影响
2015-04-23王丽丽赵勤华宫素岗刘锦铭
袁 平,王丽丽,王 岚,赵勤华,姜 蓉,宫素岗,刘锦铭*
硫化氢供体对低氧大鼠肺动脉平滑肌细胞小窝蛋白的影响
袁 平1,王丽丽2,王 岚1,赵勤华1,姜 蓉1,宫素岗1,刘锦铭1*
(1同济大学附属上海市肺科医院肺循环科,上海 200433;2浙江省中西医结合医院检验科,杭州 310003)
探讨硫化氢供体硫氢化钠(NaHS)对低氧大鼠肺动脉平滑肌细胞小窝蛋白1(Cav-1)的影响。采用间断常压低氧法建立低氧大鼠模型。利用混合气体培养法制备大鼠低氧肺动脉平滑肌细胞模型。将32只SD大鼠随机分为4组(每组8只):常氧组、低氧组、常氧+NaHS组和低氧+NaHS组。免疫组织化学方法检测肺小动脉中膜厚度、肌化及增殖程度。采用荧光探针法检测活性氧(ROS)含量。蛋白免疫印迹法检测Cav-1的表达。低氧组大鼠右心室收缩压、右心室质量指数、肺小动脉中膜厚度、肌化及平滑肌增殖程度明显增加;低氧组大鼠肺动脉平滑肌细胞ROS产生增加及Cav-1表达降低;NaHS给予大鼠可改善肺动脉血流,缓解肺动脉中膜增厚,抑制肺动脉平滑肌细胞增殖,减少肺动脉平滑肌细胞ROS产生及增加Cav-1表达。NaHS可通过降低低氧大鼠肺动脉平滑肌细胞ROS产生,上调Cav-1表达,抑制肺动脉平滑肌细胞增殖,缓解肺动脉重构。
大鼠;低氧;肺动脉;肌细胞,平滑肌;硫氢化钠;小窝蛋白;增殖
低氧性肺动脉高压是临床许多心肺疾病发生发展过程中伴随或最终的重要病理生理过程。肺血管收缩和肺动脉压力升高是低氧性肺动脉高压的始动环节和主要病理过程,后期以肺血管重构为主要病理生理改变[1,2]。因此,寻找抑制或缓解肺动脉重构的新靶点或许能给低氧性肺动脉高压提供新的治疗方法。肺脏是机体气体交换及代谢的重要场所,气体信号分子对肺循环的影响具有非常重要的意义。硫化氢(hydrogen sulfide,H2S)是新近发现的一种新型气体信使分子,具有舒张血管、抑制平滑肌细胞增殖的作用[3]。既往研究提示低氧性肺动脉高压大鼠血浆H2S浓度显著下降[4]。随后同一课题组发现外源性H2S可缓解低氧性肺动脉高压大鼠的肺动脉高压[5]。但是H2S发挥保护作用具体机制仍然不是完全清楚。此外,我们新近研究结果表明低氧性肺动脉高压大鼠肺动脉平滑肌细胞小窝蛋白(caveolin-1,Cav-1)表达显著降低[6]。那么H2S是否通过调节Cav-1发挥缓解低氧性肺动脉重构作用尚不清楚。因此,本实验拟在体内和体外实验观察H2S的供体硫氢化钠(sodium hydrosulfide,NaHS)对慢性低氧性肺动脉高压大鼠肺动脉平滑肌细胞Cav-1的影响及对血管重构的作用。
1 材料与方法
1.1 材料
选用雄性Sprague-Dawley(SD)大鼠,体质量180~220g(上海斯莱克有限公司动物房)。DMEM高糖培养基(Sigma公司,批号:EE37812);胎牛血清(Gibco澳洲血清,批号:10099-141);EDTA(上海华美生物工程有限公司);5−溴−2¢−脱氧尿嘧啶细胞增殖ELISA(密理博中国有限公司,批号:NG1758228);增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体(浙江省联科生物科技有限公司,批号:SPO735);细胞内活性氧(reactive oxygen species,ROS)检测试剂盒(江苏省碧云天生物科技有限公司,批号:S0033);小鼠抗大鼠Cav-1单克隆抗体(美国CST公司,批号:31-073)。
1.2 动物模型建立
SD大鼠32只随机分为4组(=8):常氧组、低氧组、常氧+NaHS组、低氧+NaHS组。将低氧组和低氧+NaHS组大鼠置于常压低压氧舱内(含10%氧气,90%氮气)每天持续6h,共4周。对常氧+NaHS组及低氧+NaHS组大鼠常氧或低氧处理3周后,每天常氧或低氧前NaHS[50μmol/(kg·d)]腹腔注射从第4周开始,共7d;常氧组及低氧组注射生理盐水。4组大鼠生活条件和饲料条件均相同自由摄食和饮水,光照为亮/暗12h交替,温度、湿度和通风符合该动物房动物管理条例。
1.3 原代培养肺动脉平滑肌细胞及细胞模型制备
采用酶消化法培养原代肺动脉平滑肌细胞。取150~180g SD健康雄性大鼠,开胸取肺,镜下剥离肺动脉,去掉血管周围组织及血管外膜及内膜,将肺动脉置于酶消化液中,37℃消化20min,离心弃上清,细胞培养液重悬吹打,接种于培养皿中,24h后换液。取3~8代细胞进行实验,将肺动脉平滑肌细胞分为4组(=12):常氧组,低氧组(5%O2,5%CO2),常氧+NaHS组,低氧+NaHS组(30μmol/L)培养48h后用于后续实验。
1.4 大鼠右心室收缩压测定及右心室质量指数检测
动物实验结束后,用6%的水合氯醛(1.2ml/100g)麻醉大鼠,采用右心导管法检测右心室收缩压(right ventricular systolic pressure,RVSP)[7]。测定完后,取出大鼠心脏,剪掉心房,分离右心室和左心室+室间隔,滤纸吸干称其湿重,计算右心室质量指数(right ventricular mass index,RVMI)[7]。
1.5 肺血管形态学改变
左肺叶经10%甲醛(中性福尔马林)溶液固定后,将标本严格于垂直位石蜡包埋,垂直于支气管细支气管断面,矢状位取材,沿肺门横断取材,连续切片,切片厚度5μm。切片用苏木素−伊红染色和免疫组织化学染色(α-SM-actin)。血管中膜厚度计算公式:中膜厚度(%)=血管壁厚度/血管外膜直径×100,每张切片观察30根血管外径约50~100μm的血管。显微镜400倍镜下观察100根血管外径约为10~50μm的小肺动脉,观察血管肌化程度[8]。
1.6 肺动脉平滑肌细胞增殖检测
采用PCNA检测试剂盒检测肺动脉平滑肌细胞增殖程度。肺动脉中PCNA表达的阳性信号为细胞浆呈棕黄色染色。每只大鼠选择血管外径为20~100μm的血管各30条。光学显微镜下检测。
1.7 细胞内活性氧含量测定
采用ROS检测试剂盒测定平滑肌细胞内ROS的含量。各组细胞预先培养在96孔板中48h,然后按照试剂盒说明书严格进行ROS检测。
1.8 Western印迹法检测细胞蛋白表达
取等量已变性处理的细胞蛋白,采用12%SDS聚丙烯酰胺凝胶垂直电泳进行分离,然后转至PVDF膜上(280mA,90min),用含5%脱脂奶粉的封闭液室温摇动封闭2h,加入Cav-1蛋白一抗(1∶1000),4℃过夜,室温下洗膜3次后加入辣根过氧化物酶耦联的二抗(1∶2000),室温孵育1h,洗膜3次,加化学发光物于膜上,反应3min显影。经凝胶成像系统分析处理数据,计算灰度值。
1.9 统计学处理
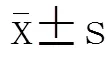
2 结 果
2.1 NaHS对大鼠RVSP、RVMI及肺动脉形态学指标的影响
与常氧组相比,低氧组大鼠RVSP显著升高,RVMI明显增加,光镜下该组大鼠肺小动脉管壁明显增厚,血管肌化程度显著增加,差异有统计学意义(均<0.01);NaHS治疗可逆转这些现象,即低氧+NaHS组大鼠RVSP和RVMI较低氧组显著降低,肺小动脉管壁明显变薄,肌化程度显著降低(均<0.01);常氧+NaHS组大鼠这些指标与常氧组大鼠类似,差异并无统计学意义(>0.05);与常氧+NaHS组相比,低氧+NaHS组大鼠RVSP、RVMI、血管中膜厚度及肌化程度均显著增加(均<0.05;表1,图1)。
2.2 NaHS对大鼠肺动脉平滑肌增殖的影响
图2结果表明,常氧组和低氧组大鼠肺动脉平滑肌细胞PCNA阳性率分别为(10.70±1.31)%和(24.85±2.57)%,两组比较差异具有统计学意义(<0.01);与低氧组大鼠相比,低氧+NaHS组大鼠平滑肌细胞增殖[(16.35±1.98)%]明显降低,差异具有统计学意义(<0.05);常氧+NaHS组大鼠平滑肌细胞增殖(12.90±1.35)%与常氧组大鼠类似,差异并无统计学意义(>0.05);与常氧+NaHS组大鼠相比,低氧+NaHS组大鼠平滑肌细胞增殖显著增加(<0.05)。
2.3 NaHS对肺动脉平滑肌细胞ROS含量的影响
与常氧组比较,低氧处理组大鼠肺动脉平滑肌细胞ROS的产生百分率显著增加[(99.65±6.58)%(177.74±7.45)%,<0.05];低氧+NaHS组(140.80±9.41)%与低氧组相比可明显抑制ROS的释放(<0.05);与常氧+NaHS组(108.28±8.16)%相比,低氧+NaHS组ROS释放增加,且差异具有统计学意义(<0.05;图3)。
2.4 NaHS对肺动脉平滑肌细胞Cav-1的影响
常氧组和低氧组肺动脉平滑肌细胞Cav-1蛋白表达相对量分别是(1.12±0.18)和(0.57±0.15),两组比较差异具有统计学意义(<0.05);低氧+NaHS组平滑肌细胞Cav-1蛋白表达(0.77±0.11)较低氧组显著增加(<0.05),但仍比常氧+NaHS组(1.08±0.20)Cav-1蛋白表达低(<0.05);类似于上述结果,常氧+NaHS组与常氧组肺动脉平滑肌细胞Cav-1蛋白表达差异并无统计学意义(>0.05;图4)。
3 讨 论
低氧性肺血管重构是低氧性肺动脉压力持续性升高的主要原因之一。血管重构主要由血管收缩物质和舒张物质失衡,导致血管内皮细胞和平滑肌细胞紊乱和增殖、凋亡抑制、炎症细胞浸润、细胞外基质聚集、血栓形成等引起的[9]。目前研究选择与肺动脉重构和右心室肥厚的相关指标来探讨NaHS对肺动脉平滑肌增殖的影响机制。前期已有文献报道在大鼠低氧性肺动脉高压时,机体内源性H2S体系下调,补充H2S对低氧诱导的肺动脉高压和肺动脉重构有明显的缓解作用[4,10]。我们的研究与这两项研究结果一致,进一步证实外源性补充H2S供体NaHS可改善低氧性肺动脉高压大鼠的RVSP, RVMI,肺动脉重构。我们采用更加客观的肺血管形态学指标即肺动脉中膜厚度和血管肌化程度来体现肺动脉重构的改变。
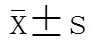
表1 4组大鼠血流动力学和肺动脉形态学指标的比较
RVSP: right ventricular systolic pressure; RVMI: right ventricular mass index. 1mmHg=0.133kPa. Compared with normoxia group,**<0.01; compared with hypoxia group,##<0.01; compared with normoxia+NaHS group,△<0.05

图1 4组大鼠肺动脉HE染色和α-SM-actin表达情况
Figure 1 HE staining and expression of α-SM-actin in pulmonary artery of four groups of rats A−D: HE staining; E−H: expression of α-SM-actin

图2 4组大鼠肺动脉PCNA阳性表达的比较
Figure 2 Comparison of PCNA positive expression in pulmonary artery between four groups of rats PCNA: proliferating cell nuclear antigen. Compared with normoxia group,*<0.05; compared with hypoxia group,#<0.05,##<0.01; compared with normoxia+NaHS group,△<0.05
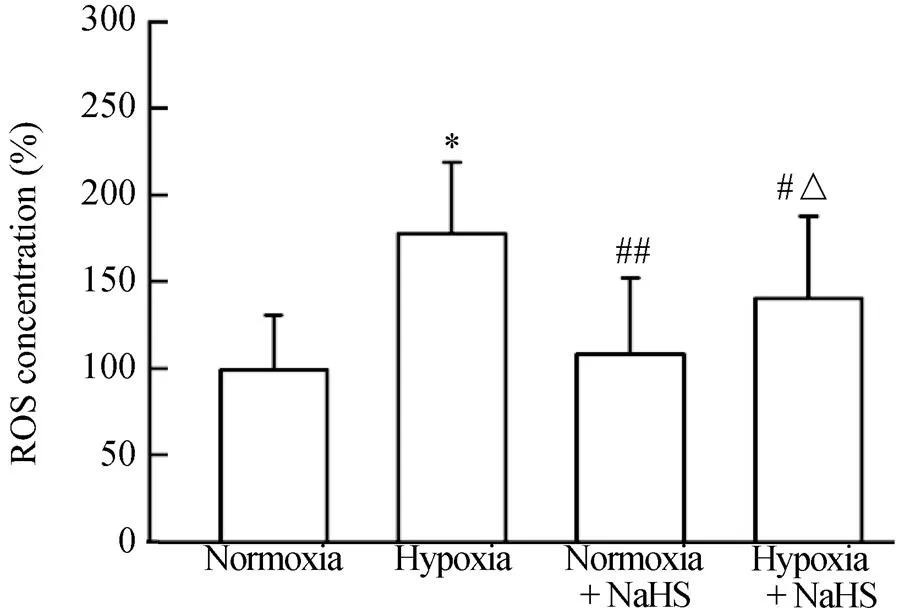
图3 4组大鼠肺动脉平滑肌细胞ROS产生的比较
Figure 3 Comparison of ROS production in pulmonary artery smooth muscle cells between four groups of rats Compared with normoxia group,*<0.05; compared with hypoxia group,#<0.05,##<0.01; compared with normoxia+NaHS group,△<0.05

图4 4组大鼠肺动脉平滑肌细胞Cav-1表达的比较
Figure 4 Comparison of Cav-1 expression in pulmonary artery smooth muscle cells between four groups of rats Cav-1: caveolin-1. Compared with normoxia group,*<0.05; compared with hypoxia group,#<0.05,##<0.01; compared with normoxia+NaHS group,△<0.05
低氧性肺动脉压力持续性升高的另一个主要原因是肺血管收缩[11,12]。近年来研究表明慢性低氧时过度生成的ROS与肺血管收缩和肺血管重构均有关联。ROS是肺血管系统内一种重要的信号传导分子。ROS过度生成可调节血管舒张因子的表达[13,14],刺激肺动脉平滑肌收缩,在慢性低氧性肺病的发生、发展中起重要作用。我们在实验中发现,给予NaHS可有效抑制低氧性肺动脉高压大鼠ROS生成,表明NaHS可能通过减少氧化应激反应缓解肺血管收缩和重构。
目前仅有一篇关于H2S与Cav-1的研究[15],该研究报道H2S并不影响大鼠阴茎海绵体内皮细胞的Cav-1表达。但是H2S对于其他疾病细胞的Cav-1表达尚不清楚。Cav-1、2、3是组成细胞质膜微囊的主要蛋白质成分,是其标志性蛋白。它们富含于多种类型的细胞内,如血管内皮细胞和平滑肌细胞。膜受体可与Cav-1结合对细胞内信号途径发挥重要调节作用,可抑制细胞增殖,调节细胞周期,调节细胞凋亡等生物学效应[16]。野百合碱(monocrotaline)可减少肺动脉内皮细胞表面Cav-1的表达,导致细胞增殖[17],但我们新近研究结果表明低氧性肺动脉高压大鼠肺动脉平滑肌细胞的Cav-1的表达显著降低[6]。为了明确Cav-1的表达是否受NaHS影响,我们用NaHS刺激正常氧浓度和低氧状态下平滑肌细胞Cav-1的表达,结果首次发现NaHS可上调平滑肌细胞Cav-1的表达的情况,但是不影响正常状态下平滑肌细胞膜Cav-1的表达,这提示NaHS可能通过影响Cav-1调节细胞内信号途径发挥抑制细胞增殖作用。
综上所述,本研究证实NaHS参与低氧性肺动脉高压肺血管重构可能是通过抑制氧化应激反应,调节肺动脉平滑肌细胞Cav-1的表达,减少细胞增殖实现的。Cav-1作为保护性因子参与低氧性肺动脉高压肺血管重构的病理生理学过程。NaHS作为H2S的随时供体,毕竟不同于H2S,因此接下来我们将进一步深入探讨H2S对Cav-1上游和下游信号通路的具体作用机制,这将对我们重新认识低氧性肺动脉高压发病机制、寻找一条新的预防和治疗途径具有重要意义。
[1] Pugliese SC, Poth JM, Fini MA,. The role of inflammation in hypoxic pulmonary hypertension: from cellular mechanisms to clinical phenotypes[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308(3): L229−L252.
[2] Pak O, Aldashev A, Welsh D,. The effects of hypoxia on the cells of the pulmonary vasculature[J]. Eur Respir J, 2007, 30(2): 364−372.
[3] Prieto-Lloret J, Shaifta Y, Ward JP,. Hypoxic pulmonary vasoconstriction in isolated rat pulmonary arteries is not inhibited by antagonists of H2S-synthesizing pathways[J]. J Physiol, 2015, 593(2): 385−401.
[4] Wei HL, Du JB, Tang CS,. Effect of hydrogen sulfide on oxidative stress in hypoxic pulmonary hypertension[J]. J Peking Univ (Health Sci), 2007, 39(6): 565−569. [魏红玲, 杜军保, 唐朝枢, 等. 硫化氢对低氧性肺动脉高压中氧化应激的调节作用[J]. 北京大学学报(医学版), 2007, 39(6): 565−569.]
[5] Wei HL, Zhang CY, Jin HF,. Hydrogen sulfide regulates lung tissue-oxidized glutathione and total antioxidant capacity in hypoxic pulmonary hypertensive rats[J]. Acta Pharmacol Sin, 2008, 29(6): 670−679.
[6] Wang LL, Shi L, Yuan P,. Effect of raloxifene on pulmonary artery remodeling in chronic hypoxic rats[J]. Modern Med J China, 2015, 32(6): 681−685. [王丽丽, 石 磊, 袁 平, 等. 雷洛昔芬对慢性低氧大鼠肺动脉血管重构的作用机理[J]. 中国现代应用医学, 2015, 32(6): 681−685.]
[7] Yuan P, Wu WH, Liu D,. Determination of pulmonary vascular resistance by improved right heart catheter in rats[J]. Chin J Cardiol, 2011, 39(10): 901−904. [袁 平, 吴文汇, 刘 岽, 等. 改良心导管测定大鼠肺血管阻力的方法[J]. 中华心血管病杂志, 2011, 39(10): 901−904.]
[8] Yuan P, Wu WH, Gao L,. Oestradiol ameliorates monocrotaline pulmonary hypertensionNO, PGI2and ET-1 pathway[J]. Eur Respir J, 2013, 41(5): 1116−1125.
[9] Crosswhite P, Sun Z. Molecular mechanisms of pulmonary arterial remodeling[J]. Mol Med, 2014, 20: 191−201.
[10] Chunyu Z, Junbao D, Dingfang B,. The regulatory effect of hydrogen sulfide on hypoxic pulmonary hypertension in rats[J]. Biochem Biophys Res Commun, 2003, 302(4): 810−816.
[11] Wan J, Jason Yuan XJ, Miao R,. Effects of gender on severity and pulmonary artery vascular reactivity in chronic hypoxic pulmonary hypertension in mice[J]. Natl Med J China, 2014, 94(22): 1692−1695. [万 钧, Jason X. J. Yuan, 缪 冉, 等. 性别对小鼠慢性低氧性肺动脉高压及肺动脉血管活性的影响[J]. 中华医学杂志, 2014, 94(22): 1692−1695.]
[12] Lahm T, Tuder RM, Petrache I. Progress in solving the sex hormone paradox in pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 307(1): L7−L26.
[13] Adesina SE, Kang BY, Bijli KM,. Targeting mitochondrial reactive oxygen species to modulate hypoxia-induced pulmonary hypertension[J]. Free Radic Biol Med, 2015, 87: 36−47.
[14] Wedgwood S, Lakshminrusimha S, Schumacker PT,. Cyclic stretch stimulates mitochondrial reactive oxygen species and Nox4 signaling in pulmonary artery smooth muscle cells[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(2): L196−L203.
[15] Meng J, Ganesan Adaikan P, Srilatha B. Hydrogen sulfide promotes nitric oxide production in corpus cavernosum by enhancing expression of endothelial nitric oxide synthase[J]. Int J Impot Res, 2013, 25(3): 86−90.
[16] Meyer MR, Haas E, Prossnitz ER,. Non-genomic regulation of vascular cell function and growth by estrogen[J]. Mol Cell Endocrinol, 2009, 308(1−2): 9−16.
[17] Huang J, Kaminski PM, Edwards JG,. Pyrrolidine dithiocarbamate restores endothelial cell membrane integrity and attenuates monocrotaline-induced pulmonary artery hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(6): L1250−L1259.
(编辑: 周宇红)
Effect of hydrogen sulfide donor on caveolin-1 expression in pulmonary artery smooth muscle cells from hypoxic rats
YUAN Ping1, WANG Li-Li2, WANG Lan1, ZHAO Qin-Hua1, JIANG Rong1, GONG Su-Gang1, LIU Jin-Ming1*
(1Department of Pulmonary Circulation, Shanghai Pulmonary Hospital, Tongji University, Shanghai 200433, China;2Clinical Laboratory, Zhejiang Provincial Hospital of Integrated Traditional Chinese and Western Medicine, Hangzhou 310003, China)
To determine the effect of hydrogen sulfide donor, sodium hydrosulfide (NaHS), on caveolin-1 (Cav-1) expression in pulmonary artery smooth muscle cells from hypoxic rats.The chronic hypoxic rat model was established by intermittent normobaric hypoxia exposure. The hypoxic rat pulmonary artery smooth muscle cells (PASMCs) were cultured under mixed gas conditions. Thirty-two Sprague-Dawley (SD) rats were randomly and equally divided into four groups (normoxia group, hypoxia group, normoxia+NaHS group and hypoxia+NaHS group). The pulmonary arteriole intima-media thickness, muscularization and PASMCs proliferation was measured by immunohistochemical assay. Reactive oxygen species (ROS) was assessed by fluorescent probe assays. Western blotting was used to detect the protein expression of Cav-1.Compared with control rats, right ventricular systolic pressure (RVSP), right ventricular mass index (RVMI), medial wall thickness, fully muscularized vessels and proliferation of PASMCs were significantly enhanced in response to hypoxia. The level of ROS was significantly higher and the expression of Cav-1 was decreased in the PASMCs of hypoxia group than in control groups. NaHS treatment resulted in improvement of pulmonary arterial blood flow, alleviation of medial wall thickness, inhibition of PASMCs proliferation, decrease of ROS production, and enhancement of Cav-1 protein expression.NaHS treatment alleviates pulmonary vascular structural remodeling in chronic hypoxic rats by decreasing ROS production, up-regulating the expression of Cav-1, and inhibiting PASMCs proliferation.
rats; hypoxia; pulmonary artery; myocytes, smooth muscle; sodium hydrosulfide; caveolin-1; proliferation
(15ZR1434400) and(20144Y0196).
R33l
A
10.11915/j.issn.1671-5403.2015.12.212
2015−09−01;
2015−09−30
上海市自然科学基金(15ZR1434400);上海市卫生和计划生育委员会科研课题(20144Y0196)
王丽丽,为共同第一作者
刘锦铭,E-mail: jinmingliu2007@163.com
