老年慢性淋巴细胞白血病患者12例的临床分析
2015-04-21李宝玲李素霞朱宏丽王统民汪海涛
李宝玲,李素霞,朱宏丽*,王统民,汪海涛,翟 冰,范 辉,郭 搏
老年慢性淋巴细胞白血病患者12例的临床分析
李宝玲1,李素霞1,朱宏丽1*,王统民2,汪海涛3,翟 冰1,范 辉1,郭 搏1
(1解放军总医院南楼血液科,北京 100853;解放军总医院第一附属医院:2烧伤整形科,3血液科,北京 100048)
探讨老年慢性淋巴细胞白血病(CLL)的临床特点。对解放军总医院1999年6月至2013年6月收治的12例>60岁的CLL患者的临床资料进行回顾性分析。12例患者中初诊时中位年龄75.5岁。所有患者均有合并症,其中以高血压最常见,有的(3/12)甚至合并第二肿瘤。共9例患者接受了个体化的治疗方案,5例进展(PD,例1、2、3、10、12总生存期分别为107个月、64个月、174个月、69个月、4个月),2例完全缓解(CR),1例部分缓解(PR),1例稳定(SD)。4例死于CLL进展,1例死于感染,3例死于第二肿瘤。老年CLL临床症状不典型,合并基础疾病多,因个体差异大,应根据患者不同情况采取个体化治疗。
白血病,淋巴细胞,慢性,B−细胞;老年人;专题综合分析
慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)是一种形态近似成熟的恶性淋巴细胞增殖性疾病,主要特征是淋巴细胞在骨髓、外周血中异常增高。CLL在欧美发病率较高,约占全部白血病的25%,占慢性白血病的50%左右。CLL主要发生于老年人群,中位年龄为72岁,男性发病率高于女性,男女比例为1.5∶1~2∶1。本研究回顾性地分析了解放军总医院1999年6月至2013年6月收治的>60岁的CLL患者的临床资料,以提高对该群患者临床特点的认识。
1 对象与方法
1.1 对象
解放军总医院血液科1999年6月到2013年6月住院治疗的>60岁的12例CLL患者为研究对象。诊断均符合张之南等主编的《血液病诊断及疗效标准》第3版[1]。疾病分期参照慢性淋巴细胞白血病Binet及Rai分期标准。
1.2 方法
回顾性地分析12例CLL患者的一般情况、临床特征和实验室辅助检查资料,包括以下内容。
1.2.1 一般情况 性别、中位发病年龄、男女比例及合并症。
1.2.2 临床特征 症状(如贫血及感染等表现)、体征(淋巴结肿大、肝脾肿大等)。
1.2.3 实验室资料 白细胞计数、血红蛋白测定、血小板计数、血清乳酸脱氢酶(lactate dehydrogenase,LDH)水平及血清β2微球蛋白(β2-microglobulin,β2-MG)含量。免疫表型:按照本院流式细胞室常规检测,采用活细胞间接荧光标记法,对T淋巴细胞系、B淋巴细胞系、髓系、干/祖细胞系抗原进行免疫标记,应用4色流式细胞仪(美国Becton Dickinson公司,FACSCalibur机型)进行检测。常规骨髓细胞染色体核型分析:取患者骨髓3~5ml,肝素抗凝,计数后按(1~2)×106/ml进行直接法制备染色体标本,采用R显带技术进行核型分析,染色体核型参照《国际人类细胞遗传学命名体系(ISCN1995)》进行描述。荧光原位杂交(fluorescence in situ hybridization,FISH)检测:检测探针组合为针对13q14缺失的探针(RB1、D13S25),针对17p13缺失的探针(p53),针对11q22-23缺失的探针(ATM),针对12号染色体着丝粒的探针(CSP12)(均北京金菩嘉生物有限公司)。
1.2.4 治疗指征 不具有进展特点的Binet A期、B期患者无需治疗,定期复查;进入活动期(如大多数Binet B期和C期患者)后,开始化疗。所有病例随访至2014年11月31日,评价化疗疗效。
1.2.5 疗效评价 参照《血液病诊断及疗效标准》第3版[1]。评判治疗效果,分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、进展(progressive disease,PD)、稳定(stable disease,SD)。
1.3 统计学处理
采用SPSS13.0统计学软件进行分析。计数资料以百分率表示。
2 结 果
2.1 一般情况
12例CLL患者中男性11例,女性1例。初诊时年龄(76.2±8.7)岁,中位年龄75.5(63~91)岁。所有患者均至少合并1个其他系统基础疾病,其中以高血压最常见,有的甚至合并第二肿瘤(表1)。

表1 12例老年CLL患者的伴发疾病
CLL: chronic lymphocytic leukemia; BPH: benign prostatic hyperplasia
2.2 临床特征
起病时伴有发热症状1例(8.3%),贫血1例(8.3%),乏力3例(25.0%),盗汗、体质量减轻2例(16.7%),发现白细胞升高10例(83.4%),淋巴结肿大7例(58.3%),脾肿大4例(33.3%;表2)。
2.3 实验室检查
患者发病时外周血血常规检查显示,白细胞中位数31.9(6.42~129.66)×109/L,其中淋巴细胞中位数26.33(2.89~124.47)×109/L,百分比为45%~96%,血红蛋白中位数123(106~140)g/L,其中1例患者有轻度贫血,血小板中位数153(95~283)×109/L。LDH>245U/L者2例(16.7%),β2-MG>2 610ng/L者6例(50.0%;表2)。对12例患者均进行了染色体核型分析,其中3例患者进行了FISH检测(表3)。
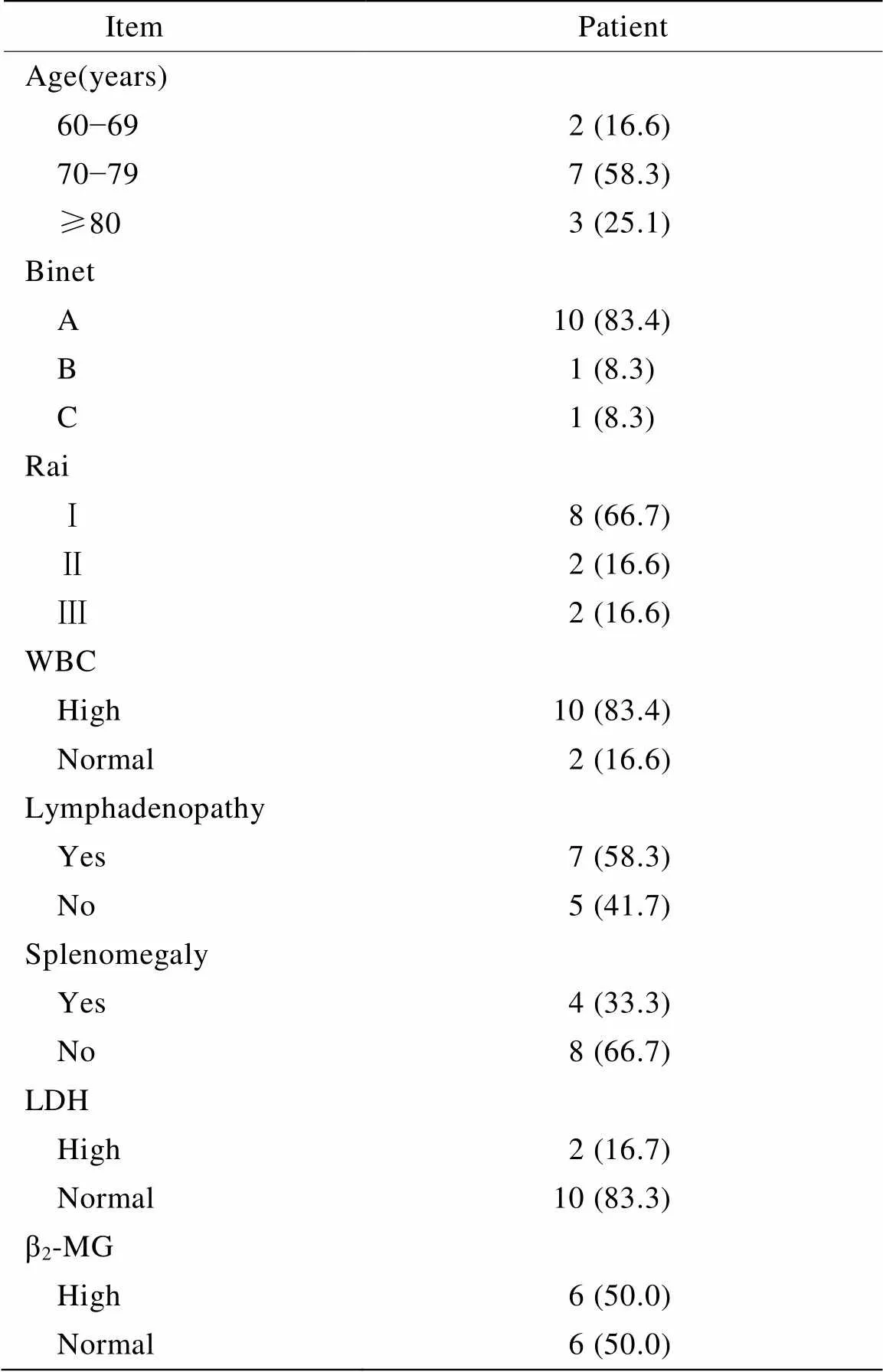
表2 12例老年CLL患者的临床特征
CLL: chronic lymphocytic leukemia; WBC: white blood cell; LDH: lactate dehydrogenase; β2-MG: β2-microglobulin
2.4 治疗方案
2.4.1 支持治疗 血红蛋白<90g/L时给予红细胞输注,血小板<20×109/L时给予输注机采血小板,中性粒细胞<0.5×109/L时给予粒细胞集落刺激因子至中性粒细胞绝对值恢复至0.5×109/L。对于合并心血管系统、神经系统疾病者,给予保护心肌、营养神经等对症支持治疗。
2.4.2 个体化治疗 例6、8、11患者定期复查,目前为疾病稳定状态,未给予任何化疗。
例1先后给予3次FR[氟达拉滨(fludarabine),第1、3、5、7、9日,50mg/d;利妥昔单抗(美罗华,rituximab),第7、14、21、28、44日,600mg/d];克拉屈滨(cladribine),第1、3、5、7、9日,5mg/d,2次氟达拉滨(第1、3、5日,50mg/d)+地塞米松(dexamethasone,第1日,10mg)+苯丁酸氮芥(chlorambucil,第1~7日,第15~21日,6mg/d),2次COP[环磷酰胺(cyclophosphamide)第1日,0.6g,长春地辛(vindesine),第1日,2mg,泼尼松,第1~5日,10mg/d],4次克拉屈滨(第2日,5mg)+盐酸多柔比星脂质体(Doxil,第1、3、4日,20mg/d)方案化疗。
例2、3均先给予苯丁酸氮芥,2次FR,自体细胞因子诱导杀伤细胞(cytokine-induced killer,CIK),地塞米松(第1~7日,5mg/d)+盐酸多柔比星脂质体(第2日,20mg)方案。
例4、7均采用了CIK联合利妥昔单抗方案治疗。例4先给予了改良的FRP[氟达拉滨(第1~3日,30mg/d,第4~29日,10mg/d)+泼尼松(prednisone,第1~3日,20mg/d,第4~29日,10mg/d)+利妥昔单抗,第1日,600mg)]方案化疗。例5、9、12均给予了FC方案(氟达拉滨第1~5日,45mg/d;环磷酰胺第1~5日,400mg/d)化疗,例5在FC效果欠佳情况下给予CVP(环磷酰胺第1~2日,600mg/d;长春地辛第1~2日,2mg/d,泼尼松25mg,3次/d);例9先给予了VP(长春地辛,第1日,4mg;泼尼松25mg,3次/d),效果不佳后给予FC,FR方案化疗。
例10先后给予苯丁酸氮芥,R-COP[利妥昔单抗(第1日,600mg),环磷酰胺(第2日,1000mg),长春地辛(第2日,4mg),泼尼松(第1~5日,100mg/d)],3次R-FD[利妥昔单抗(第1日,600mg),氟达拉滨(第2~4日,40mg/d),地塞米松(第2~4日,15mg/d)]方案化疗。
2.5 治疗效果及预后
9例接受治疗的患者中,5例PD(例1、2、3、10、12总生存期分别为107、64、174、69个月、4个月),2例CR,1例PR,1例SD。例2、3、10、12死于CLL进展,其中例3 CLL转化为弥漫大B细胞淋巴瘤(Richter征),例1死于感染,例4、7死于肺癌,例5死于胃癌。
3 讨 论
CLL是一种低度恶性的小淋巴细胞白血病,在欧美等西方国家发病率为3/10 000,并随着年龄的增长逐渐增加,在>70岁的老年人群中的发病率为50/10 000[2]。
虽然CLL通常处于一种惰性状态,从观察等待到多次化疗导致慢性免疫抑制和感染性并发症的出现,表明疾病过程是高度可变的[3]。在CLL患者中,1/3从未接受过治疗并长期生存,1/3初始无需治疗之后疾病进展,最后1/3发病时就具有侵袭性需要立即治疗[4]。本组12例CLL患者中3例疾病稳定,长期未接受治疗,目前分别存活18个月、36个月和72个月;1例早期给予个体化治疗后,目前病情稳定;5例在病情进展后给予多次化疗,出现严重的骨髓抑制和感染,最终导致死亡。合并第二肿瘤的3例CLL患者给予个体化治疗后,达到完全缓解,最终因第二肿瘤进展死亡。

表3 12例老年CLL患者的免疫表型和细胞遗传学特点
CLL: chronic lymphocytic leukemia
老年CLL的治疗目前尚无统一的治疗方案。嘌呤类似物氟达拉滨,单用或联合其他药物,已成为标准治疗方案。Steurer等[5]对1 838例患者随机应用以烷化剂(alkylating agent)或嘌呤类似物(purine analogue)为基础的化疗,结果发现嘌呤类似物组有更高的总反应、完全反应率和无进展生存期,但总生存期两组差异无统计学意义。Catovsky等[6]对777例CLL患者的一项研究发现,氟达拉滨联合环磷酰胺与单用氟达拉滨、苯丁酸氮芥相比,有更高的完全缓解率(38%∶15%∶7%)、总有效率(94%∶80%∶72%)和5年无进展生存期(36%∶10%∶10%),但三者之间的总生存率差异无统计学意义。最终证实,在各年龄组(包括>70岁的患者),氟达拉滨联合环磷酰胺是最好的选择。随着对染色体异常预后意义的研究发现,氟达拉滨用于17p-(或p53突变)者效果差[7]。在2014年,一些新的药物批准用于治疗高风险的遗传因素(17p-)和复发/难治的CLL,分子靶向药物依鲁替尼(ibrutinib)和新型磷脂酰肌醇−3激酶δ抑制剂艾地利西(idelalisib)均是口服激酶抑制剂阻断中央通路的关键调节药[8]。本研究发现,老年CLL患者往往一般情况差,合并多种基础疾病,对化疗耐受性差,应根据患者具体情况给予个体化的治疗。
CLL患者主要的死亡原因包括疾病进展、感染、第二肿瘤[9]。本组12例CLL患者初诊时均合并多种基础病,其中以高血压最多见,2例(例4、7)在诊断时合并肺癌,针对肺癌,例4一直未予治疗,例7先后给予吉非替尼(gefitinib)、厄洛替尼(erlotinib)、索拉非尼(sorafenib)靶向治疗,并在治疗期间确诊CLL,1例(例5)在CLL治疗同时并发进展性胃癌Ⅳ期,针对胃癌,未做任何治疗,最终3例CLL患者均因第二肿瘤死亡。美国得克萨斯大学安德森癌症中心[10]对1985至2005年诊断为CLL的2 028例患者,研究发现324例(16%)有其他癌症病史和227例(11.2%)在随访期间并发第二肿瘤。其中皮肤癌30%,前列腺癌13%,乳腺癌9%,胃肠道肿瘤9%,黑色素瘤8%,淋巴瘤8%,肺癌6%,以及其他癌症17%。第二肿瘤的风险比预期高2.2倍。在有其他癌症病史和无其他癌症病史的患者中,5年存活率分别为70%和82%(<0.001)。在加拿大的一项研究[11]发现,治疗后的CLL患者与未经治疗的CLL患者相比,发生第二肿瘤的风险增加1.7倍,其中最常见的第二肿瘤是非黑色素瘤性皮肤癌(non-melanoma skin carcinoma,NMSCs;37%),其次为消化系统肿瘤(16%),前列腺癌(12%),乳腺癌(10%)和肺癌(9%)。危险因素包括年龄(>60岁),男性,β2-MG(>3mg/L),LDH(>618U/L),血清肌酐(>1.6mg/dl)[10]。标准的化疗方案包括嘌呤类似物(如氟达拉滨)和烷化剂(如环磷酰胺)可诱导完全的和潜在的长期缓解,但会出现长期的免疫防御和免疫监视系统受损[12]。经过治疗后的CLL患者免疫系统受损,这或许可以部分解释第二肿瘤发病率升高的原因[13]。CLL固有的恶性转化倾向,再加上化疗,使第二肿瘤的风险显著升高[14]。
综上所述,老年CLL患者一般情况差,合并多种基础疾病,对化疗的耐受性差,治疗上应根据患者具体情况进行个体化治疗,感染是病程中常见的并发症和主要死亡原因。对于合并第二肿瘤的老年CLL患者,在治疗CLL的同时,应积极评估第二肿瘤的状态,尽可能地减少第二肿瘤引起的死亡。
[1] Zhang ZN, Shen T. Diagnostic and Curative Standard of Hematology[M]. 3rd ed. Beijing: Beijing Science and Technology Publishing House, 2007: 139−146. [张之南, 沈 悌. 血液病诊断及疗效标准[M]. 第3版. 北京: 北京科学技术出版社, 2007: 139−146.]
[2] Wendtner CM, Schmitt B, Bergmann M,. New aspects on the pathogenesis, diagnostic procedures, and therapeutic management of chronic lymphocytic leukemia[J]. Int J Hematol, 2001, 73(1): 32−38.
[3] Moran M, Browning M, Buckby E. Nursing guidelines for managing infections in patients with chronic lymphocytic leukemia[J]. Clin J Oncol Nurs, 2007, 11(6): 914−924.
[4] Dighiero G. Unsolved issues in CLL biology and management[J]. Leukemia, 2003, 17(12): 2385−2391.
[5] Steurer M, Pall G, Richards S,. Single-agent purine analogues for the treatment of chronic lymphocytic leukaemia: a systematic review and meta-analysis[J]. Cancer Treat Rev, 2006, 32(5): 377−389.
[6] Catovsky D, Richards S, Matutes E,. Assessment of fludarabine plus cyclophosphamide for patients with chronic lymphocytic leukaemia (the LRF CLL4 Trial): a randomised controlled trial[J]. Lancet, 2007, 370(9583): 230−239.
[7] Stilgenbauer S, Döhner H. Molecular genetics and its clinical relevance[J]. Hematol Oncol Clin North Am, 2004, 18(4): 827−848, ⅷ.
[8] Tausch E, Stilgenbauer S. Chronic lymphocytic leukemia: current standards and novel approaches[J]. Internist (Berl), 2014, 55(12): 1400, 1402−1404, 1406−1409.
[9] Yoon JY, Lafarge S, Dawe D,. Association of interleukin-6 and interleukin-8 with poor prognosis in elderly patients with chronic lymphocytic leukemia[J]. Leuk Lymphoma, 2012, 53(9): 1735−1742.
[10] Tsimberidou AM, Wen S, McLaughlin P,. Other malignancies in chronic lymphocytic leukemia/small lymphocytic lymphoma[J]. J Clin Oncol, 2009, 27(6): 904−910.
[11] Beiggi S, Johnston JB, Seftel MD,. Increased risk of second malignancies in chronic lymphocytic leukaemia patients as compared with follicular lymphoma patients: a Canadian population-based study[J]. Br J Cancer, 2013, 109(5): 1287−1290.
[12] Wadhwa PD, Morrison VA. Infectious complications of chronic lymphocytic leukemia[J]. Semin Oncol, 2006, 33(2): 240−249.
[13] Molica S. Second neoplasms in chronic lymphocytic leukemia: incidence and pathogenesis with emphasis on the role of different therapies[J]. Leuk Lymphoma, 2005, 46(1): 49−54.
[14] Streu E. Second malignancies in chronic lymphocytic leukemia[J]. Oncol Nurs Forum, 2014, 41(1): 95−98.
(编辑: 李菁竹)
Clinical analysis of elderly chronic lymphocytic leukemia: a report of 12 cases
LI Bao-Ling1, LI Su-Xia1, ZHU Hong-Li1*, WANG Tong-Min2, WANG Hai-Tao3, ZHAI Bing1, FAN Hui1, GUO Bo1
(1Department of Geriatric Hematology, Chinese PLA General Hospital, Beijing 100853, China;2Department of Burns and Plastic Surgery,3Department of Hematology, the First Affiliated Hospital, Chinese PLA General Hospital, Beijing 100048, China)
To investigate the clinical features of chronic lymphocytic leukemia (CLL) in the elderly.A total of 12 elderly patients (over 60 years old) with CLL admitted in our hospital from June 1999 to June 2013 were enrolled in this study and retrospectively analyzed.The mean age was 75.5 years in the cohort. All patients had suffered from underlying diseases, and hypertension was the most common one. And some of them (3/12) even complicated with the secondary tumor. Nine cases received individualized treatments. The results showed that 5 patients suffered progressive disease (PD, Sample 1, 2, 3, 10 and 12 had the total survival time of 107, 64, 174, 69 and 4 months, respectively), 2 patients achieved complete remission (CR), 1 patient achieved partial remission (PR), and 1 patient reported stable disease (SD). Four patients died of progressive CLL, 1 of infection, and the other 3 of the secondary tumor.Elderly CLL has atypical symptoms and many underlying diseases. Treatment should be individualized based on patient’s status.
leukemia, lymphocytic, chronic, B-cells; aged; comprehensive analysis for certain subjects
(13BJZ47)(2013FC-TSYS-1020).
R733.72; R592
A
10.11915/j.issn.1671-5403.2015.04.065
2014−12−22;
2015−02−04
军队保健专项科研课题(13BJZ47);解放军总医院临床科研扶持基金(2013FC-TSYS-1020)
李素霞,为共同第一作者
朱宏丽, E-mail: bjzhl202_cn@ sina.com
