NF-κB参与枸橼酸铁铵过载诱导的人肝细胞hepcidin基因表达
2015-04-17李士伟
李士伟, 李 想, 关 锋 △
(江南大学 1糖化学与生物技术教育部重点实验室, 2生物工程学院, 3无锡医学院,江苏 无锡 214122)
NF-κB参与枸橼酸铁铵过载诱导的人肝细胞hepcidin基因表达
李士伟1, 2, 李 想3, 关 锋1, 2 △
(江南大学1糖化学与生物技术教育部重点实验室,2生物工程学院,3无锡医学院,江苏 无锡 214122)
目的: 研究核因子κB(NF-κB)在枸橼酸铁铵过载诱导人肝细胞铁调素(hepcidin)基因表达中的调控作用。方法: 依据前期不同浓度枸橼酸铁铵抑制人肝细胞HH4增殖实验结果,选取0.1、1、5和10 mmol/L枸橼酸铁铵处理人肝细胞HH4 48 h,半定量PCR法检测胞内hepcidin的表达水平;利用染色质免疫共沉淀(ChIP)、电泳迁移率实验(EMSA)和双萤光素酶报告基因检测系统,并结合胞内NF-κB活性抑制实验,确定NF-κB对人hepcidin转录活性的影响。结果: 5 mmol/L和10 mmol/L浓度的枸橼酸铁铵处理细胞后,hepcidin表达水平显著增强;ChIP和EMSA实验证实NF-κB能够与hepcidin基因启动子结合;重组萤光素酶报告质粒TOPFlash-pHepcidin相对萤光素酶活性明显高于对照组;与重组质粒TOPFlash-pHepcidin相比,突变重组萤光素酶报告质粒TOPFlash-pHepcidin-mut相对萤光素酶活性显著降低;NF-κB抑制剂BAY 11-7082显著降低了hepcidin基因的表达。结论: NF-κB参与了铁过载诱导的人hepcidin基因表达。这为进一步深入研究肝细胞铁过载模式下多因子协同调控hepcidin基因表达的具体分子机理奠定了基础。
核因子κB; 染色质免疫共沉淀; 电泳迁移率实验; 双萤光素酶报告基因检测系统; 铁调素
铁调素(hepcidin)是一种肝脏分泌的在维持机体铁代谢平衡中起关键性调控作用的小分子多肽[1]。2001年,2个独立的实验室首先从人的血液和尿液中将hepcidin纯化出来[2]。Hepcidin蛋白与十二指肠、巨噬细胞和肝细胞细胞膜上的铁转运蛋白(ferroportin,FPN)结合,诱使FPN内化和泛素化降解,从而抑制肝脏和肠道对铁的吸收以及单核巨噬细胞系统对铁的释放,起到维持体内铁平衡作用[3-4]。研究表明机体铁状况、贫血、缺氧、细菌、致炎物质和细胞因子等均可影响hepcidin的表达水平[5-8]。
Hepcidin蛋白由hepcidin基因编码,该基因位于人的19号染色体的长臂上(19q13),全长为2.5 kb,含有3个外显子和2个内含子,mRNA长度为0.4 kb。Hepcidin基因的表达调控机制十分复杂,多种因素均可影响其表达水平。已经明确的是3个信号通路影响肝脏hepcidin基因的表达,BMP与Smad4途径、IL-6与STAT3途径和TfR2与HFE途径[9-10]。此外,hepcidin基因的上游调控区还存在多个潜在的转录因子结合位点,如USF2、STAT3、CCAAT/增强子、核因子κB(nuclear factor κB, NF-κB)、肝核因子42和p53等[11-12]。本实验室研究发现体外枸橼酸铁铵(ferric ammonium citrate,FAC)超载引起人肝细胞HH4胞内NF-κB和hepcidin基因表达水平的显著上调,提示NF-κB可能与铁过载激发hepcidin基因的过度表达有密切关系。因此,通过染色质免疫共沉淀(chromatin immunoprecipitation, ChIP)、电泳迁移率实验(electrophoretic mobility shift assay, EMSA)和双萤光素酶报告基因检测系统以及胞内NF-κB活性抑制实验以期确证NF-κB参与人肝细胞hepcidin转录调控的可能性,为进一步深入研究铁过载模式下hepcidin表达的多分子调控机制奠定了基础。
材 料 和 方 法
1 实验材料
非转化人肝细胞株HH4由美国西雅图Fred-Hutchinson Cancer Research Center的Joachim Deeg教授实验室惠赠。萤光素酶报告基因质粒M50 Super 8x TOPFlash、M51 Super 8x FOPFlash(TOPFlash mutant)、海肾萤光素酶对照报告基因质粒pRL-TK及大肠杆菌JM109由本室保存。
Williams’ Medium E、HEPES和丙酮酸钠(Gibco);胎牛血清和青霉素溶液(Life Technologies);地塞米松、庆大霉素和枸橼酸铁铵(Sigma);胰岛素-转铁蛋白-硒(insulin-transferrin-selenium, ITS)添加剂(BD);细胞RNA提取试剂盒和Nc-细胞核/浆蛋白抽提试剂盒(北京康为世纪生物科技有限公司);ReverTra Ace -α-逆转录试剂盒(TOYOBO);PfuDNA聚合酶、细胞基因组DNA提取试剂盒和Pro-Light HRP 化学发光检测试剂(天根生化科技有限公司);Protein A/G PLUS-Agarose(Santa Cruz);DIG Gel Shift Kit(Roche);KpnI和BglII内切酶、1 kb DNA Ladder marker、DL2000 DNA Ladder marker和琼脂糖凝胶DNA回收试剂盒(TaKaRa);双萤光素酶报告基因检测系统(Promega);96孔黑色细胞培养板(Corning);T-PER组织总蛋白抽提试剂(Thermo);NF-κB抑制剂BAY 11-7082、BCA蛋白检测试剂盒和辣根过氧化物酶标记山羊抗小鼠IgG 抗体(碧云天生物技术研究所);p-IκBα、NF-κB p65和p-NF-κB p65抗体(Cell Signalling);抗hepcidin-25抗体(Abcam)。引物由上海英潍捷基贸易有限公司合成。
2 细胞培养
HH4细胞在含10% 胎牛血清、0.1% ITS、0.04 mg/L地塞米松、50 mg/L庆大霉素、20 mmol/L 的HEPES和1 mmol/L 的丙酮酸钠的Williams培养基中培养;培养条件为37 ℃、5% CO2、95%相对湿度。
3 实验方法
3.1 半定量RT-PCR检测hepcidin表达水平 0.1、1、5和10 mmol/L枸橼酸铁铵分别处理HH4细胞48 h,提取HH4细胞总RNA并在逆转录酶的作用下合成cDNA。根据NCBI中的人hepcidin基因设计合适的半定量RT-PCR引物。上游引物序列为5’-CTGTTTTCCCACAACAGAC-3’,下游引物序列为5’-CCTTCCTTATTTATTCCTGC-3’,扩增片段全长230 bp。以cDNA为模板进行PCR扩增,PCR条件为:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃ 5 min。通过琼脂糖凝胶电泳分析PCR产物。
3.2 ChIP和EMSA实验 选取5 mmol/L FAC浓度处理HH4细胞48 h,加入终浓度1%的甲醛,37 ℃交联固定DNA与蛋白质10 min。收集细胞用SDS lysis buffer重悬,3 s工作7 s间歇超声波破碎细胞,重复150次。离心取上清,将获取的100 μL上清作为input组存于-80 ℃待用。另取100 μL上清加入NF-κB p65抗体,4 ℃颠转过夜处理。加入Protein A/G 4 ℃继续颠转4 h,离心收集沉淀(结合的DNA和蛋白质)。与input组同时用5 mol/L NaCl 65 ℃解交联4 h,DNA纯化试剂盒纯化后溶于30 μL洗脱液中。针对hepcidin基因上游启动子区设计特异性引物,扩增包含转录因子NF-κB假定识别序列的153 bp片段,以确定NF-κB和hepcidin的结合:正向引物5’-TGGGACTACAGATGTGTGC-3’;反向引物5’-GCCTGTAATCCCAGCAAT-3’。
选取5 mmol/L FAC浓度处理HH4细胞48 h,然后按试剂盒说明书提取核蛋白并用BCA法定量。将NF-κB识别的特异性互补寡核苷酸片段在TEN buffer中按摩尔比1∶ 1混匀,95 ℃变性10 min后,缓慢复性:正向序列为5’-TAGAGATGGGGTCTCCCTATGT-3’;反向序列为5’-ACATAGGGAGACCCCATCTCTA-3’。按DIG Gel Shift Kit说明书将双链DNA标记地高辛。取50 μg核蛋白与标记地高辛的双链DNA混合, 在25 ℃反应30 min。5%非变性聚丙烯酰胺凝胶电泳,电泳后的凝胶经电转至尼龙膜,254 nm紫外交联固定10 min。按照DIG Gel Shift Kit试剂盒免疫杂交信号检测操作程序进行检测。在超迁移分析实验中,取2 μg NF-κB p65抗体与核蛋白25 ℃反应20 min,然后加入标记地高辛的双链DNA。
3.3 双萤光素酶报告基因系统实验 根据NCBI中的人hepcidin基因5’上游启动子区序列设计合适的引物构建萤光素酶报告载体TOPFlash-pHepcidin。上游引物序列hepcidin-F为5’-GGGGTACCCCACCACGCCTGGCTAAA-3’,引入酶切位点KpnI,下游引物序列hepcidin-R为5’-GAAGATCTCGTGCCGTCTGTCTGGCT-3’,引入酶切位点BglII。提取HH4细胞基因组DNA,以其为模板PCR扩增hepcidin基因5’上游846 bp片段pHepcidin。PCR 扩增体系为5×Prime STAR 缓冲液10 μL,dNTP Mixture(各2.5 mmol/L)4 μL,上游引物(20 μmol/L)1 μL,下游引物(20 μmol/L) 1 μL,Prime STAR DNA 聚合酶0.3 μL,模板DNA 1 μL,灭菌蒸馏水32.7 μL。PCR反应条件为94 ℃ 4 min;94 ℃ 40 s,56 ℃ 45 s,72 ℃ 1 min,共32个循环;最后72 ℃ 8 min。PCR产物经琼脂糖凝胶DNA回收试剂盒回收纯化,然后用KpnI和BglII双酶切。酶切产物纯化后,与同样经KpnI和BglII双酶切处理的M50 Super 8x TOPFlash载体在16 ℃下用T4 DNA Ligase连接过夜,然后将连接产物转化到JM109感受态细胞中,在含有氨苄青霉素的LB固体平板上37 ℃过夜培养。挑取生长的单菌落提取质粒,经双酶切及测序鉴定,获得构建成功的TOPFlash-pHepcidin载体。
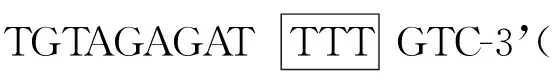
将处于对数生长期的HH4细胞以108/L接种至24孔板进行报告基因载体瞬时转染实验。细胞生长至约70 %融合时,利用LipofectamineTM2000试剂将0.8 μg的重组质粒TOPFlash-pHepcidin、0.8 μg的重组质粒TOPFlash-pHepcidin-mut或0.8 μg的阴性对照质粒FOPFlash和0.1 μg的内参质粒pRL-TK共转染HH4细胞,每个实验组设3个重复。转染6 h后更换含10% FBS的培养基。转染24 h之后,将细胞分为2组,其中一组更换5 mmol/L FAC培养基,另一组更换正常培养基。12 h后,使用双萤光素酶报告检测试剂盒裂解收集细胞。
双萤光素酶活性测定按照Promega 公司提供的Dual-luciferase reporter assay system操作说明进行。转染结束后,弃去培养液,用1×PBS液漂洗细胞2次。每孔加100 μL 1×PLB细胞裂解液,室温摇动孵育15 min裂解细胞。取50 μL细胞裂解液加入96孔黑色细胞培养板。使用多功能酶标仪进行双萤光素酶活性测定,自动进样器1 和2 分别充满LARII 和Stop&Glo®试剂。测量时,使用 2 s延迟和10 s萤光累积读数。各实验组启动子活性用相对萤光素酶值(relative luciferase activity,RLA)表示。
3.4 NF-κB活性抑制实验 HH4细胞以2×108/L传至6孔板,过夜培养后, 0.1 μmol/L NF-κB抑制剂BAY 11-7082处理5 h。收集细胞, 加入T-PER组织总蛋白抽提试剂在4 ℃裂解细胞30 min,离心取上清,使用BCA法测定蛋白浓度。样品加入5×蛋白上样缓冲液混合,煮沸5 min, 取20 μg蛋白上样进行SDS-PAGE;电泳后,将蛋白转移至0. 45 μm PVDF膜,用5 % 脱脂奶粉室温封闭2 h;随后加入 I 抗(1∶ 1 000),4 ℃孵育12 h,用1×TBST洗5次;加辣根过氧化物酶标记的 II抗(1∶5 000), 室温作用1 h, 用1×TBST洗5次, 然后用Pro-Light HRP化学发光检测试剂显色,用Bio-Rad Chemi DocTMXRS+系统扫描成像。
4 统计学处理
各组实验数据均以均数±标准误(mean±SEM)表示,应用GraphPad Prism 5软件进行t检验或单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 枸橼酸铁铵提高HH4胞内hepcidin表达水平
不同浓度枸橼酸铁铵作用于HH4细胞48 h后,hepcidin表达水平与对照组相比呈浓度依赖性升高。其中,5 mmol/L和10 mmol/L组hepcidin表达水平显著上调,见图1。

Figure 1.Different concentrations of FAC induced upregulation of hepcidin expression in HH4. Mean±SEM.n=3.*P<0.05,**P<0.01vscontrol group(0 mmol/L).
图1 不同浓度FAC诱导HH4胞内Hepcidin表达上调
2 NF-κB与hepcidin上游启动子结合作用的分析
研究揭示转录因子NF-κB特异性结合目标基因启动区内一段10 bp的保守序列GGGRNNYYCC,其中R表示嘌呤,Y表示嘧啶,N代表任意的碱基。本研究利用在线转录因子结合位点预测工具SiteGA 对人hepcidin基因5’端序列潜在的转录因子NF-κB结合位点进行预测和分析,结果在hepcidin基因启动子区域起始位点上游-3 000 bp到起始位点下游100 bp共3 100 bp范围内(hepcidin_1|NC_000019 35770435…35773535)检测到一个可能的转录因子NF-κB结合位点:GGGAGACCCC(-785…-776)。
生物信息学分析提示hepcidin上可能存在NF-κB的结合位点,而本文ChIP实验结果显示hepcidin启动子区引物分别以5 mmol/L实验组和input组DNA为模板均能扩增出大小正确的条带,且前者灰度值弱于后者,这一结果表明NF-κB能够与hepcidin启动子区发生特异性结合,与预测结果相一致,见图2A。同时在EMSA实验中出现地高辛标记双链探针与核蛋白结合的滞后条带(泳道2),经120倍的冷探针竞争结合后,滞后条带明显减弱(泳道3),当在反应体系中同时加入NF-κB p65的抗体后又出现了一条更为滞后的条带(泳道4),即DNA/NF-κB/NF-κB p65抗体所形成的超迁移带。EMSA实验结果表明,转录因子NF-κB在体外可以和hepcidin启动子上的寡核苷酸序列相结合,见图2 B。
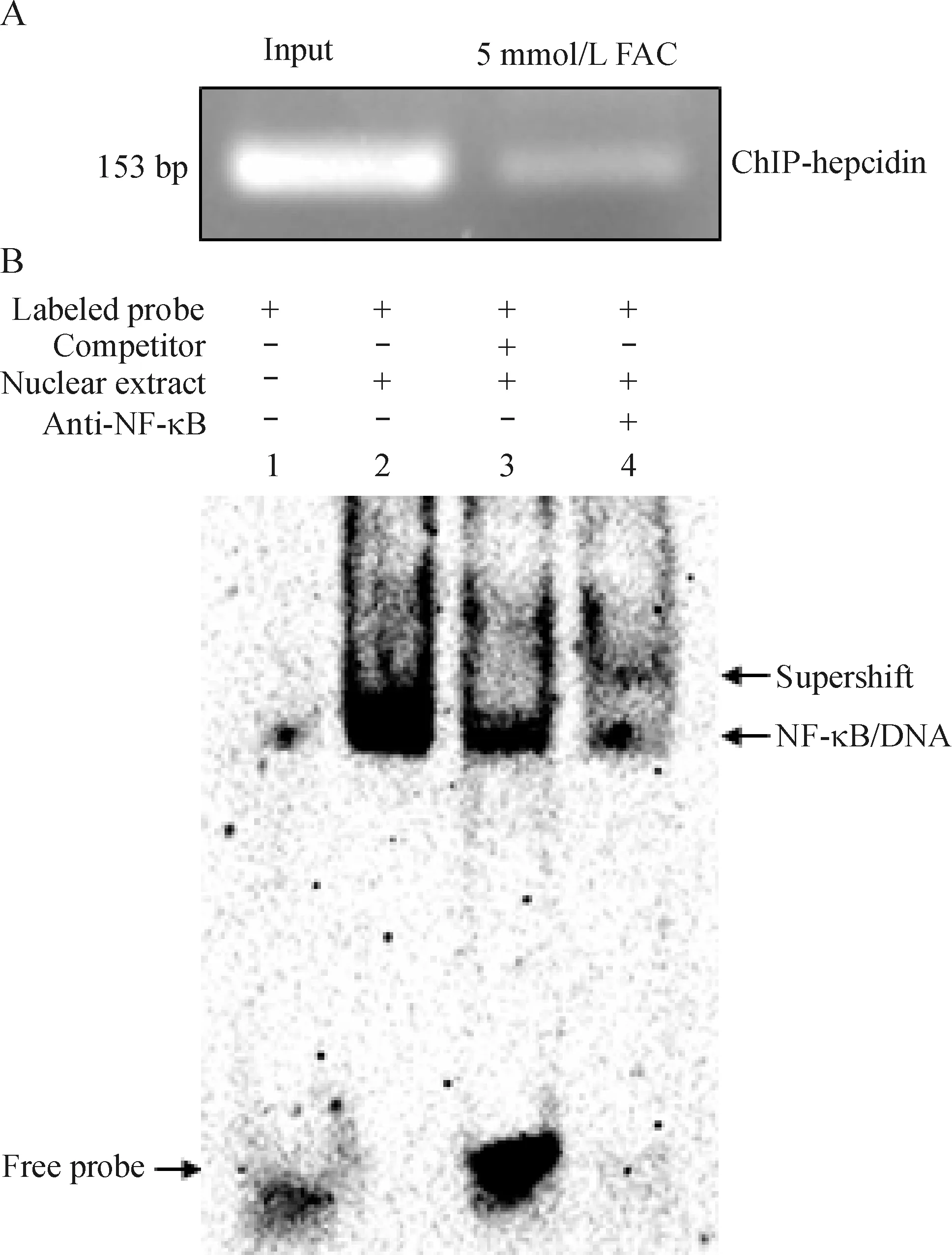
Figure 2.NF-κB binding tohepcidinpromoter region. NF-κB binding to thehepcidinpromoter was analyzed using ChIP and EMSA assays utilizing anti-NF-κB p65 after 48 h of FAC treatment. A: ChIP experiment. ChIP-hepcidin, 153 bp fragment from -848 to -694 inhepcidinpromoter. Input represents amplification ofhepcidinpromoter regions using cell lysates without immunoprecipitation. B: EMSA experiment.
图2 ChIP和EMSA实验证实NF-κB结合hepcidin上游启动子区
3 萤光素酶报告载体TOPFlash-pHepcidin的构建
为进一步检测NF-κB对HH4胞内hepcidin表达的调控,本研究构建人hepcidin启动子萤光素酶报告载体并对重组质粒瞬时转染HH4后的萤光活性进行分析。在TOPFlash-pHepcidin构建中,以HH4细胞基因组DNA为模板,PCR扩增出大小约846 bp的hepcidin基因5’上游片段。将启动子片段克隆到TOPFlash萤光素酶报告基因载体中, 获得重组质粒TOPFlash-pHepcidin。重组质粒经KpnI和BglII双酶切发现一长度约846 bp的片段,与预计一致。测序结果证实与GenBank中人hepcidin基因启动子序列一致,表明人hepcidin基因启动子报告基因载体TOPFlash-pHepcidin构建成功,见图3。

Figure 3.Construction of recombinant plasmid TOPFlash-pHepcidin. A: PCR amplification of humanhepcidinpromoter region. The M: DL2000 DNA ladder marker; Lane 1: PCR product of humanHepcidinpromoter. B: identification of recombinant plasmid by dual enzyme digestion. M1: DL2000 DNA ladder marker; Lanes 1, 2 and 3: enzymeKpnI &BglII digestion of 1, 2 and 3 positive transformants plasmid TOPFlash-pHepcidin; M2: 1 kb DNA ladder marker. C: the plasmid map of M50 Super 8x TOPFlash-pHepcidin.
图3 重组质粒TOPFlash-pHepcidin的构建
4 突变萤光素酶报告载体TOPFlash-pHepcidin-mut的构建


Figure 4.Sequencing map near NF-κB conserved sites of recombinant plasmid TOPFlash-pHepcidin/TOPFlash-pHepcidin-mut. A: sequencing map of recombinant plasmid TOPFlash-pHepcidin; B: sequencing map of recombinant plasmid TOPFlash-pHepcidin-mut.
图4 重组质粒TOPFlash-pHepcidin和TOPFlash-pHepcidin-mut上NF-κB保守位点附近的测序图谱
5 人Hepcidin基因启动子转录活性检测
TOPFlash/FOPFlash是在Wnt信号通路中比较常用的检测β-catenin表达的系统,它利用转录因子特异性结合靶位点进而启动下游的萤火虫萤光素酶基因的表达。其中,FOPFlash载体是包含突变的TCF/LEF DNA结合位点的对照质粒。从图5中可以看出,相对于内参对照组的FOPFlash质粒,所有5 mmol/L FAC处理和未处理的重组质粒组的相对萤光素酶活性在HH4细胞中均显著增高。同时,与未处理的重组质粒组相比,5 mmol/L FAC的处理能够使得萤光素酶的表达进一步增加。此外,与正常萤光素酶报告质粒TOPFlash-pHepcidin相比,突变萤光素酶报告质粒TOPFlash-pHepcidin-mut的相对萤光素酶活性下降了约40%和55%。这些结果表明,在HH4细胞中,NF-κB可以通过与人hepcidin基因的启动子区结合而调控hepcidin基因的表达。

Figure 5.The effect of NF-κB on transcriptional activity of humanhepcidinpromoter. Mean±SEM.n=3.**P<0.01vsTOPFlash;##P<0.01vsTOPFlash-pHepcidin;△△P<0.01vsTOPFlash-pHepcidin-mut.
图5 NF-κB对人hepcidin基因启动子转录活性的影响
6 抑制NF-κB的DNA结合活性对hepcidin表达的影响
为了进一步确定转录因子NF-κB在HH4细胞中参与了hepcidin的表达调控,利用NF-κB抑制剂BAY11-7082抑制NF-κB的DNA结合活性,然后观察hepcidin的表达水平。抑制剂BAY11-7082能抑制NF-κB的上游激活蛋白IκB的活性,从而间接影响NF-κB的活化。从图6可以看出,BAY11-7082处理HH4细胞5 h后,p-IκBα、p-NF-κB和hepcidin蛋白的表达水平均明显受到抑制。
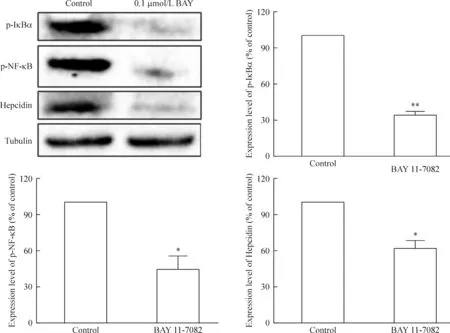
Figure 6.The effect of the NF-κB inhibitor BAY 11-7082 on hepcidin expression in HH4 cells. Mean±SEM.n=3.*P<0.05,**P<0.01vscontrol group.
图6 BAY 11-7082在HH4细胞对hepcidin表达水平的抑制作用

Figure 7.Schematic representation of hepcidin expression suppression induced by BAY 11-7082 in HH4.
图7 BAY 11-7082抑制胞内hepcidin蛋白表达示意图
讨 论
Hepcidin是机体铁吸收和代谢调控的关键效应分子,它的表达受铁贮存、低氧、炎症或细胞因子等多重信号直接或者间接调节[13]。Hepcidin表达紊乱会导致机体出现严重的病理性铁代谢紊乱,因此hepcidin表达的严密调控对维持体内铁稳态的平衡十分必要[14]。但是,当前对hepcidin表达的具体调控机制尚不十分清楚。
转录因子NF-κB广泛参与机体各种组织细胞中众多基因的转录[15]。NF-κB最早是从B淋巴细胞的核抽提物中发现的一种能与免疫球蛋白κ轻链基因的增强子上一段10 bp序列特异性结合的核蛋白因子[16]。NF-κB是由5种亚单位组成的同质的或异质的二聚体,包括NF-κB1(p50和它的前体p105)、NF-κB2(p52和它的前体p100)、 p65(也被称为RelA)c-Rel 和 RelB。其中,p50/p65是最常见的NF-κB二聚体形式[17]。本实验室研究发现铁过载引发HH4细胞内NF-κB和hepcidin的表达上调,推测两者在表达上可能存在紧密的联系。本研究利用转录因子预测工具SiteGA检测到hepcidin基因上游区存有潜在的NF-κB结合位点,随后的染色质免疫共沉淀和电泳迁移率变更实验验证了转录因子NF-κB可以特异性结合hepcidin启动子上的寡核苷酸序列。同时研究发现重组质粒TOPFlash-pHepcidin萤光素酶活性显著高于内参质粒FOPFlash,而NF-κB保守结合位点的突变则引起了重组质粒TOPFlash-pHepcidin-mut萤光素酶活性的显著下降。此外,本实验发现抑制剂BAY11-7082不但能显著影响胞内IκB和NF-κB的磷酸化,同时也导致了下游蛋白hepcidin表达的显著下调。
综上所述,FAC过载可以诱导HH4细胞hepcidin表达上调。本研究同时利用ChIP和EMSA实验表明NF-κB能够结合hepcidin上游启动子区。此外,实验通过成功克隆人hepcidin基因上游启动子区,构建人hepcidin基因启动子萤光素酶报告载体TOPFlash-pHepcidin和TOPFlash-pHepcidin-mut,以及利用BAY11-7082抑制胞内NF-κB等方法,确证了铁过载模式下NF-κB对HH4细胞hepcidin表达的调控作用。基于hepcidin表达受到多种因素的影响,本实验结果对进一步研究多因子协同调控hepcidin表达机制,以及揭示体内铁稳态调控的具体分子机理奠定了基础。
[1] Xu Q, Kanthasamy A, Jin H, et al. Hepcidin plays a key role in 6-OHDA induced iron overload and apoptotic cell death in a cell culture model of Parkinson’s disease[J]. FASEB J, 2014, 28(1 Suppl): 1038.
[2] Viatte L, Vaulont S. Hepcidin, the iron watcher[J]. Biochimie, 2009, 91(10): 1223-1228.
[3] Corradini E, Rozier M, Meynard D, et al. Iron regulation of hepcidin despite attenuated Smad1,5,8 signaling in mice without transferrin receptor 2 or Hfe [J]. Gastroenterology, 2011, 141(5):1907-1914.
[4] Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization[J]. Science, 2004, 306(5704): 2090-2093.
[5] Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation[J]. Blood, 2003, 102(3):783-788.
[6] Papanikolaou G, Tzilianos M, Christakis JI, et al. Hepcidin in iron overload disorders[J]. Blood, 2005, 105(10):4103-4105.
[7] Lin L, Valore EV, Nemeth E, et al. Iron transferrin regulates hepcidin synthesis in primary hepatocyte culture through hemojuvelin and BMP2/4 [J]. Blood, 2007, 110(6):2182-2189.
[8] Bloomer SA, Kregel KC, Brown KE. Heat stress stimulates hepcidin mRNA expression and C/EBPα protein expression in aged rodent liver[J]. Arch Gerontol Geriatr, 2014, 58(1):145-152.
[9] De Domenico I, Ward DM, Kaplan J. Regulation of iron acquisition and storage: consequences for iron-linked disorders[J]. Nat Rev Mol Cell Biol, 2008, 9(1):72-81.
[10]钱忠明,康友敏,常彦忠,等. HFE蛋白与遗传性血色病[J]. 中国病理生理杂志, 2006, 22(2):408-411.
[11]Andrews NC. Forging a field: the golden age of iron biology[J]. Blood, 2008, 112(2):219-230.
[12]Mueller K, Sunami Y, Stuetzle M, et al. CHOP-mediated hepcidin suppression modulates hepatic iron load[J]. J Pathol, 2013, 231(4):532-542.
[13]张玉超,沈媛媛,晏向华,等. 哺乳动物铁稳态分子机制研究进展[J]. 中国细胞生物学学报, 2011, 33(11):1179-1190.
[14]Camaschella C, Silvestri L. Molecular mechanisms regulating hepcidin revealed by hepcidin disorders[J]. Sci World J, 2011, 11:1357-1366.
[15]Baldwin AS Jr. The NF-κB and IκB proteins: new disco-veries and insights[J]. Ann Rev Immunol, 1996, 14: 649-681.
[16]Lenardo MJ, Baltimore D. NF-κB: a pleiotropic mediator of inducible and tissue-specific gene control[J]. Cell, 1989, 58(2):227-229.
[17]Crampton SJ, O’Keeffe GW. NF-κB: Emerging roles in hippocampal development and function[J]. Int J Biochem Cell Biol, 2013, 45(8): 1821-1824.
NF-κB participates inhepcidinup-regulation induced by iron overload in HH4 hepatocytes
LI Shi-wei1, 2, LI Xiang3, GUAN Feng1, 2
(1KeyLaboratoryofCarbohydrateChemistry&Biotechnology,MinistryofEducation, 2SchoolofBiotechnology,3WuxiMedicalSchool,JiangnanUniversity,Wuxi214122,China.E-mail:fengguan@jiangnan.edu.cn)
AIM: To study the effects of nuclear factor kappa B (NF-κB) on humanhepcidinexpression in ferric ammonium citrate (FAC)-induced HH4 hepatocytes. METHODS: Non-transformed HH4 cells were exposed to FAC at concentrations of 0.1, 1, 5 and 10 mmol/L for 48 h. The expression of iron regulatory genehepcidinwas determined by semi-quantitative RT-PCR. The effects of NF-κB onhepcidintranscriptional activity were detected using chromatin immunoprecipitation (ChIP), electrophoretic mobility shift assay (EMSA) and dual-luciferase reporter assay system, combined with the inhibition experiments of intracellular NF-κB activity. RESULTS: FAC at concentrations of 5 mmol/L and 10 mmol/L significantly enhanced the expression ofhepcidin. The results of ChIP and EMSA showed the binding of NF-κB to the upstream ofhepcidinpromoter. Treatment with NF-κB inhibitor BAY 11-7082 attenuatedhepcidinexpression. The luciferase activity in the cells transfected with recombinant luciferase reporter plasmid was obviously higher than that in control group.CONCLUSION: NF-κB is the transcription factor that contributes tohepcidinexpression in iron overload-induced HH4 cells.
Nuclear factor κB; Chromatin immunoprecipitation; Electrophoretic mobility shift assay; Dual-luciferase reporter assay system; Hepcidin
1000- 4718(2015)04- 0695- 07
2014- 10- 22
2014- 12- 25
R363
A
10.3969/j.issn.1000- 4718.2015.04.022
△通讯作者 Tel: 0510-86918126; E-mail: fengguan@jiangnan.edu.cn
