微小RNA-16对K562细胞向巨核细胞系分化的影响
2015-04-17史金龙袁玉林
史金龙, 刘 峰, 胡 颖, 袁玉林, 卢 运△
(1武汉大学基础医学院解剖教研室,湖北 武汉 430071; 2荆州市第三人民医院普胸外科,湖北 荆州 434000)
微小RNA-16对K562细胞向巨核细胞系分化的影响
史金龙1, 2, 刘 峰2, 胡 颖2, 袁玉林1, 卢 运2△
(1武汉大学基础医学院解剖教研室,湖北 武汉 430071;2荆州市第三人民医院普胸外科,湖北 荆州 434000)
目的: 观察微小RNA-16(microRNA-16,miR-16)对人白血病细胞K562向巨核细胞系分化的影响,并初步探索其中可能的机制。方法: 在K562细胞中通过转染miR-16模拟物(mimics)或miR-16抑制物(inhibitor),实时荧光定量PCR检测miR-16的水平变化,通过流式细胞术检测巨核细胞系分化指标CD41、CD42b及CD61的表达。用Western blotting检测miR-16对下游白血病癌基因(myeloblastosis oncogene,MYB)蛋白水平的影响,进而利用流式细胞术检测miR-16是否通过影响MYB调控CD41、CD42b及CD61的表达。结果: 转染miR-16-mimics可显著升高K562细胞中的miR-16水平并促进CD41、CD42b及CD61的表达(P<0.05),而转染miR-16-inhibitor可明显抑制K562细胞中的miR-16水平同时降低CD41、CD42b及CD61的表达(P<0.05);Western blotting证实miR-16可调控MYB蛋白水平,而沉默MYB可逆转miR-16对CD41、CD42b及CD61表达的调控作用。结论: miR-16可通过调控MYB的表达,调节人白血病细胞K562向巨核细胞系分化的能力。
微小RNA-16; 白血病癌基因; 巨核细胞系分化; 血小板
微小RNAs(microRNAs,miRNAs)作为一类非编码单链小RNAs,广泛存在于人体各组织脏器中,可通过影响靶基因mRNA的稳定性及翻译活性 ,参与靶基因的转录后调控。近年研究发现,miRNAs在人类肿瘤、分化发育等多种疾病中均扮演重要作用[1-3]。有文献表明微小RNA-16 (microRNA-16,miR-16)随着巨核细胞分化成熟的过程逐渐升高,在血小板中表达明显增加,而且miR-16可调控白血病癌基因(myeloblastosis oncogene,MYB)表达,参与B细胞淋巴瘤的发生发展[4-5]。但miR-16在巨核细胞分化中的作用尚不十分清楚,miR-16表达水平的升高是巨核细胞分化中的伴随现象还是发挥重要调控作用,miR-16是否通过调控成髓细胞MYB表达参与巨核细胞分化这些问题尚待解答。本文利用miR-16模拟物(mimics)及抑制物(inhibitor)作为工具,以人白血病细胞K562作为实验模型,旨在研究miR-16对巨核细胞分化的影响,并初步探索其中可能的机制。
材 料 和 方 法
1 材料
人白血病细胞K562购自中科院上海细胞库。用含10%胎牛血清的RPMI-1640培养基常规培养于5% CO2、37 ℃培养箱中。
胎牛血清、RPMI-1640培养基购自南京凯基生物有限公司;转染试剂Lipofectamine 2000、逆转录试剂及荧光定量PCR试剂购自Invitrogen;miR-16模拟物(mimics)、抑制物(inhibitor)及miR-16荧光定量PCR检测引物均由广州锐博生物科技公司设计并合成;抗MYB抗体、抗GAPDH抗体购自CST,抗CD41、CD42b和CD61流式抗体购自BD;MYB表达质粒和特异性siRNA及12-O-十四烷酰佛波醇-13-乙酸酯(12-O-tetradecanoylphorbol-13-acetate, TPA)购自Sigma。
2 实验方法
2.1 转染及药物处理 miR-16模拟物(mimics)、抑制物(inhibitor)及MYB表达质粒和特异性siRNA按照Lipofectamine 2000试剂说明书常规转染48 h后行相关检测,其中miR-16-mimics和inhibitor包括50 nmol/L和100 nmol/L两种浓度,以对照microRNA(control)、空质粒(vector)及无意乱序siRNA(si-scramble)作为实验的阴性对照。TPA以1 nmol/L的终浓度处理K562细胞作为诱导其向巨核细胞系分化的阳性对照。
2.2 实时荧光定量PCR(real-time PCR) 收集各组转染后的K562细胞,Trizol一步法提取其中总RNA,按照锐博生物说明书逆转录合成cDNA,利用real-time PCR试剂盒行PCR扩增,ABI 7300检测并分析细胞中miR-16的水平。
2.3 流式细胞术检测CD41、CD42b 及 CD61的表达 将K562细胞以每孔1×106密度接种于6孔板,按照上述方法转染不同浓度的microRNA、质粒或siRNA,常规培养48 h后,低速离心收集细胞,PBS洗涤2次后室温孵育FITC-CD41抗体30 min,再次用PBS洗涤后流式细胞仪检测并分析CD41、CD42b 及 CD61阳性比率。相同实验重复3次。
2.4 Western blotting实验 收集转染处理后的K562细胞,加入适量RIPA裂解液,获取细胞总蛋白液,加入SDS上样缓冲液100 ℃水浴解除蛋白交联。各组蛋白样品行聚丙烯酰胺凝胶电泳,PVDF 膜转膜并用脱脂奶粉封闭1 h,然后依次孵育 I 抗4 ℃过夜及辣根过氧化物酶标记的 II 抗室温1 h后化学发光法显影,检测细胞中MYB表达情况,以GAPDH作为内参照。
3 统计学处理
用SPSS 12.0统计学软件进行统计分析。实验数据以均数±标准差(mean±SD)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 在K562细胞中过表达或低表达miR-16
K562细胞中转染miR-16-mimics可显著升高K562细胞中的miR-16水平(P<0.05),随着mimics浓度的增高,miR-16水平升高的更加明显;而转染miR-16-inhibitor可明显抑制K562细胞中的miR-16水平(P<0.05),随着inhibitor浓度的增高,miR-16水平的下降更加明显,见图1。

Figure 1.miR-16 over- and low-expression in K562 cells. Mean±SD.n=3.*P<0.05vsblank and miR-control.
图1 在K562细胞中过表达或低表达miR-16
2 miR-16对K562细胞CD41表达的影响
流式细胞术检测miR-16对K562细胞中CD41、CD42b 及 CD61阳性比率的影响,结果提示,转染miR-16-mimics(100 nmol/L)后,CD41、CD42b 及 CD61阳性率均明显升高,与阳性对照TPA处理后的CD41阳性率相近;而TPA处理同时转染miR-16-inhibitor(100 nmol/L)可逆转CD41、CD42b 及 CD61表达的上升,这表明miR-16在TPA诱导的K562向巨核细胞系分化的过程中发挥着重要作用,见图2。

Figure 2.The effect of miR-16 on the differentiation of K562 cells. Mean±SD.n=3.*P<0.05vsmiR-control;#P<0.05vsTPA+miR-control.
图2 miR-16对K562细胞分化的影响
3 miR-16对K562细胞中MYB表达的影响
干预miR-16后,利用Western blot检测MYB蛋白水平变化,结果提示,与阴性对照组(miR-control)及空白对照组(blank)相比,miR-16-mimics可明显降低K562细胞中MYB的蛋白水平;而转染miR-16-inhibitor沉默miR-16的表达后,MYB的蛋白水平明显增加,同时我们发现,miR-16对MYB蛋白水平的影响具有浓度依赖性。以上结果提示miR-16可能通过MYB影响K562细胞分化,见图3。
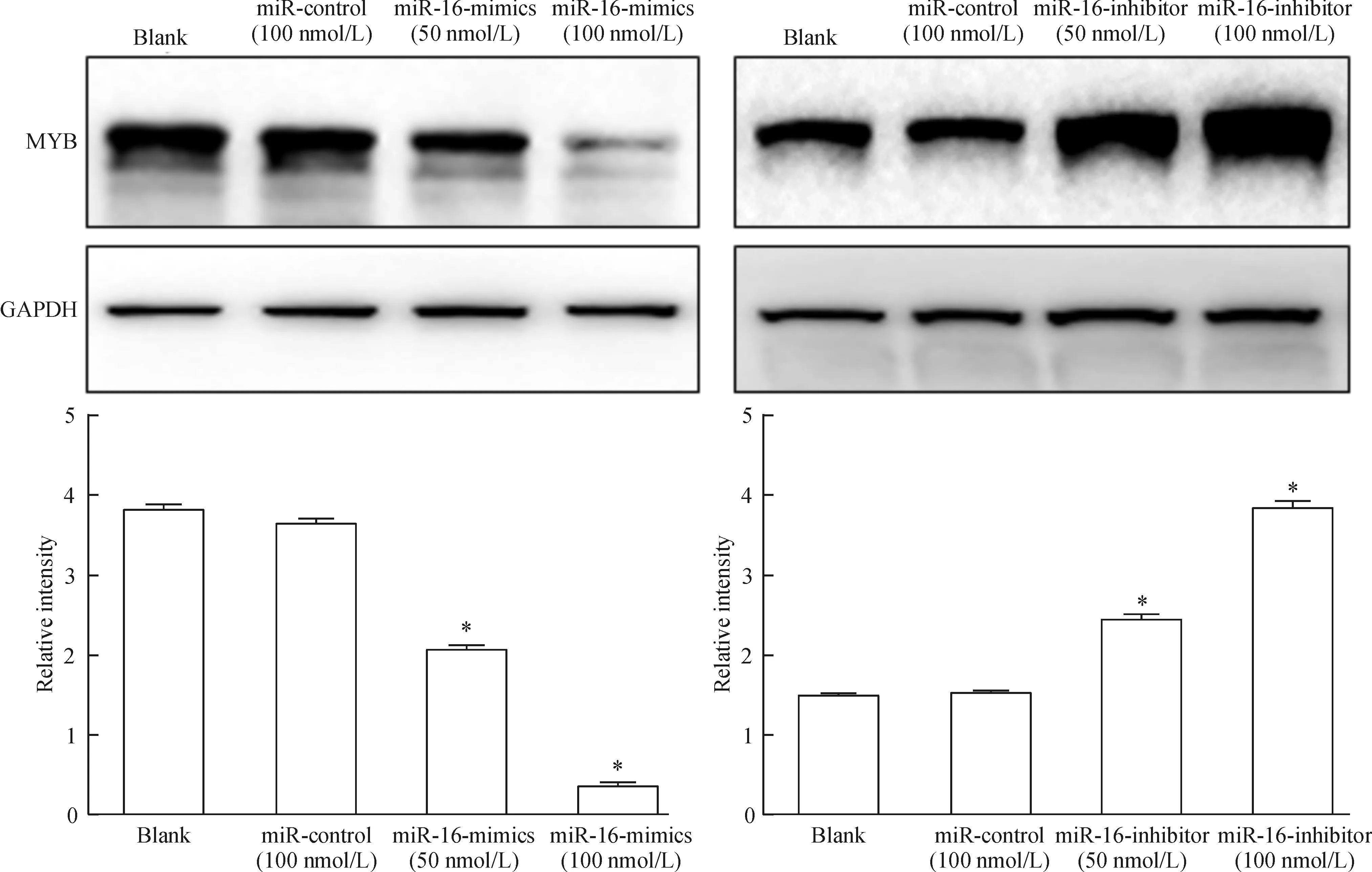
Figure 3.The effect of miR-16 on MYB expression in the K562 cells. Mean±SD.n=3.*P<0.05vsblank and miR-control.
图3 miR-16对K562细胞中MYB表达的影响
4 miR-16通过MYB影响CD41、CD42b 及 CD61的表达
为了进一步验证miR-16是否通过MYB影响K562细胞分化,我们同时干预miR-16及MYB的表达,利用流式细胞术检测CD41、CD42b 及 CD61的阳性率,结果提示,过表达MYB可以逆转miR-16-mimics(100 nmol/L)对CD41、CD42b 及 CD61表达的促进作用;而沉默MYB可恢复miR-16-inhibitor(100 nmol/L)所抑制的K562向巨核细胞系分化的能力,见图4。
讨 论
研究表明,miRNAs可结合于靶基因mRNA的3’UTR区域,促进该mRNA降解或抑制核糖体的翻译功能,在肿瘤的发生发展及胚胎发育器官形成等多种病理生理学进程中起重要的作用[6-7]。文献报道,miR-16作为miR-15a/16家族中的一员,在B细胞慢性淋巴细胞白血病、黑色素瘤、结直肠癌等多种恶性肿瘤中异常表达,通过调控Bcl2、cyclin D1及MCL1等凋亡、细胞周期相关基因参与肿瘤的发生发展[8-10]。也有文章表明在造血干细胞分化成为巨核细胞的过程中miR-16表达逐渐升高,并且在成熟的血小板中含量较高[4]。但miR-16在巨核细胞分化过程中的作用尚不清楚。我们在人白血病细胞K562中干预miR-16的表达,通过流式细胞术检测巨核细胞系标志CD41、CD42b 及 CD61的表达阳性率,发现miR-16升高后可以明显促进CD41、CD42b 及 CD61的表达,且具有浓度依赖性,在TPA诱导的分化模型中同时抑制miR-16可部分抵消TPA的作用,这提示miR-16在巨核细胞分化过程中可能发挥重要作用。
MYB是在多个物种中高度保守的转录因子,在血细胞的增殖和分化过程中起核心调控作用[11-12],一般认为,MYB表达增加可促进细胞增殖同时抑制其分化潜能,相反MYB的表达下降可抑制细胞周期进程同时促进造血干细胞及祖细胞向成熟细胞分化,既往研究表明miR-16可结合在MYB的3’端非编码区,参与其转录后调控,我们的结果也证实了miR-16可以调控MYB的蛋白表达。同时干预MYB的水平,可以逆转miR-16对于CD41、CD42b 及CD61的影响,提示MYB在miR-16调控CD41、CD42b 及 CD61的过程中发挥重要作用。

Figure 4.The effect of miR-16 on the differentiation of K562 cells was mediated by MYB. Mean±SD.n=3.*P<0.05vsmiR-control+vector;#P<0.05vsmiR-16-mimics+vector;△P<0.05vsTPA+miR-control+si-scramble;▲P<0.05vsTPA+miR-inbibitor+si-scramble.
图4 miR-16通过MYB影响K562细胞的分化
综上所述,我们的研究发现,在人白血病K562细胞中过表达miR-16,可以升高CD41、CD42b 及 CD61的表达阳性率,而低表达miR-16可抑制上述过程。进而我们通过Western blotting验证了miR-16对MYB蛋白水平的影响,通过流式细胞术证实miR-16通过MYB调控CD41、CD42b 及 CD61的表达,初步阐明了miR-16调控K562细胞向巨核细胞系分化的分子生物学机制,为巨核细胞白血病、特发性血小板减少性紫癜等骨髓巨核细胞成熟障碍性疾病的临床治疗提供了新的药物靶点及监测指标。
[1] Fatica A, Fazi F. MicroRNA-regulated pathways in hematological malignancies: how to avoid cells playing out of tune[J]. Int J Mol Sci, 2013, 14(10):20930-20953.
[2] Ling H, Fabbri M, Calin GA. MicroRNAs and other non-coding RNAs as targets for anticancer drug development[J]. Nat Rev Drug Discov, 2013, 12(11):847-865.
[3] He Y, Jiang X, Chen J. The role of miR-150 in normal and malignant hematopoiesis[J]. Oncogene, 2014, 33(30):3887-3893.
[4] Kannan M, Mohan KV, Kulkarni S, et al. Membrane array-based differential profiling of platelets during storage for 52 miRNAs associated with apoptosis[J]. Transfusion, 2009, 49(7):1443-1450.
[5] Chung EY, Dews M, Cozma D, et al. c-Myb oncoprotein is an essential target of thedleu2 tumor suppressor micro-RNA cluster[J]. Cancer Biol Ther, 2008, 7(11):1758-1764.
[6] 邓小耿, 邱荣林, 伍耀豪, 等. miRNA-122促进小鼠胚胎干细胞源性肝前体细胞的分化与成熟[J]. 中国病理生理杂志, 2013, 29(7):1260-1267.
[7] 严金海, 王志强, 韩西群, 等. Hsa-miR-150过表达诱导弥漫大B淋巴瘤细胞系OCI-Ly10再分化[J]. 中国病理生理杂志, 2014, 30(2):226-232.
[8] Nana-Sinkam SP, Croce CM. MicroRNA in chronic lymphocytic leukemia: transitioning from laboratory-based investigation to clinical application[J]. Cancer Genet Cytogenet, 2010, 203(2):127-133.
[9] Willimott S, Wagner SD. Post-transcriptional and post-translational regulation of Bcl2[J]. Biochem Soc Trans, 2010, 38(6):1571-1575.
[10]Vasilatou D, Papageorgiou S, Pappa V, et al. The role of microRNAs in normal and malignant hematopoiesis[J]. Eur J Haematol, 2010, 84(1):1-16.
[11]Pattabiraman DR, Gonda TJ. Role and potential for therapeutic targeting of MYB in leukemia[J]. Leukemia, 2013, 27(2):269-277.
[12]Prouse MB, Campbell MM. The interaction between MYB proteins and their target DNA binding sites[J]. Biochim Biophys Acta, 2012, 1819(1):67-77.
Effect of miR-16 on megakaryocytic differentiation of K562 cells
SHI Jin-long1, 2, LIU Feng2, HU Ying2, YUAN Yu-lin1, LU Yun2
(1DepartmentofAnatomy,SchoolofBasicMedicine,WuhanUniversity,Wuhan430071,China;2DepartmentofGeneralandThoracicSurgery,JingzhouThirdPeople'sHospital,Jingzhou434000,China.E-mail: 2297308442@qq.com)
AIM: To observe the effect of microRNA-16 (miR-16) on the megakaryocytic differentiation of K562 cells, and to explore the potential mechanism. METHODS: miR-16 was over-expressed or silenced by transfection with miR-16 mimics or inhibitor in K562 cells. The level of miR-16 was detected by real-time PCR. The expression of CD41, CD42b and CD61, as megakaryocytic differentiation markers, was detected by flow cytometry. The effect of miR-16 on the expression of myeloblastosis oncogene (MYB) was measured by Western blotting, and flow cytometry was performed to confirm whether the effect of miR-16 on expression of CD41, CD42b and CD61 was mediated by MYB. RESULTS: Transfection with miR-16 mimics dramatically elevated the level of miR-16 and the expression of CD41, CD42b and CD61 in the K562 cells. Transfection with miR-16 inhibitor decreased the level of miR-16 and the expression of CD41, CD42b and CD61 in the K562 cells (P<0.05). The expression of MYB was regulated by miR-16, andMYBsilencing reversed the regulation of CD41, CD42b and CD61 induced by miR-16. CONCLUSION: miR-16 regulates the megakaryocytic differentiation of K562 cells by targetingMYB.
MicroRNA-16; Myeloblastosis oncogene; Megakaryocytic differentiation; Platelets
1000- 4718(2015)04- 0585- 05
2014- 12- 17
2015- 03- 04
R558; R363.2
A
10.3969/j.issn.1000- 4718.2015.04.002
△通讯作者 Tel: 0716-8316451; E-mail: 2297308442@qq.com
