TEA+MEA混合胺液脱除天然气中CO2吸收性能
2015-03-28唐建峰张新军徐明海史泽林
唐建峰,青 霞,张新军,徐明海,黄 彬,李 晶,史泽林,杨 帆
(中国石油大学(华东)储运与建筑工程学院,山东 青岛 266580)
TEA+MEA混合胺液脱除天然气中CO2吸收性能
唐建峰,青 霞,张新军,徐明海,黄 彬,李 晶,史泽林,杨 帆
(中国石油大学(华东)储运与建筑工程学院,山东 青岛 266580)
为适应寻找经济、高效的新型天然气脱碳吸收剂的需求,研究了由三乙醇胺(TEA)和一乙醇胺(MEA)组成的混合胺溶液。实验考察了单一胺和不同比例的混合胺的吸收性能,确定了两种胺的最佳混合比例。结果表明,在TEA中添加MEA能够显著提升其CO2吸收效果,优化比例的混合胺具有更好的CO2吸收负荷、吸收速率和吸收稳定性。
三乙醇胺;一乙醇胺;混合胺液;天然气;二氧化碳;吸收性能
从地层中开采出的天然气中大多含有CO2等酸性气体,其存在会在天然气储运和利用过程中引起管道腐蚀、燃气热值降低、生成水合物等问题。因此,脱碳是天然气预处理中非常重要的环节。目前天然气脱碳的方法很多,如醇胺法、膜分离法等[1-3]。其中胺法脱碳因具有处理量大、脱除率高等优点而被广泛应用于工业生产中[4-6]。
目前国内外对醇胺法脱碳已有大量研究,但关于混合胺液配方的确定过程研究较少。而混合胺液吸收能力强、反应速度快、适用范围广、再生能耗低、气体损失小、净化程度高、溶液腐蚀性低,可以弥补单一胺液的不足提高胺液的综合性能,达到改善脱碳效果的目的[7-9]。TEA为主体,添加MEA作为活化剂,运用单一吸收实验及循环往复实验,分析不同配比TEA+MEA混合胺液的CO2吸收性能,并进行循环性能实验验证,旨在为脱碳混合胺液的配方优选提供实验依据,开发更为高效、经济,且工程适用的新型脱碳胺液配方。
1 实验部分
1.1 实验装置及流程
吸收实验装置流程如图1所示,高压气瓶1中原料气经减压阀调压后通入高压反应釜6,与反应釜内预先充入的胺液进行吸收反应。其中的关键设备为带有磁耦合搅拌的反应釜,容积300mL,设计压力10MPa。磁力搅拌速率范围为150r/min~1200r/min。反应釜外壳为循环夹套,恒温水浴11可提供一定温度的导热液体,用于胺液反应过程中的温度控制,进行不同操作温度的实验。恒温水浴的温度控制范围为室温以上5℃至100℃,控制精度±0.1℃。采用真空泵6对反应釜及管线进行排空。

图1 吸收实验装置流程图
1.2 实验步骤
(1)打开恒温水浴,将加热温度设定到要求值;
(2)配制胺液样本,使用真空泵抽出反应釜内气体后,将预先配制的胺液充入釜中;
(3)胺液充入反应釜后,持续抽真空一段时间,至釜内压力基本为0;
(4)向釜内充入原料气,待釜内压力略高于实验压力时停止充气;
(5)打开数据采集系统,进行数据记录;
(6)打开磁力搅拌系统,将搅拌速率控制在设定值;
(7)进行吸收实验,观察反应釜内温度、压力变化数据,待釜内压力趋于稳定后,关闭数据采集系统及恒温水浴,吸收实验结束。
1.3 实验指标
胺液吸收性能的评价指标定义如下:(1)吸收负荷(L/mol·L-1)

式中:n-胺液吸收的CO2的物质的量,mol;V-胺液量,L。
(2)吸收速率(vab/mol·L-1·min-1)

式中:Δτ-时间,min;Δn-Δτ时间内CO2的物质的量的变化量,mol。
2 结果与讨论
2.1 MEA添加剂性能研究实验
从相关研究已知,TEA胺液的液相吸收负荷较大,但是吸收速率较慢,而MEA胺液的吸收速率较快[10-12]。为了寻找TEA为主体的混合胺液中理想的添加剂,并实现TEA+MEA混合胺液与TEA单一胺液、MEA单一胺液的吸收性能对比,本文分别配制了 2mol/L TEA+1mol/L MEA、3mol/L TEA、2mol/L TEA、1mol/L MEA四种胺液进行相同条件下的吸收实验,并对实验结果进行对比分析。
本节吸收实验所选用的实验参数依据本课题前期研究基础确定:原料气为纯CO2气体,胺液量为100mL,吸收压力为0.21MPa,操作温度为50℃,搅拌速率为220r/min[13-14]。
2.1.1 吸收负荷随时间变化规律
图2为4种不同胺液配方的CO2吸收负荷随时间的变化规律。
由图2可以看出,4种不同胺液配方的CO2吸收负荷均随时间的增加而逐渐增大,且均在初始阶段呈近似线性快速增长,一段时间后增长趋缓并最终趋于稳定。各胺液的最终液相吸收负荷及同一时刻下的吸收负荷按从大到小排序均为:2mol/L TEA+1mol/L MEA>3mol/L TEA>2mol/L TEA>1mol/L MEA。其中,2mol/L TEA+1mol/L MEA混合胺液与3mol/L TEA单一胺液最终液相吸收负荷非常接近,与1mol/L MEA单一胺液完成吸收过程所需时间相差不大。由此可知:MEA单一胺液的CO2吸收负荷较小,TEA胺液中加入MEA活化剂能够显著提高其CO2吸收负荷;TEA+MEA混合胺液与相同浓度的TEA单一胺液相比能更快地完成CO2的吸收;TEA+MEA混合胺液能够实现TEA和MEA两种单一胺液的优势互补。
2.1.2 吸收速率随时间变化规律
图3表示4种不同胺液配方的CO2吸收速率随时间的变化规律。

图2 不同胺液的CO2吸收负荷随时间的变化曲线
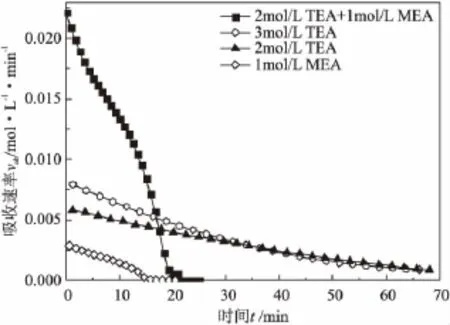
图3 不同胺液的CO2吸收速率随时间的变化曲线
由图3可以看出,4种不同胺液配方的CO2吸收速率均随时间增加而减小并最终趋于零。2mol/L TEA+1mol/L MEA混合胺液初始CO2吸收速率显著高于其他3种胺液,1mol/L MEA胺液的初始CO2吸收速率最低。在0~30min内,3mol/L TEA胺液的吸收速率高于2mol/L TEA胺液;在30min~70min内,3mol/L TEA胺液与2mol/L TEA胺液的吸收速率曲线几乎重合。2mol/L TEA+1mol/L MEA混合胺液与1mol/L MEA胺液完成吸收过程所需时间近似一致,为25min左右;3mol/L TEA胺液与 2mol/L TEA胺液的吸收完成时间均为70min左右。由此可知:增加TEA胺液浓度可以加快TEA单一胺液的CO2吸收速率,但影响较小;MEA胺液中加入TEA胺液能够显著提高其CO2吸收速率,且不影响其吸收完成时间;TEA胺液中加入MEA活化剂能够显著提高其CO2吸收速率并缩短其吸收达到平衡所需的时间;TEA+MEA混合胺液与等浓度的TEA单一胺液相比具有更高的CO2吸收速率和更低的吸收完成时间。
2.1.3 吸收速率随吸收负荷变化规律
图4表示4种不同胺液配方的CO2吸收速率随吸收负荷的变化规律。

图4 不同胺液的CO2吸收速率随吸收负荷的变化曲线
由图4可以看出,4种不同胺液配方的CO2吸收速率均随吸收负荷的增加而减小并最终趋于零。同一吸收负荷下,2mol/L TEA+1mol/L MEA混合胺液始终具有最高的CO2吸收速率,随吸收反应的进行,吸收负荷升高,吸收速率缓慢平稳下降,当吸收负荷超过0.22mol/L后其吸收速率迅速下降,于吸收负荷为0.25mol/L时2mol/L TEA+1mol/L MEA混合胺液吸收速率下降为零,分析认为由于吸收反应进行到一定程度后,原料气中CO2浓度过低,从而导致吸收速率迅速下降。3mol/L TEA胺液与2mol/ L TEA胺液吸收速率随吸收负荷变化趋势相似,其最终吸收负荷为0.21mol/L~0.23mol/L之间。同一吸收负荷下,吸收速率及吸收负荷由大到小依次为:2mol/L TEA+1mol/L MEA>3mol/L TEA>2mol/L TEA>1mol/L MEA。由此可知:增加TEA单一胺液的浓度可相应提升其吸收速率及最终吸收负荷,但影响较小;TEA胺液中加入MEA活化剂能够显著提高其CO2吸收速率,且最终吸收负荷也有所提升;TEA+MEA混合胺液与相同总胺浓度的TEA单一胺液相比,在同一吸收负荷下具有更高的CO2吸收速率,且具有更高的最终吸收负荷。说明MEA活化剂可显著提高TEA+MEA混合胺液的吸收性能。
2.1.4 综合分析
综合分析2.1.1~2.1.3内容可知:TEA单一胺液与MEA单一胺液相比CO2吸收负荷更高,适宜作为混合胺液配方中的主吸收剂;MEA单一胺液与TEA单一胺液相比吸收反应完成所需时间更短,适宜作为混合胺液配方中的活化剂;TEA单一胺液中,胺液浓度的增加对其CO2吸收性能有所提升但影响不大;TEA胺液中添加MEA活化剂能够显著提高其CO2吸收速率,并缩短吸收达到平衡所需的时间,较好的实现两种单一胺液的优势互补。因此认为,TEA+MEA混合胺液具有良好的吸收性能,可作一种吸收CO2的优良胺液配方,用于实际天然气脱碳工业中。
2.2 混合胺液配比优选实验
对不同配比的TEA+MEA混合胺液CO2吸收性能进行实验研究,实验采用更接近生产实际的φ(CO2)为4.07%的CH4/CO2混合气,其它操作条件不变。从文献可知,MEA胺液浓度高于1mol/L时腐蚀作用较强,因此本文配制了总胺浓度均为3mol/L、TEA/MEA分别为配比A、配比B、配比C的3种混合胺液。其中MEA浓度由大到小排序依次为:1mol/L≥配比A中MEA浓度≥配比B中MEA浓度≥配比C中MEA浓度≥0。考虑到吸收速率随时间变化规律及随吸收负荷变化规律的分析结果大致相同,因此只分析吸收速率随吸收负荷的变化规律。
2.2.1 吸收负荷随时间变化规律
图5为3种不同配比混合胺液的CO2吸收负荷随时间的变化规律。
由图5可以看出,各混合胺液的吸收负荷均随时间的增加在初始阶段呈线性规律迅速增长,一段时间后增长速率变慢并最终趋于稳定。配比A和配比B的混合胺液的吸收负荷变化曲线非常接近,并在吸收时间20min左右即开始达到吸收平衡,且同一时刻的吸收负荷值明显高于配比为C的混合胺液。配比C混合胺液吸收达到平衡所需的时间较长,为65min左右。由此可知:当MEA浓度为配比C~配比B之间范围内时,增加其浓度可明显提高TEA+MEA混合胺液的CO2吸收负荷,并缩短其吸收达到平衡所需的时间;当MEA浓度为配比B~配比A范围内时,增加其浓度对TEA+MEA混合胺液的CO2吸收负荷和吸收完成时间影响不大,即配比A混合胺液和配比B混合胺液具有相近的CO2吸收负荷变化规律,且吸收性能表现较优。
2.2.2 吸收速率随吸收负荷变化规律
图6为3种不同配比混合胺液的CO2吸收速率随吸收负荷的变化规律。

图5 不同配比混合胺液的CO2吸收负荷随时间变化曲线

图6 不同配比混合胺液的CO2吸收速率随吸收负荷变化曲线
由图6可以看出,各混合胺液的CO2吸收速率均随吸收负荷的增加而降低并最终趋于接近零。3种混合胺液的最终吸收负荷大致相同,均为0.15mol/L左右。当吸收负荷为0~0.11mol/L范围内时,同一吸收负荷下各混合胺液的CO2吸收速率排序依次为:配比A>配比B>配比C,且前两种混合胺液的初始吸收速率明显高于第三种混合胺液。当吸收负荷超过0.11mol/L时,配比A混合胺液的吸收速率开始低于配比B混合胺液。由此可知,当MEA浓度为配比C~配比A范围之间,吸收负荷为0~0.11mol/L时,增加MEA浓度可显著提高TEA+ MEA混合胺液的CO2吸收速率,即配比为A的混合胺液具有最高的CO2吸收速率。
2.2.3 综合分析
综合分析2.2.1~2.2.2内容可得,在本文实验条件下,增加MEA浓度可对TEA+MEA混合胺液的CO2吸收负荷和CO2吸收速率产生不同程度的改善,配比为C的混合胺液表现出了最差的CO2吸收性能,配比为A的混合胺液与配比为B的混合胺液具有相近的CO2吸收负荷变化规律,但前者的CO2吸收速率整体上高于后者。因此综合看来,配比为A的TEA+MEA混合胺液CO2吸收性能相对最优,即配比A为TEA+MEA混合胺液的最佳胺液配比。
2.3 混合胺液循环性能实验
为考察胺液的稳定性,对上述筛选出来的配比为A的TEA+MEA胺液配方进行循环实验。循环吸收实验采用纯 CO2作为原料气,初始压力为0.21MPa,一次吸收后充压至1MPa。吸收后的富液全部进行再生,再次吸收时将胺液补充至初始量,重复3次完成循环实验。
2.3.1 吸收负荷随时间变化规律
图7为循环条件下配比为A的TEA+MEA混合胺液CO2吸收负荷随时间的变化曲线。
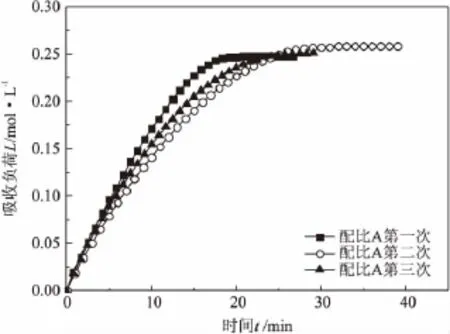
图7 循环条件下混合胺液的CO2吸收负荷随时间变化曲线
由图7可以看出,在3次循环实验中,TEA+ MEA混合胺液的CO2吸收负荷随时间的变化曲线趋势基本保持一致,均于20min左右达到平衡,其最终吸收负荷也均在0.25mol/L左右。在吸收达到平衡前,同一时刻混合胺液的CO2吸收负荷依次为:配比A混合胺液第1次>配比A混合胺液第3次>配比A混合胺液第2次。由此可知:循环次数对混合胺液的最终吸收负荷几乎无影响,说明经过循环后胺液的吸收能力保持稳定,循环性能良好;随着循环次数的增加,同一时刻混合胺液的CO2吸收负荷先减少后增加,但变化幅度均很小,说明循环次数对混合胺液的CO2吸收负荷有影响但影响不大;随循环次数的增加,混合胺液的CO2吸收完成时间先增加后减小,说明循环次数会对混合胺液的吸收完成时间产生一定的影响。
2.3.2 吸收速率随吸收负荷变化规律
图8为循环条件下配比为A的TEA+MEA混合胺液CO2吸收速率随吸收负荷的变化曲线。

图8 循环条件下混合胺液的CO2吸收速率随吸收负荷变化曲线
由图8可以看出,在3次循环实验中,混合胺液的CO2吸收速率随吸收负荷变化曲线的趋势基本一致,均随着吸收负荷的增加而逐渐下降,并于吸收负荷0.25mol/L左右处迅速降为0。同一吸收负荷下,混合胺液的CO2吸收速率依次为:配比A混合胺液第1次>配比A混合胺液第3次>配比A混合胺液第2次。由此可知:同一吸收负荷下,随着循环次数的增加,混合胺液的CO2吸收速率先下降后上升,但差距很小,说明循环次数对混合胺液的CO2吸收速率影响不大,混合胺液的吸收速率表现较稳定。
2.3.3 综合分析
根据 2.3.1~2.3.2有限次的循环实验结果对TEA/MEA为配比A的混合胺液CO2吸收性能对比分析可以得出,在循环实验中该混合胺液配方的CO2吸收负荷及CO2吸收速率均随循环次数变化较小,说明配比为A的TEA+MEA混合胺液配方性能稳定,具有良好的重复性,可在天然气脱碳工业中循环利用,实现胺液的合理、高效应用。
3 结论
本文以TEA为主体,添加MEA活化剂,在特定实验条件下,先后进行了MEA添加剂性能实验、TEA+MEA混合胺液配比优选实验及循环性能实验,通过实验结果的对比分析,对TEA+MEA混合胺液在天然气脱碳中的CO2吸收性能进行了研究,得到以下结论:
(1)TEA与MEA相比CO2吸收负荷更高,适宜作为混合胺液配方中的主吸收剂;MEA吸收反应完成所需时间更短,适宜作为混合胺液配方中的活化剂;TEA胺液中添加MEA活化剂可显著提高其CO2吸收速率,缩短吸收反应达到平衡所需的时间,且不会降低其最终CO2吸收负荷。
(2)在TEA+MEA混合胺液中,增加MEA的浓度可不同程度的改善其CO2吸收负荷和CO2吸收速率;在MEA浓度由大到小分别为配比A、配比B、配比C的3种混合胺液中,配比为A的混合胺液CO2吸收性能相对最优,即配比A为TEA+MEA混合胺液的最佳胺液配比。其配比筛选过程可为天然气脱碳工艺提供参考。
(3)在有限次的循环实验中,配比为A的TEA+ MEA混合胺液的CO2吸收负荷及CO2吸收速率均随循环次数变化较小,表现出了较稳定的胺液脱碳性能及较好的重复性,因此可作为良好的脱碳胺液配方在实际天然气脱碳工业中应用。
[1]高涵.有机胺法吸收二氧化碳及其性能研究 [D].上海:上海师范大学,2011.
[2]Luo P C,Zhang Z B,Jiao Z,et al.Investigation in the design of a CO2cleaner system by using aqueous solutions of monoethanolamine and diethanolamine[J].Ind Eng Chem Res,2003,42:4861-4866.
[3]onwilas A,Veawab A.Characterization and comparison of the CO2absorption performance into single and blended alkanolamines in a packed column[J].Ind Eng Chem Res, 2004,43:2228-2237.
[4]盖群英.醇胺溶液富集CO2的研究[D].大连:大连理工大学,2008.
[5]刘颖,王治红.天然气脱硫脱碳溶液研究进展与应用现状[J].广州化工,2012,40(7):30-32,40.
[6]Mandal B P,Biswas A K,Bandyopadhyay S S.Selective absorption of H2S from gas streams containing H2S and CO2into aqueous solutions of N-methyldiethanolamine and 2-amino-2-methyl-1-propanol[J].Sep Purif Technol, 2004,35(3):191-202.
[7]王遇冬,王登海.MDEA配方溶液在天然气脱硫脱碳中的选用[J].石油与天然气化工,2003,32(5):291-294,261.
[8]杜建鹏.醇胺法脱除天然气中硫化氢的研究 [D].上海:华东理工大学,2012.
[9]于淼,周理.天然气中H2S的脱除方法——发展现状与展望[J].天津化工,2002,9(5):18-20.
[10]马乐.MDEA为主体的混合胺法吸收CO2的研究[D].北京:北京化工大学,2011.
[11]陆诗建.醇胺溶液捕集烟道气中CO2实验研究 [D].东营:中国石油大学(华东),2010.
[12]Choi W J,Seo J B,Jang S Y.Removal characteristics of CO2using aqueous MEA/AMP solutions in the absorption and regeneration process[J].J Environ Sci,2009,21:907-913.
[13]陈杰,郭清,花亦怀,等.MDEA活化胺液在天然气预处理工艺中的吸收性能[J].化工进展,2014,33(1):80-84.
[14]花亦怀,郭清,冯颉,等.天然气脱碳单一胺液及混合胺液解吸性能研究[J].天然气化工(C1化学与化工),2014,39 (1):47-51.
Absorption properties of TEA+MEA mixed amine solution in removing CO2from natural gas
TANG Jian-feng,QING Xia,ZHANG Xin-jun,XU Ming-hai,HUANG Bin,LI Jing,SHI Ze-lin,YANG Fan
(College of Pipeline and Civil Engineering,China University of Petroleum(East China),Qingdao 266580,China)
In order to find out economic and efficient new-type?absorbent for removing CO2from natural gas,the mixed amine solutions composed of triethanolamine (TEA)and monoethanolamine (MEA)were studied.The absorption performances of the solutions of TEA,MEA and their mixtures were investigated experimentally.Results showed that adding MEA to TEA solution could significantly improve the CO2absorption effect,and the TEA+MEA mixed amine solution with the optimal TEA/MEA ratio exhibited better CO2absorption load and absorption rate as well as more stable CO2absorption performance.
TEA;MEA;mixed amine solution;natural gas;carbon dioxide;absorption property
TQ028.25
A
1001-9219(2015)05-24-05
2014-10-30;基金项目:国家工信部浮式液化天然气生产储卸 (LNG-FPSO)总体设计关键技术 (工信部联装[2012]534号),中央高校基本科研业务费专项资金资助(14CX05033A);作者简介:唐建峰(1973-),男,博士,教授,主要从事天然气预处理、LNG关键技术等研究工作,电话0532-86983173,电邮tangpaper@126.com。
