甲醇氧化直接合成甲缩醛反应体系热力学分析
2015-03-28邬长城王淑芳王延吉
邬长城,葛 松,王淑芳,王延吉
(河北工业大学化工学院,天津 300130)
甲醇氧化直接合成甲缩醛反应体系热力学分析
邬长城,葛 松,王淑芳,王延吉*
(河北工业大学化工学院,天津 300130)
甲醇氧化一步合成甲缩醛反应体系存在多个副反应。采用原子矩阵法确定了复杂反应体系中的6个独立反应,对反应体系的热力学进行了计算,并借助ChemCAD软件对反应体系进行了模拟计算,最后通过实验方法对热力学计算进行了验证。结果表明,在398.15~673.15K范围内,体系中的各个反应都能自发进行,且具有很大的平衡常数。但在反应相互竞争的情况下,甲缩醛的选择性非常低,产物组成主要受到催化剂性能和反应动力学的影响,适当提高反应温度是有利的。实验得出较适宜的温度是180℃。
甲缩醛;二甲氧基甲烷;一步合成;甲醇氧化;热力学;ChemCAD;模拟
甲缩醛(DMM),毒性很低,且在环境中不累积,能够生物降解,是一种环境友好的化学品,可被用作绿色汽油添加剂、有机溶剂和有机合成中间体[1-2]。随着甲缩醛生产工艺和应用技术的不断发展,其在能源和环境领域的应用也将会发挥更大作用。工业上,甲缩醛的生产首先是由甲醇在Ag或Fe-Mo催化剂上氧化得到甲醛,然后再由甲醇和甲醛在酸催化剂上经缩醛反应制得。由于该工艺路线长,能耗高,开发一步法合成甲缩醛工艺显得颇具吸引力。
目前,甲醇部分氧化一步合成甲缩醛工艺仍处于研究阶段,重点是催化剂的开发。该反应所采用的催化剂主要有钒基氧化物催化剂、贵金属催化剂、杂多酸催化剂等[3-4],也有采用Fe-Mo系氧化物作为催化剂的研究[5]。在工艺方面,大部分研究在气相条件下固定床反应器中进行,也有采用液相反应的报道[6-7]。Deshmukh[8]和Cozzolino[9]在分别对Fe-Mo和V-Ti催化剂上甲醇部分氧化生成甲醛的反应动力学研究的过程中,建立了生成甲缩醛副反应的动力学方程式。郑妍妍等[10]研究了甲醇和甲醛反应制备甲缩醛的热力学,但没有甲醇氧化直接合成甲缩醛反应体系的热力学分析。本文对甲醇一步合成甲缩醛反应体系进行热力学分析,以便为反应工艺条件的优化提供理论基础和指导。
1 复杂反应网络分析
甲醇氧化一步合成甲缩醛反应方程式为:
3CH3OH+1/2O2→CH3OCH2OCH3+2H2O
刘海超[11]推测了其反应机理,认为反应的第一步是甲醇在催化剂的氧化还原位上生成甲醛,第二步是生成的甲醛和甲醇在催化剂的酸性位经由半缩醛的形式生成甲缩醛。如果氧化还原位占主导,则会生成较多的氧化副产物甲醛和甲酸甲酯;如果酸性位占主导地位,则会有较多的脱水副产物二甲醚生成。该体系反应网络如图1所示。
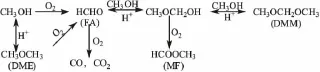
图1 甲醇氧化反应网络
根据文献[12-14]报道可知,在甲醇氧化一步法制备甲缩醛反应体系中存在 O2、CH3OH、H2O、CH3OCH3、HCHO、HCOOCH3、CH3OCH2OCH3、CO、CO2九种物质,原子系数矩阵如表1所示,表2为对其进行初等变换得到的矩阵。

表1 甲醇氧化一步法制备甲缩醛反应体系原子系数矩阵
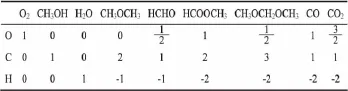
表2 经初等变换得到的反应体系原子系数矩阵
该矩阵的秩为3,所以存在的独立反应数为6。因此,可以选择如下独立反应:

2 热力学数据来源与计算方法
2.1 各物质气态标准生成焓ΔfHm(g)、标准熵Sm(g)和标准生成自由能ΔfGm(g)
各物质的标准摩尔生成焓和标准熵由文献[10,15-17]中获得,如表3所示。
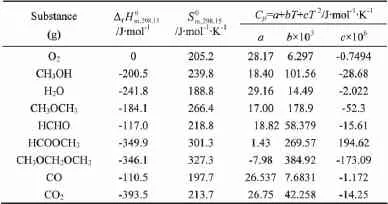
表3 气态物质的热力学数据
2.2 各反应焓变、熵变、吉布斯自由能变和平衡常数的计算
298.15K下反应的热力学数据可以通过式 (1)~(4)计算得到,结果见表4。
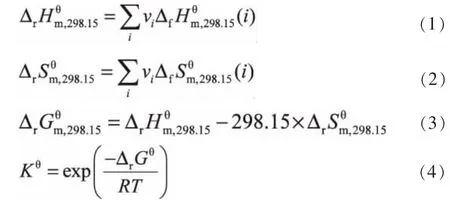
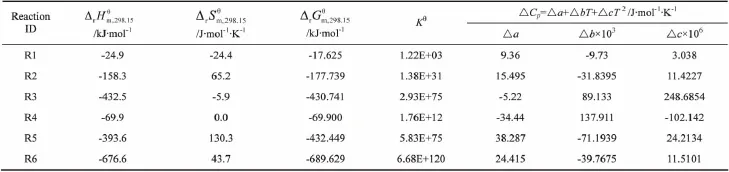
表4 298.15K下反应的热力学数据
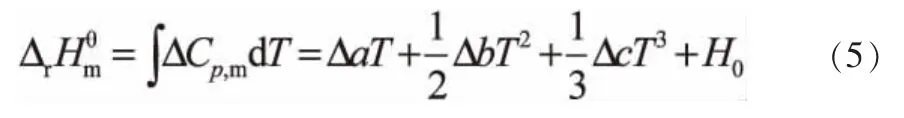
其中,H0为积分常数,可由298.15K时对应的反应焓变 ΔrHθm,298.15求得,见表5。

其中,G0为积分常数,可由298.15K时对应的反应吉布斯自由能求得,见表5。
不同温度下反应的平衡常数Kθ的计算式可根据式(4)得到。
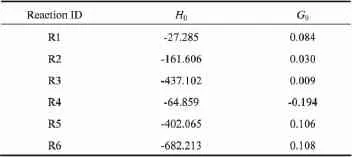
表5 各反应、与温度关系式中的积分常数
3 结果与讨论
3.1 温度对反应焓变的影响
图2是温度对各反应焓变的影响情况。由图可见,在398.15~673.15K范围内,各反应都是放热反应,而且随温度升高,反应焓变都逐渐减小,其中生成甲酸甲酯的反应(R3)焓变的变化较为明显。在热力学上,降低温度对反应是有利的。另外,由于反应的放热性,采取较低的操作温度,并注意及时移出反应热有利于防止飞温引起的爆炸事故。
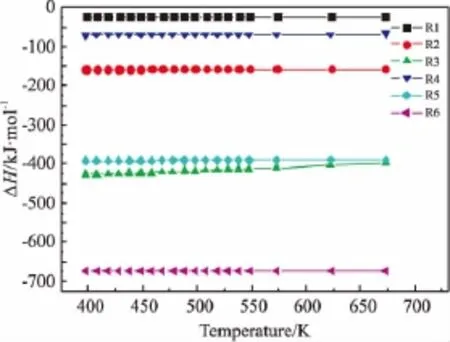
图2 温度对反应焓变的影响
3.2 温度对反应吉布斯自由能变的影响
图3是温度对反应吉布斯自由能的影响情况。由图可见,不同温度下各反应的吉布斯自由能都为负值,说明反应都可以自发进行。随着温度的升高,除了甲醇脱水反应(R1)外,其它所有反应吉布斯自由能变绝对值都在增大,说明反应变得更加容易;而R1吉布斯自由能变的绝对值在减小,说明其在高温下的反应趋势将会减弱,提高反应温度在一定程度上可以抑制二甲醚的生成。
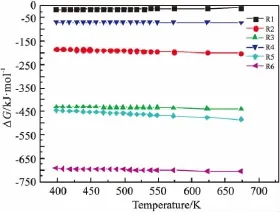
图3 温度对反应吉布斯自由能变化的影响
3.3 温度对反应平衡常数的影响
图4是温度对反应平衡常数的影响。由图可见,各反应的平衡常数都很大,虽然随着温度的升高,平衡常数呈降低趋势,但反应物几乎仍可以完全转化。所以,反应产物的分布将主要受动力学控制。从热力学方面看,完全氧化生成CO和CO2的反应在热力学上是最有利的,而生成二甲醚的脱水反应(R1)和醇醛缩合生成甲缩醛的反应(R3)平衡常数较小,表明其受热力学限制最严重。在生成有机产物的反应 (R1)~(R4)中,生成甲酸甲酯MF的反应(R3)平衡常数最大,但提高温度其平衡转化率下降速度也最快,表明该反应受温度影响更为明显。目标反应(R4)的平衡常数虽然也有所降低,但相对较小,所以提高反应温度可能会有利于甲缩醛的选择性升高。
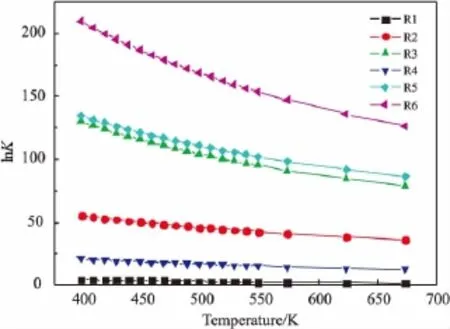
图4 温度对平衡常数的影响
4 反应体系的软件模拟与实验验证
采用ChemCAD模拟软件中的Gibbs反应器模型模拟(R1)~(R4)同时存在的反应体系中各产物的选择性情况,结果如图5所示。由图可见,主要生成产物是二甲醚和甲酸甲酯,而甲缩醛选择性最低。随温度升高,二甲醚选择性有所降低,这与前述的热力学分析结果一致,但是二甲醚仍是主要产物。甲醛的选择性在200℃以上会急剧升高,而甲缩醛的选择性虽然有所升高,但非常微弱。由此可见,在热力学控制的反应体系中,甲醇直接氧化制甲缩醛反应是比较困难的,提高反应的选择性需要有良好的催化剂存在。而且,虽然升高温度能在一定程度上改善甲缩醛选择性,但反应温度不宜过高,因为可能会生成更多的甲醛,而甲醛与甲醇反应生成甲缩醛的平衡转化率也会随着温度的升高而降低[10]。另外,提高温度也会生成更多深度氧化的副产物CO或CO2。从甲缩醛生成机理考虑,甲醇氧化首先要经过中间产物甲醛,提高温度对此反应是有利的,但若要使反应继续向生成甲缩醛的方向进行,需要增大催化剂的酸性位数量,才能满足氧化反应与醇醛缩合反应的匹配。
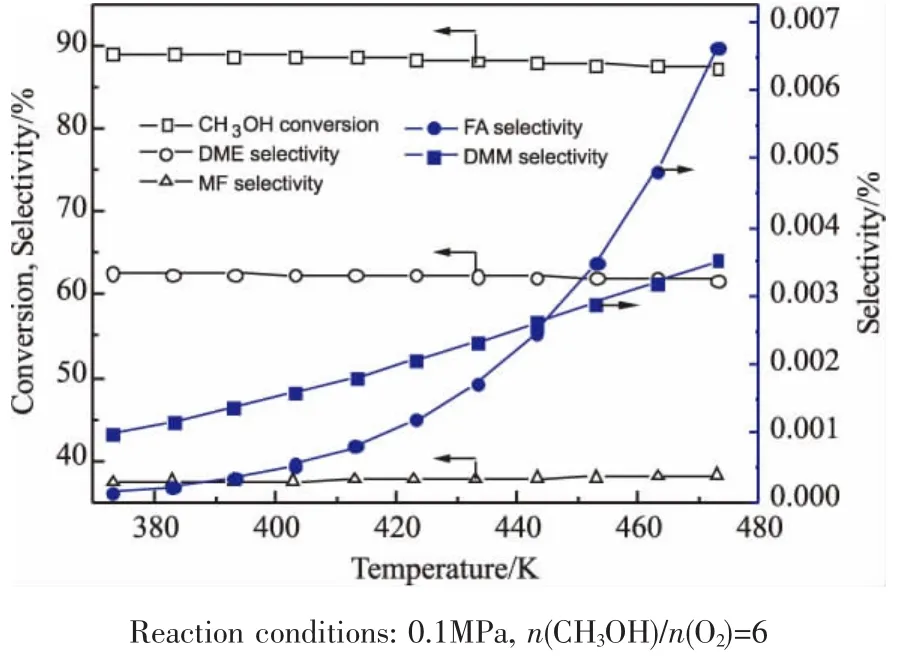
图5 温度对产物选择性的影响
以硅铝氧化物负载的V2O5为催化剂,在固定床反应器上考察了反应情况,结果如表6所示。随着温度的升高,甲醇的转化率逐渐升高。反应温度从140℃升高到160℃时,甲缩醛的选择性升高,而二甲醚的选择性降低,这与热力学分析结果一致。而继续升高温度,二甲醚和甲酸甲酯的选择性又会升高,但仍低于其平衡状态下的选择性,同时又有少量CO2生成。由此可以推断,升高温度提高了反应速度,从而使反应更接近平衡状态。考察的实验条件下,反应都未能达到平衡状态,此时动力学控制对反应产物分布起到了主要作用。因此,综合考虑热力学和动力学双重因素的共同作用,兼顾较好的甲醇转化率情况下,认为180℃是较适宜的反应温度。

表6 不同温度下的反应结果
5 结论
(1)甲醇氧化反应体系中存在的6个独立反应都是放热反应,反应能够自发进行,且具有很大的平衡常数。
(2)在吉布斯自由能最小化原则下,只考虑生成有机产物的情况时,热力学控制的反应体系中主要产物是二甲醚,而生成甲缩醛的选择性很小。
(3)催化反应体系中的产物分布受催化剂性能和动力学的影响,适当升高温度有利于甲缩醛选择性的提高,实验确定较适宜的温度是180℃。
[1]杨丰科,李金芝,曹伟丽.甲缩醛的研究进展[J].应用化工,2011,40(10):1833-1836.
[2]廉海昆,龙慧敏.甲缩醛生产技术和应用进展[J].天然气化工(C1化学与化工),2012,37(5):68-70.
[3]付鹏,谢璇,李永刚,等.甲醇直接氧化制备二甲氧基甲烷催化剂研究进展[J].化学世界,2013,(6):380-384.
[4]李美兰,邓志勇,翟刚,等.甲醇一步氧化制甲缩醛金属催化剂研究进展 [J].天然气化工 (C1化学与化工), 2014,39(6):82-89.
[5]Thavornprasert K A,Capron M,Louise J D,et al.Highly productive iron molybdate mixed oxides and their relevantcatalytic properties for direct synthesis of 1,1-dimethoxymethane from methanol[J].Appl Catal B,2014, 145:126-135.
[6]Prado N T,Nogueria A F,Nogueira A E,et al.Modified niobia as a new catalyst for selective production of demithoxymethane from methanol [J].Energy Fuels, 2010,24:4793-4796.
[7]刘鹏,邓志勇,杨先贵,等.CuCl/肟配合物催化甲醇液相一步氧化生成二甲氧基甲烷[J].天然气化工(C1化学与化工),2013,38(6):16-19.
[8]Deshmukh S A R K,Annaland M V S,Kuipers J A M. Kinetics of the partial oxidation of methanol over a Fe-Mo catalyst[J].Appl Catal A,2005,289:240-255.
[9]Cozzolino M,Tesser R,Di Serio M,et al.Kinetics of the oxidative dehydrogenation (ODH) of methanol to formaldehyde by supported vanadium-based nanocatalysts [J].Catal Today,2007,128:191-200.
[10]郑妍妍,张宏达,王金福.二甲氧基甲烷合成反应的热力学分析[J].天然气化工(C1化学与化工),2013,38(1):7-10.
[11]Liu H C,Iglesia E.Selective one-step synthesis of dimethoxymethane via methanolor dimethylether oxidation on H3+nVnMo12-nPO40keggin structures[J].J PhysChem B,2003,107:10840-10847.
[12]Kaichev V V,Popova G Y,Chesalov Y A,et al.Selective oxidation of methanol to form dimethoxymethane and methyl formate over a monolayer V2O5/TiO2catalyst[J].J Catal,2014,311:59-70.
[13]Zhao Y B,Qin Z F,Wang G F,et al.Catalytic performance of V2O5/ZrO2-Al2O3for methanol oxidation[J]. Fuel,2013,104:22-27.
[14]Meng Y L,Wang T,Chen S,et al.Selective oxidation of methanoltodimethoxymethaneon V2O5-MoO3/γ-Al2O3catalysts[J].Appl Catal B,2014,160-161:161-172.
[15]天津大学物理化学教研室.物理化学(上册)[M].第三版.北京:高等教育出版社,1992.
[16]赵彦巧,陈吉祥,张继炎.二氧化碳加氢直接合成二甲醚反应体系的热力学[J].天津大学学报,2006,39(4):408-413.
[17]张映珊,王乐夫.膜反应器对甲醇脱氢制甲酸甲醋平衡移动的影响[J].天然气化工(C1化学与化工),1993,18(6): 27-30.
Thermodynamics of reaction system for oxidation of methanol to methylal
WU Chang-cheng,GE Song,WANG Shu-fang,WANG Yan-ji
(School of Chemical Engineering and Technology,Hebei University of Technology,Tianjin 300130,China)
Several side reactions exist in the reaction system of one-step oxidation of methanol to methylal.Six independent reactions were determined by the atomic coefficient matrix method,and a thermodynamic calculation was conducted for this complicated reaction system.The ChemCAD software was used to simulate the products distribution.Experiments were carried out to test the results of thermodynamics and simulation.Results showed that each reaction could spontaneously happen under 398.15-673.15K with a large equilibrium constant,however,the selectivity of methylal was very low because of the competition between the reactions.The products distribution was mostly influenced by the performance of catalyst and the kinetics,and properly elevating the temperature could be in favor of the synthesis of methylal.The optimal temperature determined by the experiments was 180℃.
methylal;dimethoxymethane;one-step synthesis;methanol oxidation;thermodynamics;ChemCAD;simulation
TQ223.121;O642
A
1001-9219(2015)05-19-05
2015-03-17;基金项目:河北省高等学校科学技术研究项目 (QN2014144);作者简介:邬长城(1977-),男,博士,讲师,电话 13821534550,电邮 greatwu5@163.com;*
王延吉 (1962-),男,博士生导师,教授,电邮yjwang@hebut.edu.cn。
